氯化钙调节肠道微生物组成对高脂肪饮食诱导的小鼠肥胖的影响
马春丽 扈瑞平 苑红 张竞男 包玉龙 董超 徐宋瑶 李丽
内蒙古医科大学基础医学院(呼和浩特010110)
随着生活水平的提高和生活方式的改变,高脂肪饮食和久坐不动的生活方式引起的肥胖及相关代谢疾病越来越多。肥胖的根本原因包括由于遗传或环境因素导致的能量储存高于消耗,以及身体脂肪细胞的过度增殖和分化,最终导致体质量增加。肠道微生物群由数以万亿计的细菌组成,通过调节养分吸收、能量和脂肪储存,影响宿主的养分消化和能量代谢。因此,它在肥胖和相关代谢疾病的发展中起着重要作用[1-3]。研究发现,与非肥胖者相比,肥胖者的微生物群较少[4]。在无菌小鼠中,高能量和高脂肪饮食诱导的体质量增加和脂肪积累受到抑制。当将肥胖小鼠的微生物群移植到无菌小鼠中时,肥胖表型也发生了转移。此外,在减少Akkermansia 和拟杆菌数量、增加Oscillospira 丰度时,小鼠发生肥胖。这些研究表明微生物群在肥胖的发展中起着重要作用。同时,肥胖会导致血清脂多糖浓度升高,脂多糖是革兰氏阴性菌外膜的主要成分,脂多糖可能导致代谢炎症。研究表明,拟杆菌可以通过产生短链脂肪酸(SCFAs)为身体提供能量来促进健康,抑制LPS诱导的肠上皮细胞炎症[5-9]。这些结果表明,调节肠道微生物群可能是预防肥胖和肥胖相关代谢综合征的重要措施。
此外,饮食干预有助于调节细菌分布[10]。因此,通过饮食治疗或使用更有针对性的方法,如给予特定的细菌菌株来改善营养成分,可能是对抗肥胖的一种新的、更有效的方法。钙离子是人体的重要营养元素,膳食钙摄入量与体重、体脂或体重指数正相关。有人认为钙会增加粪便能量损失,并导致能量失衡[11],但是钙离子如何影响肥胖机体肠道菌群变化以及介导机体肥胖未见报道。本文主要研究氯化钙是否可以通过调节肠道微生物群来改善肥胖。
1 材料与方法
1.1 材料
1.1.1 实验材料 30 只C57bl ∕6J 雄性小鼠,购自北京斯贝福生物技术有限公司。
1.1.2 试剂 氯化钙为sigma 试剂;小鼠脂多糖(LPS)ELISA 试剂盒,小鼠白细胞介素1β(IL-1β)ELISA 试剂盒;小鼠免疫球蛋白G(IgG)ELISA 试剂盒,小鼠免疫球蛋白M(IgM)ELISA 试剂盒;小鼠胰岛素(INS)ELISA 试剂盒,小鼠白细胞介素6(IL-6)ELISA 试剂盒,小鼠生长激素(GH)ELISA 试剂盒;甘油三酯(TG)含量检测试剂盒;总胆固醇(total cholesterol,TC)含量测定试剂盒,均为酶免品牌试剂盒。TransZol(全式金),氯仿(国药集团),异丙醇(沪试),无水乙醇(CNW)DEPC 水(生工生物),反转录试剂盒(Takara),普通PCR 试剂(生工生物),qPCR 试剂(Takara)
1.1.3 仪器 超低温冰箱(Forma 900 series,Thermo Fisher Scientific),酶标仪(Multiskan FC,Thermo Fisher Scientific),恒温培养箱(DNP型,精宏),DNA∕protein analyier(SMA4000 Merinton),PCR 扩 增 仪(ETC811,苏州东胜),qPCR 仪(7300 plus Thermo),涡旋仪(0003340025,IKA VORTEX 3),低速掌上离心机(DWB,D1088),电泳电源(DYY-6D 型,北京六一生物科技),化学发光成像仪(ChemiScope6200,上海勤翔科学仪器有限公司)
1.2 实验方法
1.2.1 动物实验设计 将雄性C57BL∕6 野生型小鼠鼠房中饲养:温度(25 ± 2)℃,相对湿度(55 ±10)%,12 h光照∕12 h黑暗的明暗循环。自由饮水,自由饮食标准饲料适应性喂养7 d,将30 只小鼠随机分为对照组(C)、模型组(M)、氯化钙处理组(D),每组10只。C组喂标准饲料和饮用水,M组喂高脂饲料和饮用水,D组喂高脂饲料和1.5 g∕100 mL氯化钙。连续喂养11 周,11 周后采样。取样前12 h 禁食。收集小鼠粪便于离心管中用于高通量测序。记录小鼠体质量。断头取血收集于离心管中,静置30 min,于4 ℃、3 000 r∕min 离心15 min,分离血清。迅速剥离脾脏、肾脏周围脂肪组织,并称质量。
1.2.2 生化分析和细胞因子测量 TG、TC、LDL-C、HDL-C 采用全自动生化分析仪测定。LBP、TNF-α、IL-6、IL-1β 和IFN-γ 使用商业ELISA 试剂盒(酶免品牌)定量。
1.2.3 肠道微生物群分析 11 周实验结束时,从每组中选择3 个小鼠粪便样品进行微生物群16S rRNA。CTAB∕SDS 方法提取总细菌基因组DNA,1%琼脂糖凝胶电泳评估DNA 提取数量和质量,DNA 终浓度1 μg∕μL。选取特定的引物16S V4:515F-806R(5′-ACTCCTACGGGAGGCAGCAG)扩增16S rRNA 的16S V4∕16S V3∕16S V3-V4∕16S V4-V5区域。使用TruSeq®DNA PCR-Free Sample Preparation Kit(Illumina,USA)进行文库构建,Qubit@2.0 Fluorometer(Thermo Scientific)和Agilent Bioanalyzer 2100 系统对文库进行评估,Illumina NovaSeq测序。原始读取被存入NCBI 序列读取存档(SRA)数据库。原始16S rRNA 基因测序读数经过多路分解、质量过滤和合并。对具有97%相似性的操作分类单元(OTU)进行聚类,识别并删除嵌合序列。
1.3 统计学方法 通过Perl 语言和R 语言软件进行分析,分析样品内物种丰富度、均匀度和多样性、不同样品间的共有和特有OTU 等信息。采用SPSS 16.0 软件对数据进行统计分析,计量资料表示为均数±标准差,比较行单因素方差分析,并进行Tukey′s 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 氯化钙抑制高脂肪饮食诱导的小鼠体质量增加 研究结束时,高脂饮食喂养的雄性小鼠体质量显著高于标准饮食喂养和高脂饮食喂养+1.5 g∕100 mL 氯化钙喂养的小鼠,氯化钙+高脂饮食小鼠体质量与标准饮食小鼠体质量差异有统计学意义(P<0.05),说明氯化钙减少了高脂饮食喂养小鼠的体质量增加。见图1。
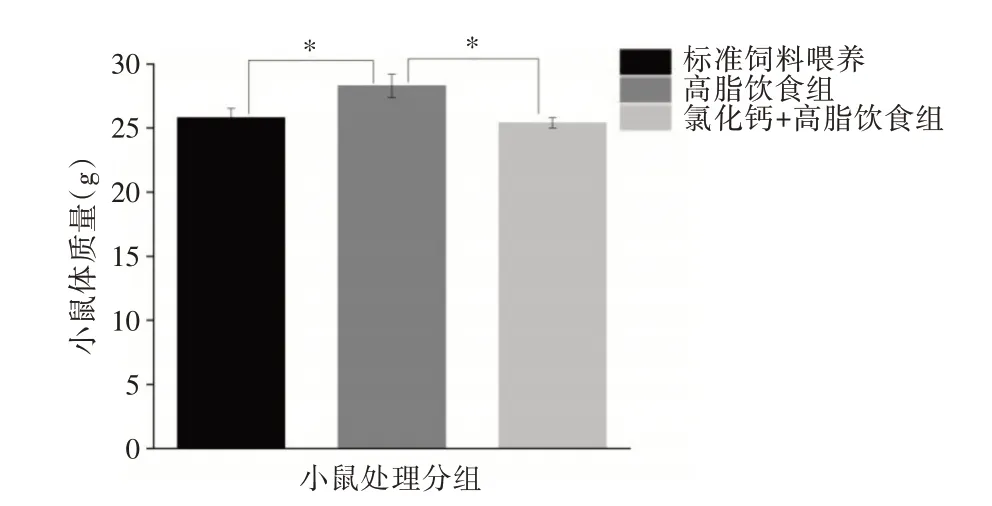
图1 小鼠体质量数据Fig.1 Mouse body weight data
2.2 氯化钙防止高脂饮食介导的小鼠脂肪组织增加 由于氯化钙降低了高脂饮食喂养的小鼠体质量,通过称量脂肪质量可知体质量增加的减少是否由于脂肪组织质量的减少。与标准饮食喂养组相比,高脂饮食显著增加了肝脏、附睾、肾脏和肠系膜脂肪的重量。氯化钙+高脂饮食组与高脂饮食组小鼠相比,脂肪重量明显降低,表明氯化钙降低了高脂饮食诱导的脂肪量增加。脂肪量与喂食氯化钙相关,氯化钙诱导的体质量增加减少可归因于脂肪组织质量的减少。结果显示,与高脂饮食组相比,氯化钙显著降低体内脂肪质量(P<0.05),表明氯化钙可能抑制了体内脂肪生成。见图2。

图2 小鼠脂肪数据Fig.2 Mouse fat data
2.3 氯化钙改善高脂饮食喂养小鼠的血清脂质并减轻全身炎症 肥胖伴随着血清脂质、血糖水平和炎性细胞因子水平的升高。与标准饮食喂养组相比,高脂饮食喂养组小鼠血清TC、血糖、IL-6、IL-1β 显著升高,与标准饮食组差异有统计学意义(P<0.05)。与高脂饮食组相比,氯化钙+高脂饮食组血清脂质水平(TC)、血糖和全身炎症指标(IL-6、IL-1β)明显降低(P<0.05)。表明氯化钙能使高脂小鼠TC、血糖、IL-6、IL-1β 降低。见图3。
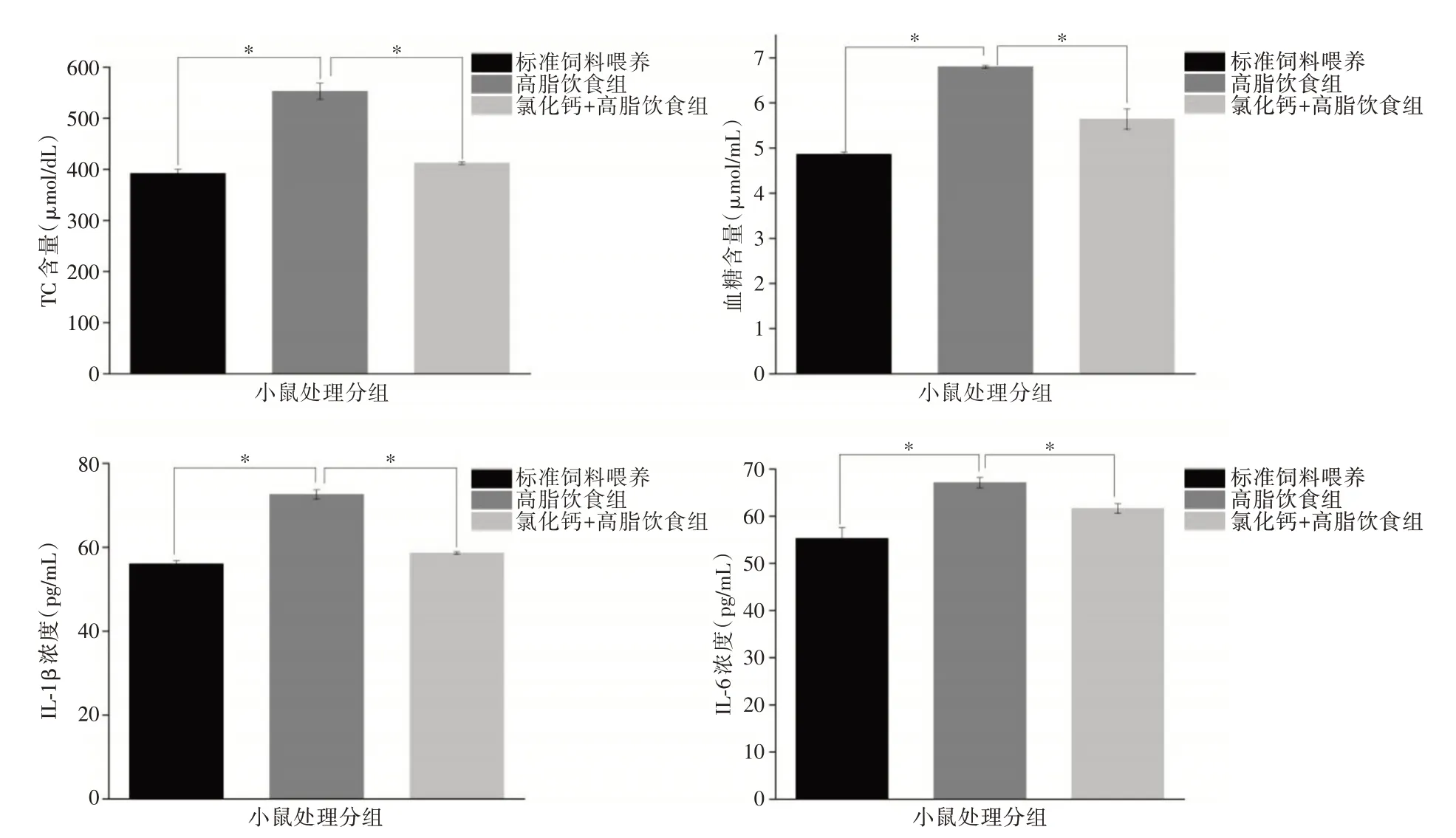
图3 脂质、血糖水平和炎性细胞因子变化Fig.3 Changes in lipids,blood sugar levels and inflammatory cytokines
2.4 氯化钙改善高脂饮食喂养小鼠的血清IgM和IgG 升高 与标准饮食喂养组相比,高脂饮食喂养组小鼠血清IgM 和IgG 降低,与标准饮食组差异有统计学意义(P<0.05)。与高脂饮食组相比,氯化钙+高脂饮食组血清IgM 和IgG 升高,说明氯化钙在高脂饮食中升高了IgM 和IgG 水平(P<0.05)。见图4。

图4 血清IgM 和IgG 变化Fig.4 Serum IgM and IgG changes
2.5 氯化钙改善高脂饮食喂养小鼠的血清脂多糖浓度的升高 与标准饮食喂养组相比,高脂饮食喂养组小鼠血清LPS 显著升高,与标准饮食组差异有统计学意义(P<0.05)。与高脂饮食组相比,氯化钙显著降低了血清LPS水平(P<0.05)。见图5。
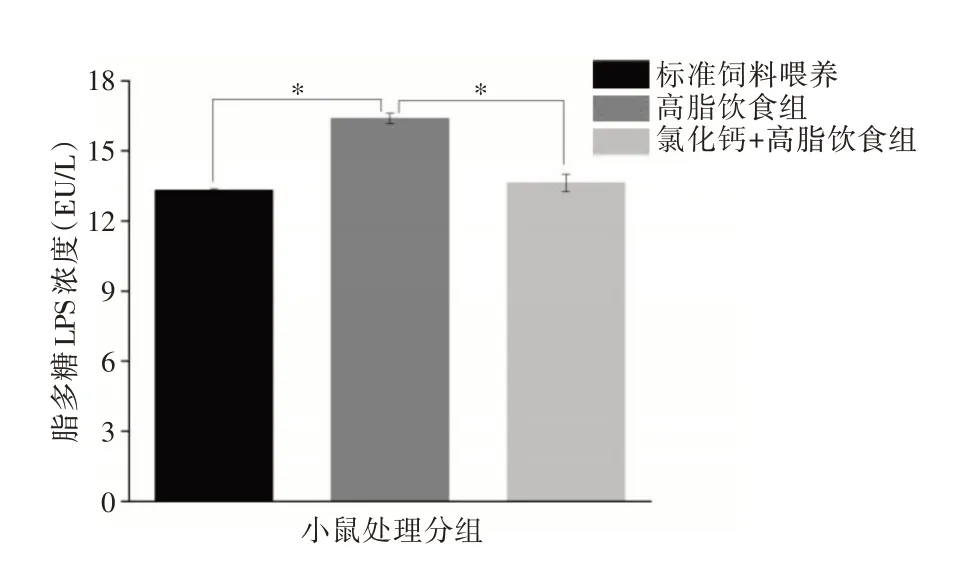
图5 血清脂多糖浓度变化Fig.5 Changes in serum lipopolysaccharide concentration
2.6 氯化钙改善肥胖小鼠肠道微生物群组成 在喂养11 周后,对小鼠粪便样本进行测序,以阐明标准饮食、高脂饮食和高脂饮食补充氯化钙对肠道微生物群结构的影响。门和属含量前十的菌群物种相对丰度见图6、7。厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)、变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)、脱硫球菌门(Desulfobacterota)是最丰富的门,它们存在于所有组中。厚壁菌门和拟杆菌门是人体肠道中最重要的两个细菌门,占85.6%。高脂饮食组的厚壁菌门比例从41.2% 增加到61.8%,拟杆菌门的比例从44.4%下降到13.7%。高脂饮食+氯化钙组小鼠肠道微生物群谱存在差异,厚壁菌门比例为58.1%,变性菌门比例低至0.9%,放线菌门升高至7.1%。见表1。同时,从属中可以看到双歧杆菌属(Bifidobacterium)比例升高,标准饮食组为3.9%,氯化钙+高脂饮食组为8.9%。表明氯化钙可能通过调节放线菌门来抑制体质量增加。
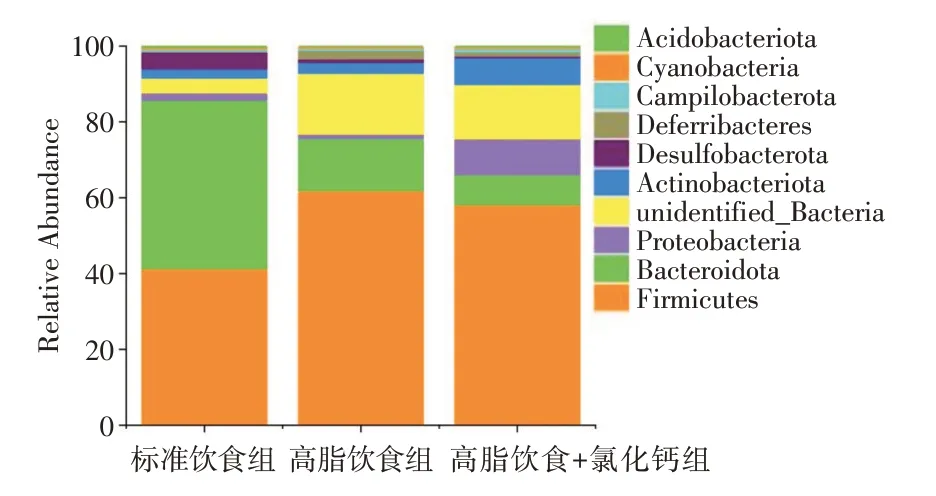
图6 肠道菌群门水平丰度Fig.6 Relative abundances of the gut microbiota at the phylum level

表1 小鼠肠道厚壁菌门、拟杆菌门、变形菌门、放线菌门、脱硫球菌门所占比例Tab.1 Percentage of Firmicutes,Bacteroidota,Proteobacteria,Actinobacteriota,Desulfobacterota in the mouse intestine %
3 讨论
肥胖是一种皮下或腹部脂肪组织过度堆积的状态。这种脂肪组织主要用于储存能量,当前认为这些脂肪组织参与调节生理和病理过程,包括免疫和炎症[12]。饮食在肥胖和其他病理生理状况中起着关键作用。健康的饮食和一些营养素通常被认为是有益的[13]。
本研究主要探讨钙的补充对高脂饮食小鼠体质量、脂肪、生化指标、炎症因子及肠道菌群的影响。结果显示,高脂饮食组体质量增加、体内脂肪的重量以及TC 含量均显著增加。氯化钙干预后,相比高脂饮食组,小鼠体重降低、体内脂肪质量降低、TC 较低,同时,钙的补充增加了双歧杆菌丰度,降低了拟杆菌丰度。
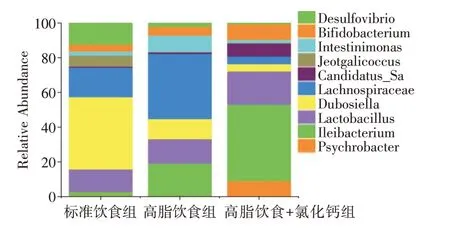
图7 肠道菌群属水平丰度Fig.7 Relative abundances of the gut microbiota at the genus level
研究表明,肠道微生物群在肥胖中扮演着重要角色[14],饮食对其组成有重大影响[15]。高脂饮食喂养的小鼠由于长期摄入过多造成能量过剩,被转化为脂肪储存在体内。在饮食肥胖的动物中补充钙有利于微生物和宿主代谢之间的相互作用,通过补充钙制剂能够增加肠道中潜在的有益细菌,进而促进肠道ANGPTL4 的诱导。这两种作用都与宿主动物血浆内毒素LPS 水平较低和表型较瘦有关。同时,钙的摄入量减少了Firmicus 门的代表性细菌梭状芽孢杆菌(Clostridium spp.)[16],钙对放线杆菌、双歧杆菌两种细菌的生长具有益生作用,说明钙为它们的生长提供了适宜的环境。双歧杆菌属(Bifidobacterium spp.)可以降低内毒素血症和炎症张力,内毒素是一种细菌衍生的分子,参与了肝脏组织中轻度炎症的发生。同时,与脂多糖和肠道ANGPTL4 呈负相关,后者被认为是一种潜在的脂肪调节因子。在高脂饮食下,ANGPTL4的表达减少,而补充具有益生素特征的化合物刺激其表达,从而抑制LPS 活性并降低脂肪酸摄取。高脂肪饮食引起的肥胖与慢性低度炎症状态有关,巨噬细胞逐渐浸润到肥胖的脂肪组织,释放细胞因子,如IL-1β、IL-6 和TNFα,创造一个促炎环境,炎症的产生容易导致胰岛素抵抗。本实验中氯化钙能够增加双歧杆菌属丰度,降低LPS 增多触发的炎症[17-18];同时,细菌也能通过调节LPS影响炎症,LPS 是革兰氏阴性细菌如拟杆菌门的主要组成成分,有研究报道肥胖个体中厚壁菌门∕拟杆菌门比例较大,本研究发现高脂饮食+钙离子小鼠中拟杆菌数目进一步降低,可能通过拟杆菌门的降低引起LPS 降低,降低炎症的发生。
血清免疫球蛋白(Igs)在通过中和病原体调节免疫反应中起关键作用[19],有研究发现肥胖和高甘油三酯血症人群中发现血清免疫球蛋白A(IgA)浓度升高[20],而在血脂异常的情况下观察到不同浓度的免疫球蛋白M(IgM)。肥胖受试者免疫功能降低,免疫球蛋白IgM 较正常人群相比降低,本研究IgM 结果与前述研究相符,高脂+钙离子饮食下,IgM 水平升高。
综上所述,本研究结果支持了钙摄入量有助于对抗老鼠肥胖的假设。钙离子能够调节肠道菌群结构,与高脂饮食相比,高脂饮食+钙离子使小鼠IgM 和IgG 升高、炎症因子降低,提高免疫能力,抑制LPS 引起的肠道炎症,控制肥胖发展。

