血红蛋白Ube⁃2复合CD37杂合子异常血红蛋白的分子诊断及其家系分析
陈晴晴 冼嘉嘉 王燕超 何健淳 何文智 李少英 黎青
广州医科大学附属第三医院妇产科,广东省重大疾病重点实验室(广州 510150)
地中海贫血(简称“地贫”)是最常见的单基因遗传病之一,世界范围内大约有5%的人群有异常血红蛋白病,其中2.9%是地贫引起的。每年约有300 000~400 000 例异常血红蛋白疾病的婴儿出生[1]。在中国,地贫存在地区差异性分布,其中以“两广”及海南为高发区,广东省α 和β 地贫的人群基因携带率分别是8.53 %和2.54 %[2]。由于地贫的疾病特点为小细胞、低色素贫血,因此地贫基因携带者或患者常伴有血液学指标的改变。异常血红蛋白会导致贫血等症状,严重的贫血会引起胎儿的发育异常。比如目前已知的巴氏水肿胎、胎儿重度β 地贫等,在临床上是建议终止妊娠的。所以对于南方地区,特别是广东、广西及海南的人群进行地贫筛查尤为重要。人群筛查的目的主要是确定夫妻双方生育后代患严重地中海贫血的风险[3]。周艳洁等[4]通过观察对比分析大人群地中海贫血筛查的方法发现通过红细胞平均体积筛选出阳性人群做血红蛋白电泳,再针对电泳结果做α 地贫基因检测的方法在人力、经济、干预地贫胎儿效果上更有优势。
临床上筛查地贫的常用方法是血液样本检验,地贫相关的血液检验指标包括:血红蛋白、平均红细胞体积(MCV)、平均红细胞血红蛋白(MCH)、血红蛋白A2(HbA2)等。MCH 及MCV 是最常用的指标,若MCV 小于80 fL 和/或MCH 小于27 pg 表明筛查结果阳性[5],需进行HbA2 检测判断患者是否为β⁃地中海贫血携带者[6]。HbA2 值高于3.4%~3.6%被认为是β⁃地贫携带者,可通过DNA 基因分析进行明确诊断[7]。在一些情况下,比如α⁃地贫合并β⁃地贫,MCV 可以处于临界范围,HbA2 在正常范围,这可能是因为两种地贫之间存在相互作用。
地贫的诊断需要结合血液学表现、血红蛋白电泳及DNA 基因分析[8],对于临床上可疑的血液指标结果需要进一步行地贫基因诊断。地贫基因诊断方法目前有常规范围的地贫基因诊断,包括3种缺失型α⁃地贫基因突变类型、非缺失型α⁃地贫基因3 种常见突变类型和β⁃地贫基因17 种常见突变类型。但是这种常规的α、β 地中海贫血基因检测方法仅能覆盖约95%的地贫基因缺陷,仍有5%左右的其他型别未能覆盖。所以对于常规检测方法检测不出的基因类型,需进行DNA 测序方法进一步诊断。
随着基因检测技术的发展,越来越多未知的地贫基因类型被发现。血红蛋白Ube⁃2(Hb Ube⁃2)就是被发现的罕见型别之一。Hb Ube⁃2 首先由MIYAJI 等[9]在日本发现,1981年日本IUCHI 等研究者报道了日本第2 例Hb Ube⁃2(α68[E⁃17]ASN→ASP),其α 链N 端第68 位的门冬酰胺被门冬氨酸所替代(α68Asn→Asp)。Hb Ube⁃2是广东省较常见的三种α⁃珠蛋白变异体之一[10],国内首次报道的Hb Ube⁃2 是在广东省湛江发现的。在对深圳地区异常血红蛋白病的调查研究中,深圳地区20 734例筛查样本中发现1 例Hb Ube⁃2 复合CD118 杂合子异常血红蛋白[11],可见Hb Ube⁃2 型异常血红蛋白类型的罕见。
在现存的文献中还未发现有Hb Ube⁃2 复合CD37 杂合子异常血红蛋白的相关报道。本文先证者的异常血常规结果与未检测出地中海贫血类型相矛盾,患者的血红蛋白、MCH 及MCV 都低于正常值范围的下限,为轻度贫血,患者的HbA2(%)显著升高,这引起了笔者的关注,并进一步对其家系进行DNA 基因测序,以望找到患者血常规结果异常的病因及其分子遗传特点,并评估后代发生重度地贫的风险。
1 资料与方法
1.1 一般资料选取该家系三代成员,先证者、先证者之妻、先证者之父、先证者之母、先证者之子、先证者之弟、先证者之弟媳、先证者之侄女共八个成员。
1.2 常规方法检测地贫基因型
1.2.1 仪器及试剂血细胞分析仪(NX⁃9000,Sys⁃mex,日本),全自动毛细管电泳仪(Capillarys 2 Flex Piercing,Sebia,法国),离心机(Eppendorf 5240,德国),PCR 扩增仪(ABI9700,美国),凝胶成像分析系统(Bio⁃rad,美国),水平电泳槽及电泳仪(Bio⁃rad,美国),恒温水浴箱。全血基因组DNA 提取试剂盒(QIAGEN,德国),地贫基因检测试剂盒购于亚能生物技术(深圳)有限公司,试剂均为厂家原装配套试剂。
1.2.2 血红蛋白电泳严格按照全自动毛细管电泳仪(Capillarys 2 Flex Piercing)的说明书进行操作,分析样本各血红蛋白组分的含量。
1.2.3 基因型分析以DNA提取试剂盒(QIAGEN,德国)提取基因组DNA。采用跨越断裂点PCR(gap polymerase chain reaction,Gap⁃PCR)技术检测3 种缺失型α⁃地贫基因突变类型(⁃⁃SEA、⁃α3.7 和⁃α4.2),采用PCR⁃反向点杂交法(PCR⁃reverse dot blot,PCR⁃RDB)技术检测非缺失型α⁃地贫基因3 种常见突变类型(ααWS,ααCS 和ααQS)和β⁃地贫基因17 种常见突变类型CD41⁃42、IVS⁃2⁃654、⁃28、CD71⁃72、CD17、βE、CD31、27/28、IVS1⁃1、CD43、⁃32、⁃29、⁃30、CD14⁃15、CAP、Int、IVS1⁃5),所有地贫基因诊断试剂盒均来源于亚能生物技术(深圳)有限公司。
1.3 DNA 测序地贫基因检测方法
1.3.1 基因组DNA 提取采用Qiagen 法提取全血基因组DNA,Thermo 公司的NANODROP 2000 紫外分光光度计测定DNA 浓度和纯度。
1.3.2 引物设计共设计3 对引物,扩增7 种异常Hb,具体引物序列见表1。
1.3.3 聚合酶链反应(polymerase chain reaction,PCR)扩增PCR 扩增试剂来自亚能生物技术(深圳)有限公司,总反应体积为50 μL。α1、α2 测序扩增反应条件为96 ℃预变性5 min,98 ℃变性45 s,65 ℃退火1 min30 s,72 ℃延伸3 min,共35 个循环,最后72 ℃延伸10 min;β 测序扩增反应条件为95 ℃预变性5 min,96 ℃变性1 min,65 ℃退火45 s,72 ℃延伸3 min,共35个循环,最后72 ℃延伸10 min。扩增完成后,取5 μL 产物进行2%琼脂糖凝胶电泳30 min。
1.3.4 DNA 测序将PCR 扩增产物纯化后行双向DNA 测序(Sanger 双脱氧末端终止法)。测序图采用Chrome 软件进行分析,并与Genbank α⁃珠蛋白基因(NG000006.1)和β⁃珠蛋白基因(NG000007.3)进行比对。同时与异常血红蛋白及地贫数据库(http://globin.bx.psu.edu/hbvar/menu.html)进行比对分析。
1.4 血细胞分析采用血细胞分析仪进行血细胞分析,送检样本在4 h 内完成检测。主要观察指标为血红蛋白、MCV、MCH。
2 结果
2.1 地贫基因检测结果先证者及其家系成员的地贫基因检测结果,见表2。

表2 先证者及其家系成员的地贫检测结果Tab.2 Test results of thalassaemia of the proband and his family members
2.2 DNA 测序结果先证者、先证者之父亲的DNA 测序结果,见图1。
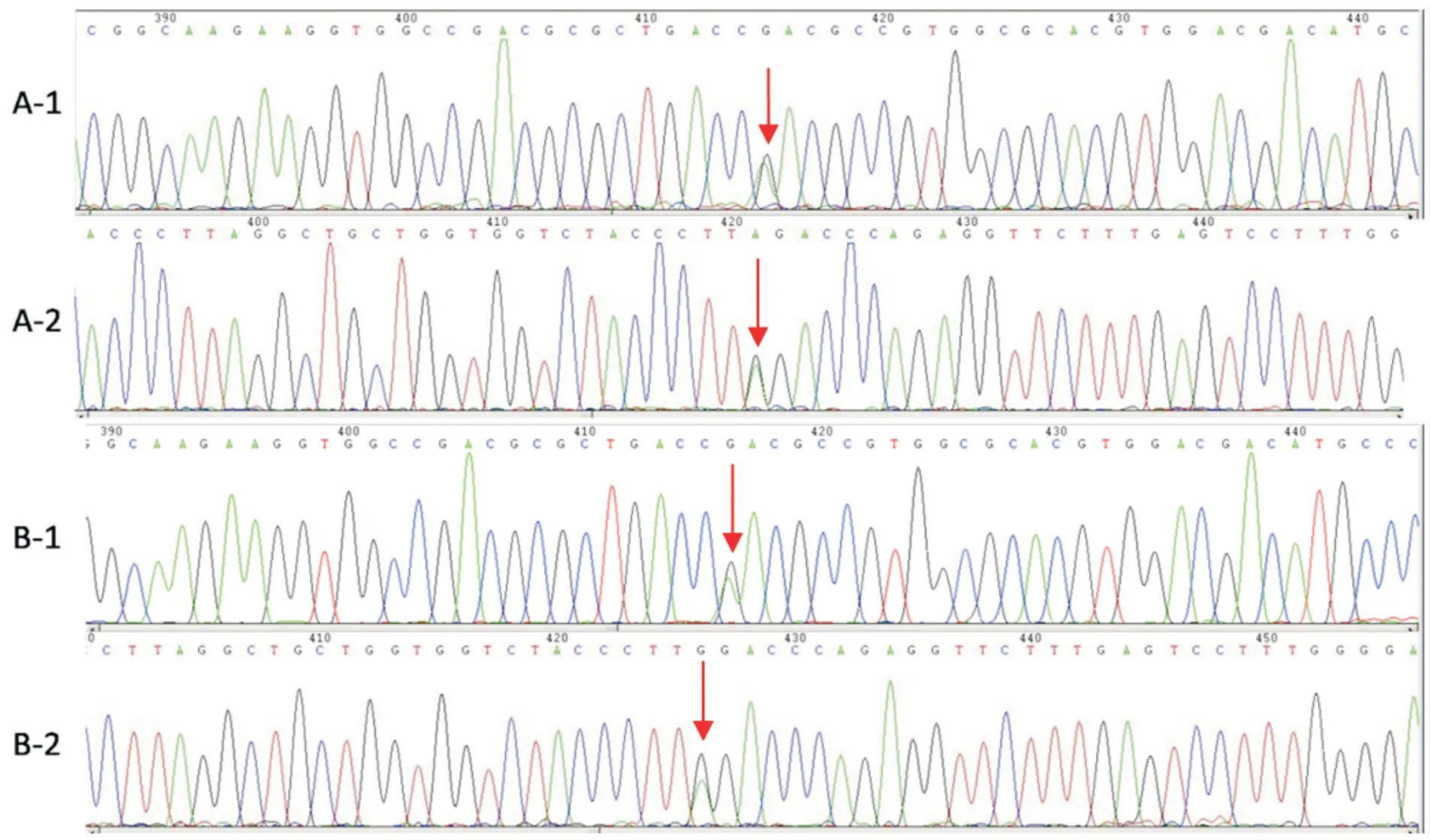
图1 先证者、先证者之父亲的DNA 测序结果Fig.1 DNA sequencing results of the proband and his father
2.3 血常规检验结果先证者及其家系成员血常规检验结果,具体指标见表3。
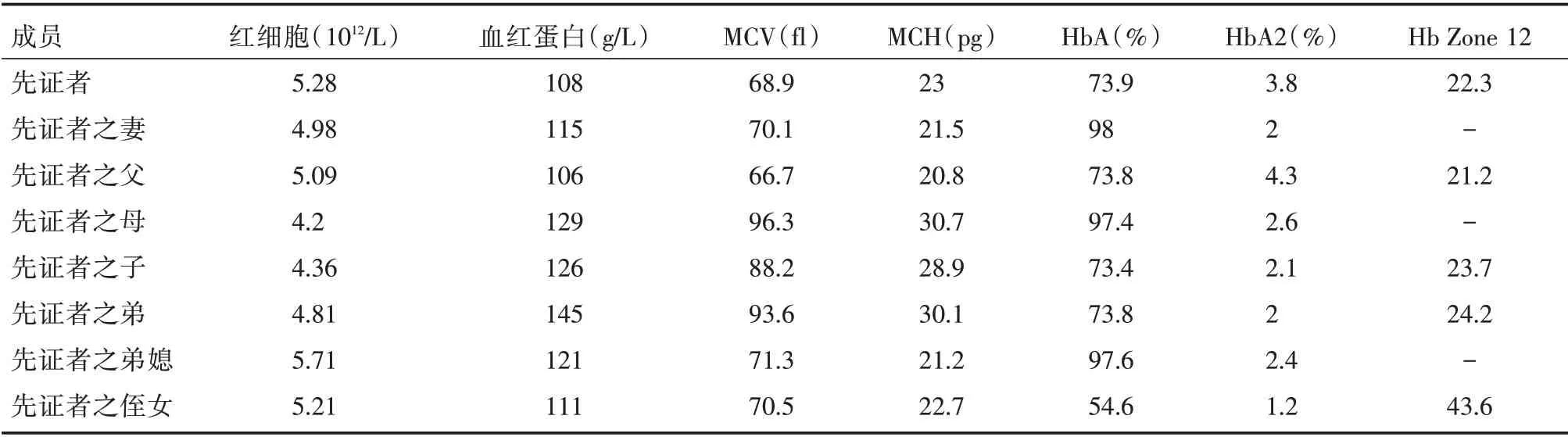
表3 先证者及其家系成员血常规检验中血红蛋白、MCV、MCH、HbA(%)、HbA2(%)、血红蛋白12 区(Hb Zone12)的结果Tab.3 Results of hemoglobin,MCV,MCH,HbA(%),HbA2(%)and Hb Zone12 in routine blood tests of proband and their family members
3 讨论
本文先证者的血红蛋白、MCH 及MCV 低于正常范围的下限,通过临床上常规检测地贫的方法基因测序,通过对先证者及其家属的测序结果分析,进行以下讨论。未发现异常。但是患者HbA2(%)的数值明显升高,提示患者很有可能存在beta 地贫基因的异常。通过对患者及其家属进一步DNA 测序发现患者为Hb Ube⁃2 杂合突变复合CD37 杂合突变,为罕见的异常血红蛋白类型。笔者对临床检验异常的结果给予了重视并进一步分析,认为患者存在异常血红蛋白的可能性很大。而且这种异常血红蛋白的存在与患者的血常规检验结果异常是否相关,其家系遗传特点及其血液学表现对后代是否产生影响尚不清楚。因此笔者对患者及家属进行了DNA
在对家系结果分析的过程中,发现先证者之弟及先证者之子均为Hb Ube⁃2杂合突变,两人均发育正常,血常规无明显异常,MCH 及MCV 在正常范围内。国内有少许关于HB Ube⁃2 的报道,在广东省珠海市妇幼保健院的6 297 份样本中,筛查出2 例Hb Ube⁃2 异常类型[12]。HUANG 等[13]报道了1 例Hb Ube⁃2 异常类型,并表示其对患者的临床表现无明显影响。根据目前已报道的HB Ube⁃2 异常血红蛋白患者血液学表现,结合本文先证者之弟及先证者之子的血液学表现,说明单纯的Hb Ube⁃2 杂合突变对患者的血常规没有产生明显影响。
CD37 杂合突变为beta 基因密码子37 的无义突变,由于β⁃珠蛋白肽链的生物合成完全被抑制,构成血红蛋白的α⁃珠蛋白肽链和β⁃珠蛋白肽链的平衡被破坏,使得正常血红蛋白合成减少或者无法合成[14]。CD37 突变包括CD37(TGG>TAG)和CD37(TGG>TGA)两种。在中国人群中相对较常见的是CD37(TGG>TAG),国外偶有CD37(TGG>TGA)的报道。在来自于巴勒斯坦地区的β 地贫的分析中报道了1 例CD37(TGG>TGA)突变[15]。CD37 杂合突变的发生率低,在一份对泉州11 668 例地中海贫血病例调查中发现CD37 杂合突变的病例只有2 例,占整个调查病例的0.14%[16]。其临床表现为β0 地贫,为轻型的β 地贫临床特征,MCH 及MCV 降低,HbA2(%)的数值升高,与本文的先证者及其父亲的临床表现一致。秦丹卿等[17]对12 例CD37 突变阳性的病例进行分析发现其HbA2 均升高。目前还没有CD37 纯合突变的报道。根据李育敏等[18]报道的一罕见β 地贫基因CD37(TGG→TAG)突变复合ɑ 地贫家系的检测结果提示MCH及MCV 降低,HbA2 升高,与本文的β0 地贫临床表现同样符合。
先证者DNA 测序结果其为Hb Ube⁃2 杂合突变复合CD37 杂合突变,通过对比其父母的结果发现其突变来源于其父亲。先证者及其父亲的MCH及MCV 均低于正常值范围的下限,为轻度贫血。两者的HbA2(%)的数值明显升高,测序结果验证了笔者最初的考虑,两者均合并了β⁃地贫类型。目前还未有Hb Ube⁃2 杂合突变复合CD37 杂合突变相关的报道。在研究过程中,还发现先证者之侄女为Hb Ube⁃2/SEA 地贫类型,属于α 地贫的SEA 缺失合并Hb Ube⁃2 杂合突变类型。目前还未发现有与此相关的报道。其血红蛋白、MCH 及MCV 都低于正常值范围的下限。对比上文讨论的单纯的Hb Ube⁃2 杂合突变对MCH 及MCV 无明显影响,Hb Ube⁃2/SEA 地贫类型及Hb Ube⁃2 复合CD37 杂合突变对MCH 及MCV 有一定的影响,这与文献报道的结果相一致。在一份对江苏省无锡地区异常血红蛋白病的流行病学调查报道中发现的1 例Hb Ube⁃2 杂合突变,其血红蛋白及MCV 在正常范围[19]。
Hb Zone 12 区域是在毛细管电泳中出现的峰,PANYASAI 等[20]在罕见的Hb 沈阳[α26(B7)Ala→Glu,HBA2:c.80C>A(or HBA1)]变异体研究中报道了携带此变异体的在毛细管电泳中会出现Hb Zone 12。在RECASENS 等[21]报道的新血红蛋白变异体中,通过毛细管电泳发现Hb Zone 12 出现的峰值占整个血红蛋白的3.3%。在我国也有相关的报道,胡帅等[22]报道的四川1 例Hb J Bangkok 基因突变中,通过毛细管电泳方法发现异常的Z12 区域峰,此会影响蛋白质的物理性质,但是不会改变血红蛋白的功能。结合本文报道的在Hb Zone 12区域出现的峰可以发现,在毛细管电泳中出现Zone 12 区域峰,很有可能存在罕见的异常血红蛋白,需要进一步验证其类型,至于存在的异常血红蛋白是否影响患者的血液系统,还需结合患者的血液指标进行分析。
本文先证者常规地贫检测结果未有异常与先证者异常的血常规结果相矛盾,因此从这点着手对先证者的家系进行了DNA 测序分析。测序结果解释了先证者血常规结果异常的原因,通过对家系DNA 测序结果的分析,并进行文献查找,进一步发现Hb Ube⁃2 杂合突变复合CD37 杂合突变类型对血常规的影响趋势与单独的CD37 杂合突变类型一致。CD37 杂合突变类型对血红蛋白合成的影响机制与Hb Ube⁃2 杂合突变复合CD37 杂合突变类型的影响机制是否一致目前还不清楚,有望在接下来的研究中进一步探究。但是对于临床上血液检测有异常改变的患者,还是需通过分子诊断的方式进一步确诊,这在产前诊断和婚育指导上有重要意义。

