呼吸道合胞病毒通过TRAF6/NF⁃κB通路调控人T淋巴细胞白血病细胞增殖
聂钰君 侯燕 钱丹
湖北文理学院附属医院襄阳市中心医院(湖北襄阳 441021)
急性淋巴细胞白血病(acute lymphoblastic leu⁃kemia,ALL)是儿童发病率第一位的恶性肿瘤,占儿童白血病的70%,部分具有遗传倾向[1-2],多采用化疗,5年无病生存率已达80%以上,但有少部分患儿难治或复发甚至死亡[3],因此迫切需要探究新的疗法提高ALL 的临床疗效。现有多种治疗癌症的新方法,如多药联合化疗、靶向治疗、生物治疗等[4],其中,溶瘤病毒治疗是近年来发展的新的生物疗法。溶瘤病毒是基因工程病毒或天然存在的病毒,可以选择性复制并杀死癌细胞而不损害正常组织[5],这为肿瘤恶性细胞的特异性和靶向选择治疗提供了可能[6]。据报道,麻疹病毒对儿童B 系ALL 疗效显著[7],新城疫病毒可抑制ALL 细胞的增殖[8],呼吸道合胞病毒(respiratory syncytial virus,RSV)与他们同属副粘病毒家族,但RSV 在白血病鲜有报道。因此,本研究采用MTT、FCM、RT⁃PCR、Western blot 等方法评估感染RSV后Jurkat 细胞的增殖及凋亡情况,以探究其可能的溶瘤作用。
1 材料与方法
1.1 材料RSV⁃A2 株及Jurkat 细胞来源于ATCC,MTT 购自美国MedChem Express,TRIzol 来自科瑞生物制品有限公司,M⁃MLV 逆转录试剂盒、实时定量PCR 试剂盒、引物购自上海Invitrogen,Taq DNA聚合酶购自Fermentas,细胞蛋白裂解液、BCA 蛋白检测试剂盒及ECL 化学发光试剂盒均购自碧云天生物公司,cleaved⁃Caspase⁃8 单抗购自上海MACK⁃LIN,其余抗体均购自上海Abcam。
1.2 方法
1.2.1 细胞培养Jurkat 细胞采用含双抗(青霉素100 U/mL、链霉素0.1 mg/mL)及10%胎牛血清RP⁃MI⁃1640 培养液,置于37 ℃、5% CO2培养箱中培养,实验用细胞均处于对数生长期。
1.2.2 病毒感染细胞在12 孔板中接种Jurkat 细胞,待汇合度达60%时每孔加入1×107PFU/mL 病毒液60 μL(MOI 3),吸附1 h 后再加入含10%胎牛血清的RPMI⁃1640 培养液900 μL,置37 ℃、5%CO2培养箱中培养,分别于RSV 感染后3、6、12、24 h收集细胞,通过qRT⁃PCR 检测RSV⁃NS2 mRNA 的表达来确认RSV 是否感染Jurkat 细胞。
1.2.3 MTT 实验收集Jurkat 细胞并调浓度为5×105/mL,取96 孔板,每孔接种细胞180 μL,置37 ℃、5%CO2培养箱培养12 h。每孔加入RSV 1×107PFU/mL 病毒液10 μL(MOI 3),设未感染的细胞作为空白对照。培养不同时间后,每孔加入20 μL(浓度为5 g/L)MTT,继续培养4 h。每孔加入100 μL DMSO,振荡混匀后培养20 h。在酶联免疫检测仪上读取波长为570 nm处的吸光度值(A值)。实验组细胞的相对增殖水平=A(实验孔)/A(阴性对照),实验重复3 次。
1.2.4 克隆形成实验RSV 感染Jurkat 细胞后,将细胞以200 个/孔密度接种于6 孔板中,置于37 ℃,5%CO2培养箱内培养12 d,用PBS 小心洗涤细胞3 次,甲醇固定20 min,Giemsa 染液染色20 min,流水缓慢洗去染色液。镜下计数大于50 个细胞的克隆数。
1.2.5 FCM 检测凋亡细胞接种于24 孔板,RSV作用Jurkat 细胞12、24、48 h 后,收集2×105细胞经PBS 洗涤后用Annexin 2V 2FITC(215 μg/mL)和PI(10 μg/mL)染色,避光作用10 min 后,在流式细胞仪上检测凋亡细胞,实验均设3 复孔。
1.2.6 Western blot 实验采用细胞蛋白裂解液提取细胞总蛋白,BCA 法测定蛋白浓度,10%SDS⁃PAGE 凝胶电泳,至marker 出现清晰条带停止电泳。200 mA 转3 h 至PVDF 膜上,5%脱脂牛奶室温摇床封闭2 h,一抗cleaved⁃Caspase⁃3(1∶500)、cleaved⁃Caspase⁃8(1∶1 000)、cleaved⁃Caspase⁃9(1∶1 000)、Bcl2(1∶1 000)、TRAF6(1∶2 000)、p⁃NF⁃κB(1∶2 000)、NF⁃κB(1∶2 000)及GAPDH(1∶2 500)4 ℃孵育过夜,羊抗兔二抗(1∶2 500)室温摇床孵育90 min,TBST 洗膜后采用ECL 化学发光法压片、显影、定影。胶片采用GDS⁃8000 型凝胶成像系统进行灰度扫描,以目的条带与GAPDH 灰度比值作为目的蛋白的相对表达量。
1.2.7 qRT⁃PCR 实验25 μL 的PCR 反应体系含有2 μL 逆转录反应产物、10 μmol/L 特异引物各1 μL 以及0.5 μL TaqDNA 聚合酶,反应在DNA 扩增仪上进行:95 ℃变性2 min,扩增条件为95 ℃30 s,退火温度72 ℃1 min,循环35 次。用GAPDH作为RSV⁃NS2 和TRAF6 的内部参照,目的基因的相对表达量以与GAPDH 的比值计算,实验重复3 次。目的基因的引物序列见表1。

表1 qRT⁃PCR 目的基因的引物序列Tab.1 Primer sequence of qRT⁃PCR target gene
1.3 统计学方法应用GraphPad Prism 8 软件进行数据分析。实验结果以均数±标准差表示。多因素比较采用单因素方差分析,两组间比较采用独立样本t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 RSV 感染Jurkat 细胞将RSV 感染对数生长期Jurkat 细胞,感染3、6、12、24 h 后收集细胞,采用qRT⁃PCR 检测RSV 是否感染Jurkat 细胞。结果显示,Jurkat 细胞内RSV⁃NS2 表达随时间延长而增强,6 h表达差异有统计学意义(P<0.001)。
2.2 RSV抑制Jurkat细胞增殖RSV感染Jurkat细胞3、6、12、24 h 后收集细胞,采用MTT 检测Jurkat细胞增殖,结果显示Jurkat 细胞的增殖能力从6 h后显著下降,呈时间依赖性(P<0.05,图1A)。RSV 感染Jurkat 细胞后12 d,克隆形成实验显示Jurkat 细胞的克隆数明显减少(P<0.05,图1B)。
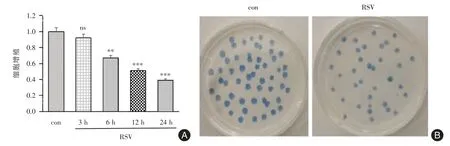
图1 RSV 抑制Jurkat 细胞的增殖Fig.1 RSV inhibited the proliferation of Jurkat cells
2.3 RSV 促进Jurkat 细胞凋亡将RSV 感染对数生长期Jurkat 细胞,12、24、48 h 后收集细胞,流式细胞术结果显示RSV 感染后,Jurkat 细胞的凋亡水平逐渐上升,有时间依赖性(P<0.05,图3A)。Western blot 结果显示,cleaved Caspase⁃3 和cleaved Caspase⁃9 的表达均显著增加,Bcl2 的表达明显减少,呈时间依赖性(P<0.05,图3B),cleaved Cas⁃pase⁃8 的表达无明显改变。
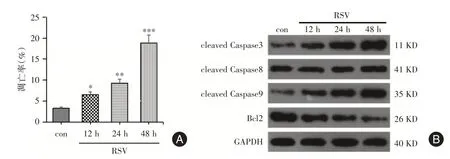
图2 RSV 促进Jurkat 细胞的凋亡Fig.2 RSV promoted the apoptosis of Jurkat cells
2.4 RSV 抑制TRAF6/NF⁃κB 通路活化RSV 感染Jurkat 细胞12、24、48 h 后收集细胞,qRT⁃PCR 结果显示RSV 显著抑制了TRAF6 的表达,有时间依赖性(P<0.001)。Western blot 的实验结果显示,TRAF6 和p⁃NF⁃κB 的表达随感染时间的延长而降低(图3)。
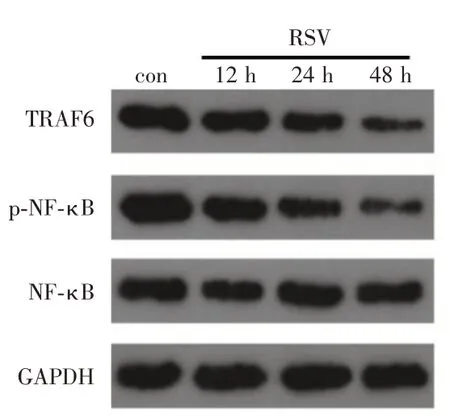
图3 RSV 抑制TRAF6/NF⁃κB 通路的活化Fig.3 RSV inhibited the activation of TRAF6/NF⁃κB pathway
3 讨论
ALL 作为儿童时期最常见的恶性血液病[9],5年无病生存率已达80%以上,但仍有少部分患儿复发。溶瘤病毒是近年来研究较多的生物疗法,已有报道证实麻疹病毒、新城疫病毒均对白血病细胞有抑制作用,但RSV对白血病细胞的作用尚未明确。国内外研究发现,RSV 可诱导前列腺癌细胞[10]、肝癌细胞[11]、皮肤癌细胞[12]、肺癌细胞[13]凋亡,提示RSV 可诱导多种肿瘤细胞凋亡,但关于RSV 是否诱导白血病细胞凋亡鲜有报道,其机制尚未明确。本研究选择Jurkat 细胞[14]为研究对象,探索RSV 对Jurkat 细胞的作用及可能的分子机制。
研究显示RSV 编码的非结构蛋白NS2 参与RSV 作用的过程[15],因此,本研究采用qRT⁃PCR 检测RSV⁃NS2 mRNA 的表达来确认RSV 是否感染Jurkat 细胞。研究结果显示,Jurkat 细胞在感染后3 h 内RSV⁃NS2 表达开始出现,6 h 明显增高,随时间延长,RSV⁃NS2 RNA 在Jurkat 细胞中的表达逐渐增多,提示RSV 可感染Jurkat 细胞。
众所周知,细胞增殖[16]和细胞凋亡[17]是评价细胞生长的重要指标,因此,本研究采用以下方法评估RSV 对Jurkat 细胞的作用。本实验MTT 及克隆形成实验结果显示Jurkat 细胞的增殖能力下降,克隆数明显减少,提示RSV 抑制了Jurkat 细胞增殖。FCM 结果显示RSV 感染后Jurkat 细胞的凋亡率呈时间依赖性上升,说明RSV 感染Jurkat 细胞后细胞凋亡增加。Western blot 的结果提示RSV 大部分通过Caspase⁃3、9 和Bcl2 通路诱导Jurkat 细胞凋亡。
肿瘤坏死因子受体相关因子6(TNF receptor associated factor 6,TRAF6)是肿瘤坏死因子超家族和Toll 样受体超家族的重要结合蛋白[18]。另一方面,NF⁃κB 转录因子是免疫应答和应激反应以及细胞生长的关键调节因子,可通过与其他通路协调作用来影响细胞的增殖[19]。TRAF6 的激活启动下游信号传导,导致NF⁃κB 亚单位从细胞质转移到细胞核,促进相关基因表达,对细胞增殖和免疫应答起正反馈调节[20]。抑制TRAF6 泛素连接酶活性,对NF⁃κB 激活和自噬功能的TLR4 信号进行负性调节,如杀菌活性、癌细胞迁移及侵袭[21]。有研究显示TRAF6 通过激活TRAF6⁃NF⁃κB/AP⁃1 信号通路,促进大肠癌细胞的增殖和转移[22]。TLR3 或TLR4 激活诱导的自噬通过促进TRAF6 泛素化增强各种细胞因子的产生,从而促进肺癌细胞的迁移和侵袭[23-26]。本研究发现RSV 感染Jurkat 细胞12 h 以后,TRAF6 和p⁃NF⁃κB 的表达随感染时间的延长而减弱,说明RSV 感染抑制了TRAF6/NF⁃κB的表达,因此,笔者推断RSV 通过TRAF6/NF⁃κB 通路抑制Jurkat 细胞的增殖。然而,RSV 影响Jurkat细胞的其他机制还有待进一步的探究。
综上所述,本研究发现RSV感染对Jurkat细胞具有抑制作用,这种作用可能通过抑制TRAF6/NF⁃κB 信号通路的活化实现的。如能在动物实验中加以验证,探明RSV 致瘤体细胞凋亡机制,将为白血病的溶瘤治疗提供理论基础。

