番茄DNA甲基转移基因SlDRM2L的克隆及表达分析
刘嘉荔,刘红达,汪宏涛,张 玉,唐晓凤
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
0 引 言
在真核生物中,DNA甲基化具有非常重要的调节作用。在哺乳动物中,DNA甲基化主要由DNA甲基转移酶(DNMTs)介导,其在复制过程中参与维持初始甲基化和甲基化形式。甲基化的变化也会受到DNA甲基转移酶和DNA去甲基转移酶的影响。DNA甲基化是指向DNA的胞嘧啶碱基中加入甲基以形成5-甲基胞嘧啶。
植物的DNA甲基化发生在CG、CHG和CHH(H=A、C或T)上,已鉴定出3种DNA甲基转移酶,分别为MET1、CMT3和DRM2[1-3]。哺乳动物DNA甲基转移酶DNMT1的同系物MET1主要维持CG的甲基化[4];CMT3作为植物特异性DNA甲基转移酶则参与维持CHG位点的DNA甲基化[5];DRM2参与所有序列位置的DNA甲基化的起始,并且CHH的DNA甲基化也很大程度上依赖于该酶,其中DRM2的活性会受到由RNA介导的DNA甲基化(RdDM)路径的高度调节[6-7]。
DNMT3是哺乳动物中DRM2的同系物,参与维持某些位置(如CHG和CHH)的甲基化以及CG、CHG、CHH的初始甲基化[8-9]。DRM2作用的目标取决于siRNA生物合成中涉及的一些蛋白质,包括RNA聚合酶Ⅳa、Ⅳb、DCL3以及AGO4等[10]。UBA结构域是由约45个氨基酸残基组成的泛素结合结构域,具有3个α-螺旋束可与单、多聚泛素或底物进行相互作用。
与此同时,有关DNA甲基化在其他植物体中的研究甚多,如拟南芥DRM在盐胁迫耐受性的研究,研究表明DNA 甲基转移酶可能间接促进纤维素合成酶的表达进而调控纤维素合成的水平,最终赋予拟南芥盐胁迫的耐受性[11]。茶树也有相应的研究,茶树能通过改变CsDRM2基因的表达水平来调节基因组甲基化的变化,从而参与茶树对低温胁迫的响应[12]。除此之外,高温作为植物生长过程中逆境胁迫因子对植物的生长发育也受到关注。有研究报道,在高温环境下,植物DNA甲基化水平会受到高温胁迫的诱导,甚至会调节植物的繁殖力[13]。因此本文还分析了高温处理是否影响番茄DNA甲基转移基因SlDRM2L的转录水平。
本文以野生型番茄作为模式植物进行研究,通过生物信息技术分析了番茄SlDRM2L基因的结构域、亲缘性以及该基因在番茄组织中的表达模式,并通过构建绿色荧光融合表达载体进行亚细胞定位实验确定了蛋白的表达位置;同时研究在高温胁迫下对野生型番茄幼苗的影响。这些分子生物学实验对深入了解SLDRM2L分子机制及生物学功能的研究具有重要作用。
1 材料与方法
1.1 实验材料
1.1.1 载体、菌株和植物材料
pBI121-GFP(Kana,14 kB),携带农杆菌转移的T-DNA区域和融合报告基因GFP保存于实验室;克隆载体pEASY-Blunt Simple Cloning Vector、大肠杆菌(Escherichiacoli)菌株DH5α、根癌农杆菌(Agrobacteriumtumefaciens)菌株GV2260均由本实验室保存;野生型番茄(Solanumlycopersicum,AC)、烟草均由本实验室繁育保存。
1.1.2 分子生物学试剂
RNA提取试剂Trizol;高保真DNA聚合酶Pfu酶;反转录试剂盒5X All-In-One RT MasterMix、质粒提取试剂盒Plasmid Mini Kit 50-preps、OMEGA琼脂糖胶回收试剂盒Cycle-Pure Kit,均购于北京安诺伦生物科技有限公司;Taq DNA聚合酶、限制性内切酶、T4连接酶,均购于TaKaRa公司;引物(Primer Premier 5.0软件设计)由生工生物工程(上海)股份有限公司合成;其余试剂为分析纯。
1.2 生物信息学分析
在美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库中搜索并命名番茄SlDRM2L作为和拟南芥DRM2蛋白质序列中的同源基因。对该基因功能结构域及进化关系进行分析,搜索番茄SlDRM2L基因编码的蛋白质序列在其他物种中的同源序列,包括油松PtDRM2(Pinus tabuliformis,GenBank登录号AJP06289.1)、拟南芥AtDRM2(Arabidopsisthaliana,GenBank登录号AAF66129.1)、高从蓝莓VcDRM2(Vacciniumcorymbosum,GenBank登录号ASA49460.1)、南芥属BhDRM2(Boecheraholboellii,GenBank登录号AQM49846.1)、高粱SbDRM2(Sorghumbicolor,GenBank登录号XP-002455421.1)、木薯MeDRM2(Manihotesculenta,GenBank登录号XP-021599348.1)、樱桃PaDRM2(Prunusavium,GenBank登录号XP-021817090.1)、粟SiDRM2(Setariaitalic,GenBank登录号XP-004986027.1)、烟草NbDRM2(Nicotianabenthamiana,GenBank登录号JQ957857.1)以及苹果MdDRM2(Malusdomestica,GenBank登录号NP-001280787.1),经ClusterX多重序列比对后使用MEGA5.0软件,利用领接法(neighbor-joining,NJ)来绘制系统进化树。
1.3 SlDRM2L基因编码区的扩增
通过Trizol法提取番茄总RNA,检查番茄RNA的浓度和完整性,并在-80 ℃下保存备用。取1 μg总RNA参考试剂盒说明合成第一链cDNA。通过番茄SlDRM2L基因序列(GenBank登录号NM-001246974)来设计SlDRM2L编码区扩增引物。聚合酶链式反应(polymerase chain reaction,PCR)条件为:96 ℃ 5 min,96 ℃ 30 s,54 ℃ 28 s,72 ℃ 1 min,29个循环;72 ℃延伸10 min扩增基因序列。通过凝胶回收PCR产物并与克隆载体pEASY-Blunt Simple Cloning Vector连接以转化DH5α感受态细胞,并鉴定阳性克隆(命名为pEASY-S1DRM2L)用于测序。
1.4 SlDRM2L基因的表达谱分析
分别收取野生型番茄植株的不同组织和果实在不同时期的果皮(授粉后7、14、35 d,变色期,成熟期)以研究番茄SlDRM2L基因的组织表达模式。利用Trizol法提取总RNA,逆转录合成cDNA。以内参基因为番茄UBI3(GenBank登录号X58253),通过实时荧光定量PCR研究SlDRM2L基因的表达。PCR反应条件为:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 20 s,40个循环。反应用Step One实时荧光定量PCR完成,每样品3个反复,数据结果进行T检验。
1.5 SlDRM2L基因亚细胞定位分析
根据SlDRM2L基因序列设计含有SmaⅠ和KpnⅠ酶切位点的引物扩增SlDRM2L基因片段(不含终止密码子TAG)。用SmaⅠ和KpnⅠ分别酶切目的基因片段以及载体pBI121-GFP,回收片段后,用T4连接酶连接,转化到大肠杆菌感受态DH5a中。培养选择的抗性菌落,提取质粒经酶切鉴定后送测序,由此得到获得了融合绿色荧光蛋白(green fluorescent protein,GFP)的植物表达载体pBI121::SlDRM2L-GFP。随后将其转化农杆菌GV2260涂至有rif和kana抗性的培养皿中经培养获得阳性农杆菌克隆,将其储存备用。
参考农杆菌介导烟草瞬时表达方法[14]将pBI121:SlDRM2L-GFP质粒的农杆菌在28 ℃培养过夜,再转接培养6~8 h并利用乙酰丁香酮诱导培养农杆菌12 h,将菌液稀释为OD600=0.6,注射烟草,培养36~48 h后,在激光共聚焦显微镜(LSM710,蔡司)下观察烟草叶片背面表皮。
2 结果与分析
2.1 SlDRM2L基因的生物信息学分析
本文利用对已公布的番茄SlDRM2L序列进行了结构域分析。SlDRM2L存在2个UBA结构域(Ubiquitin-associated domain)和1个胞嘧啶甲基化酶(DNA methylase),如图1a所示。UBA结构域由约45个氨基酸组成,是由3个α螺旋紧密集束组成。它作为泛素结合结构域,利用疏水界面与单、多个泛素或其他底物进行相互作用。由此确定与DNA甲基化相关的甲基转移酶是番茄中的SlDRM2L。
结合GenBank数据库中公布的拟南芥AtDRM2、油松PtDRM2、高从蓝莓VcDRM2、南芥属BhDRM2、高粱SbDRM2、木薯MeDRM2、樱桃PaDRM2、粟SiDRM2、烟草NbDRM2以及苹果MdDRM2等的氨基酸序列,使用Clustal X和MEGA5.0软件构建进化树,如图1b所示。由图1b可知,番茄SlDRM2L亲缘关系最近的是烟草,而与油松最远。

图1 番茄SlDRM2L基因的生物信息学分析
2.2 SlDRM2L cDNA 全长序列的克隆
使用野生型番茄cDNA作为模板进行PCR扩增,如图2所示。图2中,M代表DNA Marker;1代表SlDRM2L。
从图2可以看出,通过琼脂糖凝胶电泳证实特定基因片段大小与预期的SlDRM2L基因(1 872 bp)一致。经测序后,确定该基因片段为番茄SlDRM2L。

图2 番茄SlDRM2L 基因PCR产物
2.3 SlDRM2L 基因表达模式分析
采用Trizol法提取对野生型番茄在根、茎、叶、花以及果实不同发育阶段(授粉后7、14、35 d、变色期和成熟期)中的总RNA并进行逆转录成cDNA后,通过实时荧光定量PCR测定SlDRM2L基因在不同组织中的表达,如图3所示。图3中,IG1为授粉后7 d的果实;IG2为授粉后14 d的果实;MG为授粉后35 d的果实;Br为变色期果实;RR为成熟期果实;Rt为根;Stem为茎;L为叶片;F为花。由图3可知,SlDRM2L基因在番茄各组织中均有表达,其叶片和花中表达量最高,表明SlDRM2L基因可能参与叶片和花发育的调控。

图3 SlDRM2L基因的表达模式分析
2.4 SlDRM2L蛋白的亚细胞定位
将pBI121::SlDRM2L-GFP融合蛋白表达载体通过GV2260农杆菌介导,注射烟草进行瞬时表达。
于激光共聚焦显微镜下,通过绿色荧光观察被注射的叶片背面表皮细胞(培养36 h后),并用DAPI对细胞核进行染色以确定其位置,结果如图4所示。

图4 番茄SlDRM2L蛋白的亚细胞定位
图4中,绿色荧光表示SlDRM2L蛋白;蓝色荧光表示DAPI染色后的细胞核;两者荧光重叠(Merge)表示SlDRM2L蛋白的表达位置,确定该蛋白定位于细胞核。
2.5 SlDRM2L受高温诱导情况分析
许多研究表明高温诱导甲基化表达水平,为此本文测试了DNA甲基转移酶DRM2L是否也受到高温影响[15]。在该实验中,经查阅文献确定38~50 ℃高温处理的温度[16],由于实验材料为番茄幼苗,若温度过高处理4 h会导致植株直接死亡,最终选择39 ℃作为处理温度。实验将野生型番茄幼苗分为2组:一组在39 ℃高温处理4 h;另一组作为空白对照,在正常温度(25 ℃)生长4 h。2组提取RNA反转录用于定量分析,结果如图5所示,图5中,CK表示对照组;1~3分别为高温处理的不同番茄植株。由图5可知,与对照组相比,高温条件下番茄SlDRM2L基因表达水平明显增加,说明高温确实会诱导SlDRM2L的表达。
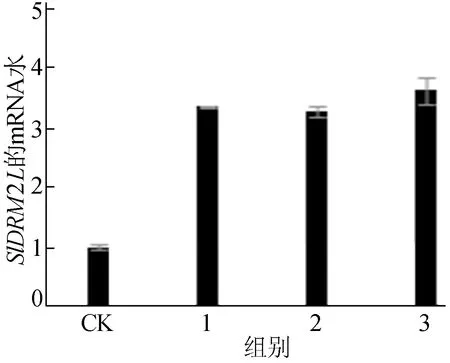
图5 高温处理后番茄叶片中SlDRM2L的表达水平
3 讨 论
DNA甲基化是基因沉默的主要表观修饰机制,其广泛存在于植物基因组中并影响基因表达。通过 DNA 甲基化动态的调节基因的表达,这对确立细胞功能和协调植物体发育进程效果十分明显。SlDRM2L基因(番茄DNA甲基化转移酶基因,与已知的拟南芥胞嘧啶甲基转移DRM2具有较高的同源性)也参与植物细胞在植物生长和发育过程中的生理功能。本文对多种植物DRM2同源序列进行生物信息学分析,并通过ClustalX进行多重序列比对和领接法绘制系统发育树,分析发现番茄SlDRM2L与烟草的关系最为密切,与油松最远[13]。
已有的研究表明番茄DRM类基因(包括SlDRM5以及SlDRM8)在所有组织中均表达,叶片和花中始终表达水平最高[15]。本文分析发现SlDRM2L基因在番茄各个组织和不同时期果实中均有表达,发现叶片和花中的表达量水平最高。这些结果与文献报道一致,这表明在花器官发育以及果实发育过程中SlDRM2L都可能起着重要作用。除此之外,高温是植物的逆境胁迫因子,有研究表明黄瓜的叶子DNA甲基化水平在高温下上升[17]。因为高温确实影响SlDRM2L基因的转录水平,所以推测SlDRM2L可能参与高温调控下植物的生长和发育。初步分析番茄SlDRM2L基因和先前DRM2同源基因的研究,表明番茄SiDRM2可能参与调控番茄的生长发育过程,这一发现对更深入了解SlDRM2L的DNA甲基化和植物生长发育有重要的指导作用。

