丙酮酸激酶基因调控异色瓢虫生殖力的作用分析
蔡文杰,史宇星,晁 蕾,葛欣竺,刘智慧,于园仪,王莎莎,王世贵,唐 斌
(杭州师范大学生命与环境科学学院,浙江 杭州 311121)
应用捕食性瓢虫等天敌昆虫防治有害生物已有近120年的历史.作为捕食性瓢虫中的一员,异色瓢虫(Harmoniaaxyridis)对蚜虫、叶螨、介壳虫等重要害虫具有很强的捕食能力[1],在其引入地及原产地都发挥了重要的控害作用[2].天敌昆虫的生殖力研究主要是通过饲养提高天敌昆虫的产卵能力[3-4],在合适的时间内获得充足的天敌昆虫.目前开发的人工饲料可保证异色瓢虫正常生长发育,但对提高成虫的生殖力效果欠佳,多代后生殖力下降[5-6],不利于物种的扩繁[7].因此,寻找生殖力促进因子、改进人工饲料配方的研究显得尤为重要.
昆虫的生长发育和生殖离不开能量供给.丙酮酸通过乙酰辅酶A和三羧酸循环实现体内糖、脂肪和氨基酸间的互相转化.丙酮酸激酶(pyruvate kinase,PYK)是糖酵解途径关键限速酶,在埃及伊蚊(Aedesaegypti)和棕榈象甲(Rhynchophoruspalmarum)胚胎发生过程中,均发现PYK活性升高[8-9];且有研究发现胚胎肌肉发育需要PYK[10].另有研究[11]发现,当PYK基因表达下降后,褐飞虱(Nilaparvatalugens)的生殖力显著降低.因此,推断昆虫胚胎发育和生殖力受丙酮酸激酶活性的影响.RNA干扰(RNA interference,RNAi)技术已被广泛用于基因功能、调控等研究[12-13].本研究以异色瓢虫为研究对象,通过RNA干扰技术降低异色瓢虫靶标基因PYK1-1的表达水平,测定异色瓢虫生殖力相关指标,探究丙酮酸激酶基因在调控异色瓢虫生殖力中的作用.
1 材料与方法
1.1 供试昆虫
供试异色瓢虫为杭州师范大学动物适应与进化重点实验室饲养种群,虫源为2020年5—7月采集于杭州师范大学校园及附近田间.将蚜虫(Megourajaponica)放置在蚕豆苗上饲养,再将接有蚜虫的蚕豆苗放入有异色瓢虫的养虫笼中.温度(25±1) ℃,相对湿度(70±5)%,光周期为14 L∶10 D.
1.2 实验方法
1.2.1 dsRNA的合成
采用Trizol法提取异色瓢虫总RNA,通过琼脂糖凝胶电泳和NanoDropTM2000微量核酸测定仪检测RNA的质量和浓度.采用PrimeScript RT Reagent Kit with gDNA Eraser试剂盒(Takara,日本)进行反转录实验,获得cDNA的第一条链.运用Primer 5软件设计丙酮酸激酶基因PYK1-1(GenBank:MZ327965)的dsRNA特异性引物(表1),进行PCR扩增.采用MiniBEST Agarose Gel DNA Extraction Kit胶回收试剂盒(Takara,日本)对目标片段进行回收,对回收产物进行T克隆.使用带T7启动子(5’-GGATCCTAATACGACTCACTATAGG-3’)的引物进行交叉PCR反应后,使用T7 RiboMAXTMExpress RNAi System双链RNA合成试剂盒(Promega,美国)合成dsPYK1-1[14].采用同样的方法合成绿色荧光蛋白(GFP)基因的dsRNA.

表1 实时荧光定量PCR所用引物Tab.1 Primers used for qRT-PCR
1.2.2 异色瓢虫的显微注射

1.2.3 实时荧光定量PCR(qRT-PCR)

1.2.4 生殖力指标测定
取未注射组(CK)、注射dsGFP组及注射dsPYK1-1组各10只成虫(雌∶雄=1∶1)分别放入饲养盒(280 mL)中,每天饲喂蚜虫.每个处理重复5次.记录每组第1次产卵的日期,产卵前期为羽化到第1次产卵的间隔期.从第1次产卵开始,每天记录产卵量,共统计30 d的产卵量,同时记录每批卵的孵化率.另外,收集注射后第3、5、7天的雌虫,在解剖镜下解剖卵巢并拍照记录,每个时间点解剖4只及以上雌虫.
1.3 数据统计分析
采用Microsoft Office Excel 2010、SPSS 20.0软件整理和分析实验数据.采用单因素方差中Tukey法分析异色瓢虫产卵前期、30 d总产卵量、孵化率在不同处理组之间的差异性,采用t检验分析异色瓢虫基因表达水平在不同处理组之间的差异性,P<0.05为差异有统计学意义.
2 结果
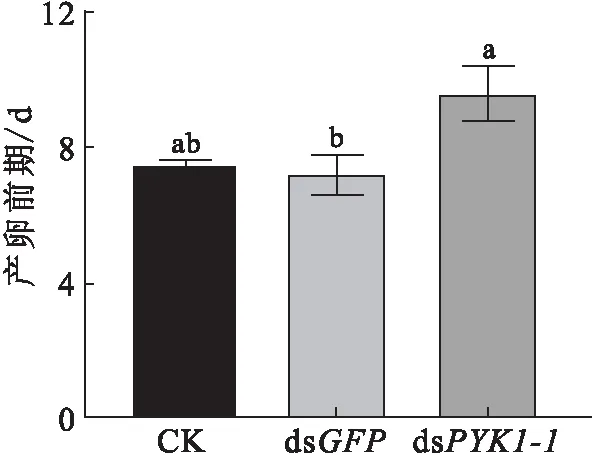
注:不同小写字母表示组别间差异具有统计学意义(P<0.05);下同.
2.1 RNA干扰PYK1-1基因后对异色瓢虫产卵前期的影响
将dsPYK1-1注射进成虫体内后,在48 h和72 h均检测到PYK1-1基因表达水平下调[12],差异具有统计学意义(P<0.05),表明RNA干扰有效.dsPYK1-1组异色瓢虫雌虫产卵前期(9.60±0.81) d长于dsGFP组(7.20±0.58) d,差异具有统计学意义(P<0.05),见图1.
2.2 RNA干扰PYK1-1基因后对异色瓢虫雌虫产卵量的影响
CK组单只雌虫30 d总产卵量最多,其次是dsGFP组,dsPYK1-1组产卵量最少,3组间30 d总产卵量比较差异无统计学意义(P>0.05),详见图2.dsPYK1-1组前10 d单雌总产卵量[(130.25±22.30)枚]低于CK组[(194.50±12.13)枚],差异具有统计学意义(P<0.05).
2.3 RNA干扰PYK1-1基因后对孵化率的影响
3组雌虫所产卵的孵化率比较,差异无统计学意义(P>0.05),见图3.CK组孵化率最高(69.76±4.46)%,其次为dsGFP组(64.79±2.79)%,dsPYK1-1组孵化率最低(62.20±4.63)%.
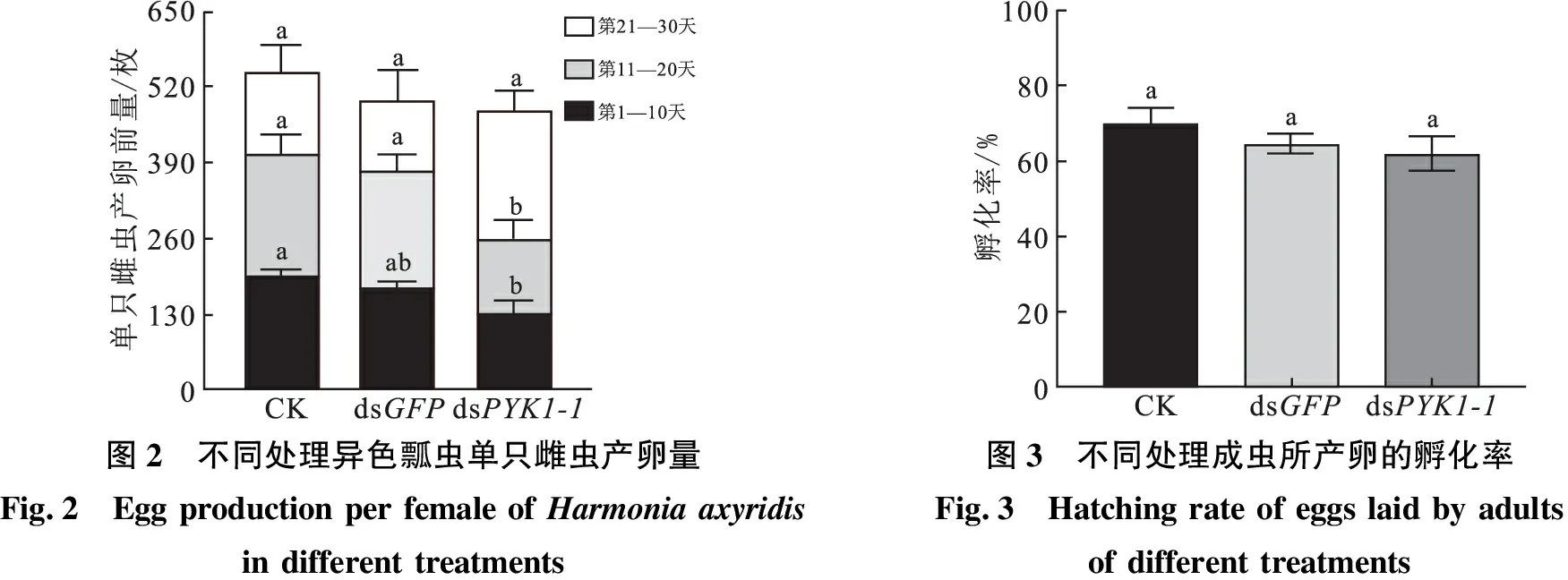
图2 不同处理异色瓢虫单只雌虫产卵量Fig.2 Egg production per female of Harmonia axyridis in different treatments图3 不同处理成虫所产卵的孵化率Fig.3 Hatching rate of eggs laid by adults of different treatments
2.4 RNA干扰后对异色瓢虫雌虫Vg和VgR基因表达的影响
注射dsPYK1-1到异色瓢虫后,第3天Vg1的相对表达水平高于dsGFP组,第5天和第7天Vg1的相对表达量降低,差异均有统计学意义(P<0.05)(图4A).异色瓢虫Vg2的表达水平在第5天和第7天均低于dsGFP组,差异均有统计学意义(P<0.05)(图4B).在3个检测时间点中,仅在注射后第5天,异色瓢虫VgR的表达水平低于dsGFP组,差异有统计学意义(P<0.05)(图4C).

ns表示P>0.05;*P<0.05;**P<0.01.
2.5 RNA干扰后对异色瓢虫卵巢形态的影响
异色瓢虫dsPYK1-1组雌虫卵巢在第3、5、7天均比另外2组雌虫的卵巢发育滞后(图5).第5天时,CK组雌虫卵巢可见黄色成熟卵粒;dsGFP组雌虫卵巢虽未见黄色卵粒,但卵巢大小与CK组相似;dsPYK1-1组的雌虫卵巢较小,说明卵巢发育较为迟缓.第7天时,CK组和dsGFP组雌虫卵巢中的黄色卵粒清晰可见,卵粒比较饱满;dsPYK1-1组初步形成黄色卵粒.结果表明dsPYK1-1表达被抑制后,异色瓢虫的卵巢发育被延迟.

图5 不同处理雌虫卵巢形态Fig.5 Ovarian morphology of female adults in different treatments
3 讨论
生殖是昆虫发育过程中的重要环节,对后代的繁衍起着至关重要的作用.研究[8]报道,葡萄糖代谢与埃及伊蚊胚胎发育密切相关.本研究前期结果同样显示,在异色瓢虫人工饲料中添加葡萄糖、海藻糖等糖类物质能够促进异色瓢虫卵巢发育、提高其产卵量[17];PYK1-1表达被抑制后,异色瓢虫葡萄糖含量先下降后上升[14],表明PYK1-1能够调控葡萄糖代谢.那么PYK1-1是否能够通过海藻糖代谢来影响卵巢和发育呢?本研究结果显示,当异色瓢虫PYK1-1表达受抑制后,雌虫产卵前期延长、前期产卵量下降、卵巢发育迟缓、Vg和VgR基因表达量受影响,结果与褐飞虱注射dsPYK后飞虱产卵量下降相吻合[11,18].RNA干扰褐飞虱糖酵解限速酶己糖激酶基因,褐飞虱产卵量下降[18];褐飞虱糖转运蛋白6(NlST6)介导中肠腔到血淋巴的糖转运[19],研究[20]发现,饲喂dsNlst6可导致褐飞虱产卵前期明显延长、产卵期缩短、产卵量减少.上述研究结果与本研究相符,推测可以通过调控糖代谢或者能量代谢相关基因控制生殖力,从而探寻更为合适的靶标基因防控害虫,或者借助这些靶标基因调控生殖力,改进人工饲料配方,提升天敌昆虫的产业化生产能力.
昆虫体内的糖、脂肪和蛋白质是产卵量的物质基础,在卵黄原蛋白的合成中起着重要作用[18].昆虫糖代谢水平与生殖能力之间存在相关性,本研究结果显示,雌虫在第21天至第30天的产卵量明显提高,所产卵的孵化率在3个处理组间差异无统计学意义.3组的30 d总产卵量差异无统计学意义,可能与采用RNAi注射法短时间抑制PYK1-1基因表达有关.对于通过长期饲喂抑制PYK1-1基因表达对异色瓢虫产卵量的影响,后续还需进一步研究.RNA干扰效应可以稳定地遗传给子代,存在时间上的有效性[21].Fire等[12]发现将小干扰RNA注射到线虫中能把RNA干扰的效应传给第2代,但不能传给第3代,推测后续目的基因PYK1-1的抑制效果可能会减弱,瓢虫的生理状态会逐渐恢复,后续还需进一步研究.
Vg是一类在卵巢外合成的蛋白质,是卵黄的主要成分[22],在胚胎发生过程中起着重要的营养作用[23].通常将Vg作为检测昆虫生殖力的分子标记[24-26].影响Vg的表达主要有4种信号通路,分别是胰岛素通路、雷帕霉素作用靶标(target of rapamycin,TOR)信号途径、蜕皮激素和保幼激素途径、与能量相关的途径[27].本研究结果显示,RNAi抑制PYK1-1的表达后,Vg1和Vg2的表达水平受影响.Ge等[20]发现饲喂dsNlst6会导致褐飞虱雌虫Vg表达水平降低,与本研究结果类似.VgR对卵母细胞的Vg摄取至关重要,并在昆虫生殖力中起重要作用.当斜纹夜蛾和褐飞虱VgR的表达水平被敲低后,卵巢中Vg蛋白水平降低,血淋巴中Vg蛋白积累,卵巢发育停滞,产卵失败[28-29].褐飞虱丙酮酸激酶与己糖激酶基因沉默导致卵巢蛋白水平下降,且卵巢发育受阻[18,30].由此看来,瓢虫PYK1-1的表达被干扰后,间接或直接降低Vg和VgR的表达,进而对卵细胞和卵巢发育产生影响.
目前,对七星瓢虫和异色瓢虫人工饲料配方、生殖等方面进行了大量的研究[31-32].本研究前期给异色瓢虫饲喂添加适量海藻糖或者葡萄糖的人工饲料,发现雌虫的生殖力比饲喂普通饲料有所提高[17].昆虫卵巢发育和卵细胞成熟需要碳水化合物代谢,本研究结果表明昆虫的糖酵解与生殖力之间存在联系,后续可深入探究昆虫能量代谢与生殖力之间的联系.

