DOT1L在头颈部鳞状细胞癌中的表达及生物学意义
杜欢乐 尤慧华 张琳
头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)是发生于头颅、颈部的恶性肿瘤,手术和放化疗是其主要治疗手段,但肿瘤复发、转移影响其总体生存率[1,2]。肿瘤干细胞是具有自我更新、分化潜能的肿瘤细胞亚群,是肿瘤进展的重要动力和肿瘤复发、转移的根源[3]。HNSCC 肿瘤干细胞特性、肿瘤细胞侵袭和化疗抵抗与类端粒沉默干扰体1(disruptor of telomeric silencing 1-like,DOT1L)表达上调有关。DOT1L 在基因转录过程中发挥作用[4],其异常表达与多种肿瘤进展密切相关[5~7],但其在HNSCC 中的表达及作用并不完全清楚。本次研究观察DOT1L 在HNSCC 组织、细胞中的表达,并初步探讨其对HNSCC Tca-8113 细胞生物学行为的影响,以期为HNSCC 的发病机制及治疗提供新线索。现报道如下。
1 资料与方法
1.1 一般资料 回顾性选择金华市中心医院的HNSCC 组织芯片(由上海芯超生物科技有限公司生产),组织芯片微阵列编号为GSE33205,共有90 例HNSCC 组织,剔除临床数据缺失者,共纳入81 例HNSCC 组织进行分析,其中男性60 例、女性21 例;年龄46~83 岁,平均年龄(64.00±7.90)岁;并选择30 例来自于正常口腔、喉等部位的黏膜上皮组织为对照组,其中男性21例、女性9例;年龄54~75岁,平均(62.00±5.00)岁。
1.2 方法
1.2.1 免疫组化检测DOT1L蛋白表达 将芯片组织标本经石蜡包埋、切片、脱蜡、复水、修复后,予以H2O2处理,10%山羊血清封闭后,加入DOT1L 抗体4 ℃过夜;经二抗和链酶卵白素各孵育30 min,行二氨基联苯胺(diaminobenzidine,DAB)染色,苏木精复染;脱水、封片,显微镜下观察拍照。结果判定:根据阳性细胞比例与染色强度积分乘积法,评分结果<3 分为阴性(低表达),≥3 分为阳性(高表达)[8]。
1.2.2 细胞培养、分组和转染 Tca-8113 细胞(由南京科佰生物科技有限公司生产)、CNE-1 细胞(由上海钰博生物科技有限公司生产)分别用含20%、10%胎牛血清的RPMI1640 培养基(由北京索莱宝生物科技有限公司生产)培养,FaDu 细胞(由武汉普诺赛生命科技有限公司生产)用相应专用培养基培养。实验共设三组,分别为对照组(未转染)、Scrambled siRNA 组(HNSCC 组织转染Scrambled siRNA)和DOT1L siRNA 组(HNSCC 组织转染DOT1L siRNA),每组设置3 个重复,取平均值。将Tca-8113细胞铺至6孔板,培养至融合70%~80%,根据实验分组参照脂质体3 000(由北京索莱宝生物科技有限公司生产)说明书步骤转染,6 h 后换液再培养48 h。DOT1L siRNA 及其阴性对照Scrambled siRNA由上海吉玛制药技术有限公司合成。
1.2.3 MTT 法和克隆形成实验分析细胞增殖 细胞接种于96 孔板(5×104/ml,每孔200 μl),贴壁后,按照1.2.2 中的分组转染,另设调零组(仅加培养液),48 h 后加MTT 溶液(由北京索莱宝生物科技有限公司生产)培养4 h;去除培养液,加二甲基亚砜,酶标仪测定各孔吸光度(absorbance,A)值,并按(实验组A 值-调零组A值)/(对照组A值-调零组A值)×100%计算细胞存活率。将处理完成的细胞以5×103/孔接种于6 孔板,培养14 d;弃上清液,甲醇固定15 min,适量吉姆萨染液染色15 min,统计克隆数。
1.2.4 流式细胞仪检测细胞周期与凋亡 将处理完成的细胞于70%乙醇固定过夜,PI 标记,室温避光孵育30 min;流式细胞仪分析细胞周期分布。实验重复3 次,取平均值。将处理结束完成由北京索莱宝生物科技有限公司生产)说明书进行标记,室温避光孵育15 min;流式细胞仪分析细胞凋亡率。
1.2.5 Transwell 实验分析细胞侵袭与迁移 ①侵袭实验:按1∶8 稀释基质胶MatriGel,包被小室底部膜上室,室温风干;收集转染48 h 的细胞,调整为1×105/ml,加入上室200 μl,含血清RPMI1640 培养基加下室;培养48 h,取出小室,多聚甲醛固定,结晶紫溶液染色,显微镜下随机观察,计数穿膜细胞,分析细胞的侵袭浸润能力。②迁移实验:Transwell 小室不进行基质胶MatriGel 包被,其余实验步骤同上,分析细胞的迁移运动能力。
1.2.6 克隆球形成实验分析细胞干性 收集转染48 h 后细胞,以4×103/孔接种于6 孔板,加入含20 μg/L 表皮细胞生长因子、10 μg/L 碱性成纤维细胞生长因子、2% B27 的DMEM/F12 无血清培养基(由武汉普诺赛生命科技有限公司生产),培养14 d,采用Image-J 图像软件拍照观察直径大于50 μm 的克隆球数。
1.2.7 实时荧光定量聚合酶链反应(real time fluorescent quantitative polymerase chain reaction,RTqPCR)检测DOT1L、Nanog、CD44、SOX2 mRNA 表达 Trizol 法提取总RNA,检测RNA 浓度与完整性;合成cDNA,进行PCR 扩增(试剂盒由大连宝生物工程有限公司生产)。反应条件如下:预变性95 ℃5 min;95 ℃变性15 s、60 ℃退火30 s、72 ℃延伸30 s,40 个循环。三磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参,2-△△ct法 计 算DOT1L、Nanog、CD44、SOX2 mRNA 表达水平。
1.2.8 免疫印迹法检测DOT1L、Nanog、CD44、SOX2蛋白表达 按照总蛋白提取试剂盒(由北京索莱宝生物科技有限公司生产)说明书提取总蛋白,二奎啉甲酸法检测总蛋白浓度;蛋白样品水浴加热变性,行SDS-PAGE 凝胶电泳分离,转至聚偏氟乙烯膜;脱脂奶粉封闭2 h,加入DOT1L(1∶1000)、Nanog(1∶1000)、CD44(1∶800)、SOX2(1∶800)和GAPDH(1∶1000)抗体(由英国Abcam 公司生产)4 ℃下孵育过夜;加入二抗(1∶3000)室温下孵育1.5 h;暗室显色后,以GAPDH 为内参,采用Image-J 图像软件分析DOT1L、Nanog、CD44、SOX2蛋白水平。
1.3 统计学方法 采用SPSS 22.0 软件进行统计学分析。计量资料以均数±标准差()表示。计量资料比较采用t检验;计数资料比较采用χ2检验。等级资料采用秩和检验。设P<0.05 为差异有统计学意义。
2 结果
2.1 DOT1L在HNSCC组织中的表达 HNSCC组织中DOT1L mRNA相对表达水平为2.82±0.23,高于癌旁组织中DOT1L mRNA 相对表达水平(1.00±0.00),差异有统计学意义(t=43.22,P<0.05)。81 例HNSCC 组织中45 例(55.56%)HNSCC 组织的DOT1L 呈高表达,36 例(44.44%)HNSCC 组织的DOT1L 呈低表达。DOT1L 在HNSCC 组织中的表达与临床特征的关系见表1。
由表1 可见,与DOT1L 低表达的HNSCC 患者比较,DOT1L 高表达的HNSCC 患者的低分化、有淋巴结转移、高T 分期和高病理分期比例更高,差异均有统计学意义(χ2分别=12.50、4.23,Z分别=3.11、3.62,P均<0.05)。两组在年龄、性别、发生部位比较,差异均无统计学意义(χ2分别=0.23、0.46、0.08,P均>0.05)。

表1 DOT1L在HNSCC组织中的表达与临床特征的关系/例(%)
2.2 HNSCC细胞中DOT1L表达水平见表2
由表2 可见,在3 种不同HNSCC 细胞系中DOT1L mRNA 和蛋白表达水平比较,差异均有统计学意义(F分别=194.37、217.92,P均<0.05),其中Tca-8113 细胞中DOT1L mRNA 和蛋白表达水平最高,明显高于CNE-1 细胞、FaDu 细胞,差异均有统计学意义(t分别=27.49、29.27、9.69、11.31,P均<0.05)。

表2 3 种HNSCC细胞系中DOT1L mRNA和蛋白表达水平的比较
2.3 DOT1L 对HNSCC Tca-8113 细胞增殖的影响见表3
由表3 可见,转染至Tca-8113 细胞48 h 后,各组细胞中DOT1L mRNA、DOT1L 蛋白表达水平和细胞存活率、克隆细胞数比较,差异均有统计学意义(F分别=672.70、393.44、366.12、196.13,P均<0.05)。Scrambled siRNA 组和对照组间DOT1L mRNA 和蛋白表达水平比较,差异均无统计学意义(t分别=1.10、1.11,P均>0.05),但DOT1L siRNA组细胞中DOT1L mRNA 和蛋白表达水平较Scrambled siRNA 组明显降低(t分别=45.46、34.90,P均<0.05);Scrambled siRNA 组细胞存活率和克隆细胞数与对照组比较,差异均无统计学意义(t分别=1.56、1.19,P均>0.05);与Scrambled siRNA 组比较,DOT1L siRNA 组细胞存活率明显降低,且克隆细胞数明显减少(t分别=32.33、24.83,P均<0.05)。
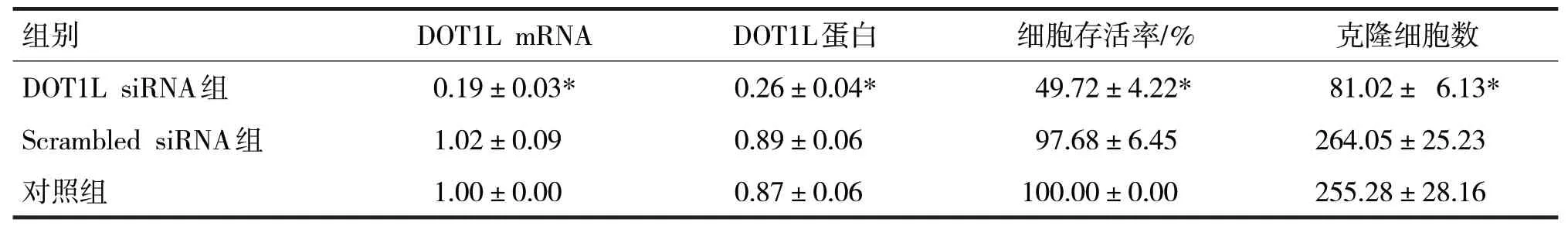
表3 各组细胞中DOT1L mRNA、DOT1L蛋白表达水平和细胞存活率、克隆细胞数的比较
2.4 DOT1L 对HNSCC Tca-8113 细胞周期、凋亡和侵袭、迁移细胞数的影响见表4
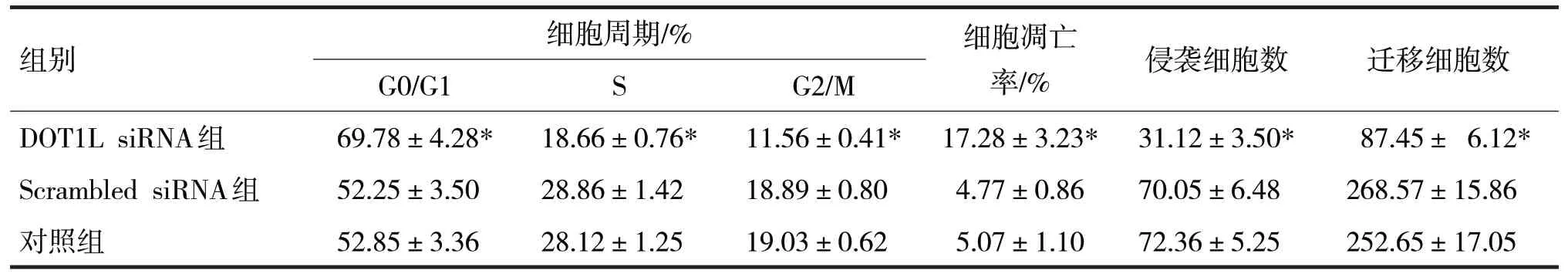
表4 各组细胞周期、凋亡和侵袭、迁移细胞数比较
由表4 可见,各组细胞周期分布、细胞调亡率、侵袭细胞数和迁移细胞数比较,差异均有统计学意义(F分别=63.89、210.12、413.39、111.09、177.22、466.17,P均<0.05)。Scrambled siRNA 组细胞在G0/G1、S 和G2/M 期所占百分比与对照组比较,差异均无统计学意义(t分别=0.48、1.89、0.67,P均>0.05);与Scrambled siRNA 组比较,DOT1L siRNA 组细胞在G0/G1 期所占百分比明显升高,而细胞在S和G2/M 期所占百分比明显降低(t分别=14.08、26.00、34.88,P均<0.05)。流式细胞仪检测结果显示,Scrambled siRNA 组与对照组细胞凋亡率比较,差异无统计学意义(t=0.44,P>0.05);但DOT1L siRNA 组细胞凋亡率较Scrambled siRNA 组明显升高(t=18.47,P<0.05)。Transwell 小室检测结果显示,Scrambled siRNA 组与对照组中侵袭细胞数和迁移细胞数比较,差异均无统计学意义(t分别=1.33、3.44,P均>0.05);与Scrambled siRNA 组比较,DOT1L siRNA 组中侵袭细胞数和迁移细胞数均明显减少(t分别=22.37、39.09,P均<0.05)。
2.5 DOT1L 对HNSCC Tca-8113 细胞干性的影响见表5
由表5 可见,各组中克隆球数和干细胞标志物Nanog、CD44、SOX2 的mRNA 和蛋白表达水平比较,差异均有统计学意义(F分别=114.98、214.91、248.03、202.15、370.40、214.05、306.29,P均<0.05)。Scrambled siRNA 组与对照组中克隆球数目比较,差异无统计学意义(t=1.91,P>0.05),DOT1L siRNA组中克隆球数目较Scrambled siRNA 组明显减少(t=17.55,P<0.05);Scrambled siRNA 组与对照组细胞中干细胞标志物Nanog、CD44、SOX2 的mRNA 和蛋白表达水平比较,差异均无统计学意义(t分别=1.21、2.88、1.06、2.67、1.55、1.61,P均>0.05),但DOT1L siRNA 组中Nanog、CD44、SOX2 的mRNA 和蛋白表达水平均明显低于Scrambled siRNA 组(t分别=24.77、23.06、25.85、25.84、32.53、29.48,P均<0.05)。
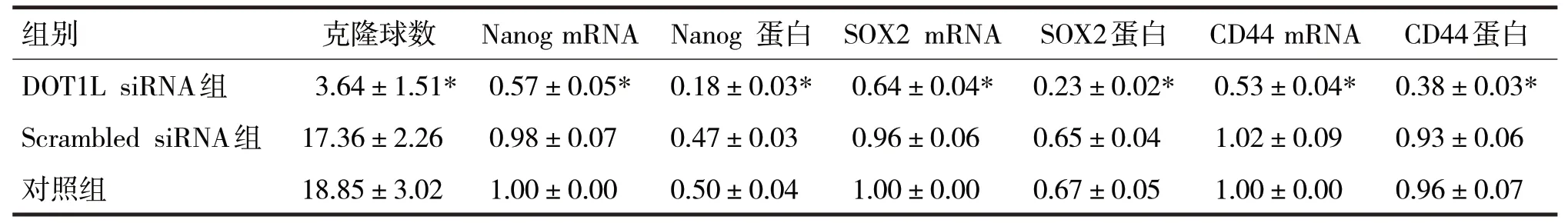
表5 各组中克隆球数和干细胞标志物Nanog、CD44、SOX2表达水平
3 讨论
研究表明,催化组蛋白赖氨酸甲基化的转移酶在包括HNSCC 在内的多种肿瘤中存在着异常表达,而组蛋白甲基化修饰的异常与肿瘤的发生发展密切相关[9]。EZH2 作为组蛋白赖氨酸甲基转移酶可催化H3K27me3,在HNSCC 中高表达,且其表达水平与患者肿瘤分级和预后不良有关。有研究认为,EZH2 是HNSCC 潜在的抗肿瘤靶点,抑制EZH2 可引起细胞凋亡、细胞周期阻滞和细胞生长减慢。组蛋白甲基转移酶G9a 可通过H3K9 甲基化与Snail 相互作用,在对上皮间质转化介导的HNSCC 的转移和癌干细胞样特征的维持方面发挥重要作用[10]。迄今为止,发现的组蛋白甲基转移酶大约有60 余种,大都与肿瘤的发生密切相关。因此,寻找、发现靶向组蛋白甲基转移酶的小分子抑制剂应用于抗肿瘤治疗不失为一条可行的途径。
DOT1L 是组蛋白H3的第79位赖氨酸的特异性的甲基转移酶,其异常表达与肿瘤发生发展密切相关[11,12]。例如:胃癌中DOT1L 高表达与患者分化程度、淋巴结转移、TNM 分期和不良预后有关;同时,DOT1L 可通过H3K79me2 改变G1 期细胞周期,进而影响胃癌细胞增殖[13]。DOT1L在浸润性乳腺癌中表达上调与患者的总生存率降低相关,同时可促进乳腺癌细胞侵袭和转移[14]。另外,抑制DOT1L 表达可降低干细胞标记物SOX2 表达、减缓肿瘤生长,提高整体生存率[15]。尽管已有学者指出,基质透明质酸诱导的HNSCC 肿瘤干细胞特性、肿瘤细胞侵袭和化疗抵抗与DOT1L 表达上调有关。但DOT1L 在HNSCC中的表达意义及生物学作用并不完全清楚。
本次研究检测发现81 例HNSCC 组织中DOT1L mRNA 表达水平明显高于正常组织,其中55.56%的HNSCC 组织中DOT1L 呈高表达,且高表达DOT1L 与HNSCC 患者分化程度、淋巴结转移、T分期和病理分期有关(P均<0.05),与Song 等[13]在胃癌中的研究一致,表明DOT1L 可能在HNSCC 发生发展过程中发挥着重要作用。为进一步探索其作用机理,本次研究通过细胞实验探索DOT1L 对HNSCC 癌细胞生物学行为的影响。在3 种HNSCC细胞系中检测发现,Tca-8113 细胞中DOT1L mRNA和蛋白表达水平最高,故选择Tca-8113 细胞进行后续研究。通过转染DOT1L siRNA 成功下调DOT1L表达后发现,Tca-8113细胞存活率、细胞在S和G2/M期所占百分比以及细胞中干细胞标记物Nanog、CD44、SOX2 的mRNA 和蛋白表达均明显降低,同时克隆细胞数、侵袭细胞数、迁移细胞数、克隆球数目明显减少,而细胞在G0/G1 期所占百分比和细胞凋亡率明显升高,表明下调DOT1L 表达可抑制Tca-8113 细胞增殖、侵袭、迁移和干性并诱导细胞周期阻滞和凋亡,这与Duan 等[14]、Bozek 等[15]关于DOT1L在乳腺癌细胞侵袭、转移、胶质母细胞瘤干性方面的研究一致。以上结果提示在HNSCC 发生发展过程中,异常高表达的DOT1L 在肿瘤细胞增殖、侵袭、迁移、凋亡和肿瘤细胞干性调节等过程中发挥着重要作用。
综上所述,DOT1L 在HNSCC 中高表达,而抑制其表达可抑制Tca-8113 细胞增殖、侵袭、迁移和肿瘤干细胞特性并诱导细胞周期阻滞与凋亡。本次研究关于DOT1L 在HNSCC 生物学意义方面的研究局限于单一细胞系和细胞水平,还需从动物实验及其他细胞系进行验证,同时DOT1L 是通过何种途径发挥作用也有待进一步深入研究。

