Rg1皂苷单体对人参锈腐病菌(Ilyonectria robusta)的趋化作用及酶活性的影响1)
陈彦霏 张善铭 许永华
(吉林农业大学,长春,138118)(人参新品种选育与开发国家地方联合工程研究中心)
宫赫阳 田义新 张连学 卢宝慧
(龙井市东盛涌镇农业技术推广站)(吉林农业大学)(人参新品种选育与开发国家地方联合工程研究中心)(吉林农业大学)
人参(PanaxginsengC.A.Mey)是五加科植物,人参的干燥根及根茎,主要功效有大补元气、复脉固脱、补脾益肺、生津养血、安神益智[1]。我国人参栽培面积居世界首位,吉林省长白山区作为我国人参主产区,每年人参产量超过全国80%[2]。
早年间,中国栽培人参主要选择是以毁林种植为主的传统栽培模式,传统的伐林栽参模式每年毁林面积高达2 300 hm2。由此造成了抚松、靖宇、集安、长白等老参区开始面临无林可伐的局面,并且长期的伐林栽参也带来了一系列严重的生态问题[3]。根据用地的分类,人参栽培方式可以分为伐林栽参、林下护育栽参、农田栽培人参、老参地栽参等。人参的栽培方式主要是依赖人工栽培,传统栽培模式有人参病害,主要以根部土传病害为主,也伴有一些地上部病害发生。大多数植物根部栖息的细菌都来自土壤[4]。种植人参后,土壤pH值降低,出现酸化趋势,NH4+和土壤有机质质量分数降低;土壤细菌多样性减少,真菌多样性增加[5-6]。人参在栽培过程中具有季节脱落的现象,导致每年有大量的茎叶和部分脱皮的根系在土壤中残留[7]。Dong et al.[8]对人参根际微生物群落研究发现,人参根际微生态的变化与人参的种植时间和发育阶段有关。种植模式[9-10]、生长年限[11]等都会影响根际微生物的群落组成,进而影响药材品质。人参种植对土壤养分和理化性质产生了直接影响,可能直接产生连作障碍[12]。连作障碍是指在同一土壤连续种植同一类型植物,植株出现病虫害严重、产量降低、品质下降的现象[13],人参连作后土传病害发生严重,其中主要是由于柱孢菌属(Cylindrocarponspp)引起的人参锈腐病造成的,从人参的苗期到收获期都有可能发生,发病严重的会使整个根部生锈腐烂,造成巨大的经济损失[14]。人参药用部位为多年生宿根,生长周期长,对生长环境的要求比较苛刻,很容易受到病原菌侵袭,从而导致病害的发生,使人参品质和产量受到严重制约。
皂苷是植物次生代谢物,同时也是植物预先合成的抗菌物质,能够抑制非病原菌的生长,而植物的病原菌对总皂苷有较强的化学趋向性[15-16]。引起人参根部病害主要病原菌是否会对皂苷单体有化学趋向作用及其对侵染或防御相关酶活性的影响,在国内外文献资料较少。
本试验通过对吉林省非林地栽参主要地区进行了锈腐病发病种类调查,明确了农田栽参过程中锈腐病的优势病原菌粗壮柱孢菌(Ilyonectriarobusta)。通过菌丝生长速率法、孢子萌发法以及菌丝干质量测量法初步确定Rg1对人参锈腐病菌(Ilyonectriarobusta)的趋化作用,通过测定施加不同质量浓度Rg1后,人参粗壮柱孢菌(I.robusta)侵染和防御相关酶活力测定试验确定最佳Rg1添加质量浓度。开展了Rg1最适质量浓度条件下,pH值以及碳氮源对人参锈腐病菌菌丝生长的影响。
1 试验材料
供试材料:锈腐病患病人参参根采自吉林省人参主产区,具体见表1。培养基:马铃薯200.0 g,葡萄糖20.0 g,琼脂20.0 g,蒸馏水1 000 mL,pH值自然。

表1 样品详细信息
主要仪器设备:电热恒温培养箱(DH600),恒温培养振荡器(ZHWY-100H),超净工作台(SW-CJ-ID)、立式自动电热压力蒸汽灭菌锅,酶标仪,霉菌培养箱,凝胶成像设备(ChemiDoc XRS+),低温冷冻离心机(DH600)。主要试剂药品:Biofiux真菌DNA提取试剂盒,PCR引物,dNTP,Taq DNA酶,人参皂苷Rg1。
2 研究方法
2.1 人参锈腐菌的分离与纯化
供试新鲜的初发病的人参样品,用流水冲洗30 min,冲去表面泥沙,用无菌滤纸吸干表面附水。选取患病部位切成1 cm小段,先用体积分数75%乙醇进行表面消毒3 min,随后用无菌水冲洗3~5次,再次用无菌滤纸吸干表面附水,后将1 cm小段均匀切成3小块接入PDA培养基中,在(24±1)℃下培养,每隔2 d观察1次。并将最后一次冲洗的无菌水涂布在平板上作为对照,7 d后无菌体生长即为消毒成功。
获得的人参锈腐菌采用单饱子分离纯化法进行纯化分离,得到锈腐菌株在平板培养基上培养7 d后4 ℃保存备用。
致病性测定:通过柯赫氏法则验证分离出的人参锈腐菌的致病力。
2.2 人参锈腐菌鉴定
病菌形态学观察:将8 mm菌饼置于PDA平板上,24 ℃黑暗培养7 d后观察病原菌的培养性状,包括菌落颜色及气生菌丝情况。显微镜检测观察病菌子实体形态并拍照。
分子生物学鉴定:采用试剂盒提取法提取菌丝DNA,-20 ℃保存备用。选择真菌rDNA内转录区(ITS)扩增的通用引物ITS5(5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’)进行PCR扩增。PCR反应体系:2.5 μL 10×PCR buffer,2.0 μL dNTP(2.5 mmol/L),MgCl2(2.5 mmol/L)1 μL,1 μL ITS4,1 μL ITS5,1 μL模板DNA,0.5 μL rTaq(5 U/μL)。
PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸1 min,总共35个循环,最后72 ℃延伸10 min。
PCR产物经1%琼脂糖凝胶电泳检测质量合格后进行测序,测序结果在Gen Bank(http://www.Ncbi.Nlm.Nih.gov/)中进行BLAST比对分析,并用MEGA6.0软件以邻接法构建系统发育树。
2.3 Rg1最佳趋化质量浓度测定
本研究拟采用从生长速率法、孢子萌发法、菌丝干质量测量法3种方法相结合,确定最适Rg1皂苷单体质量浓度。
生长速率法。基础培养基为马铃薯营养琼脂培养基(PDA),基础培养基中加入1 mL不同设定质量浓度的皂苷单体,对照组加入1 mL与试验组中皂苷单体相同的溶剂。如图1中所示:最小圆环为直径8 mm的人参锈腐病菌菌饼;(A1+A2)为对照组菌丝生长的长度,采用“十字交叉法”测量,取其平均值;(B1+B2)为加入不同质量浓度皂苷组菌丝生长长度,采用“十字交叉法”测量,取其平均值。当皂苷单体对人参锈腐病菌生长为抑制作用时,(A1+A2)>(B1+B2),菌丝生长抑制率={[(A1+A2)-(B1+B2)]/(A1+A2)}×100%;当皂苷单体对人参病原真菌生长为促进作用时,(A1+A2)<(B1+B2),菌丝生长促进率={[(B1+B2)-(A1+A2)]/(A1+A2)}×100%。
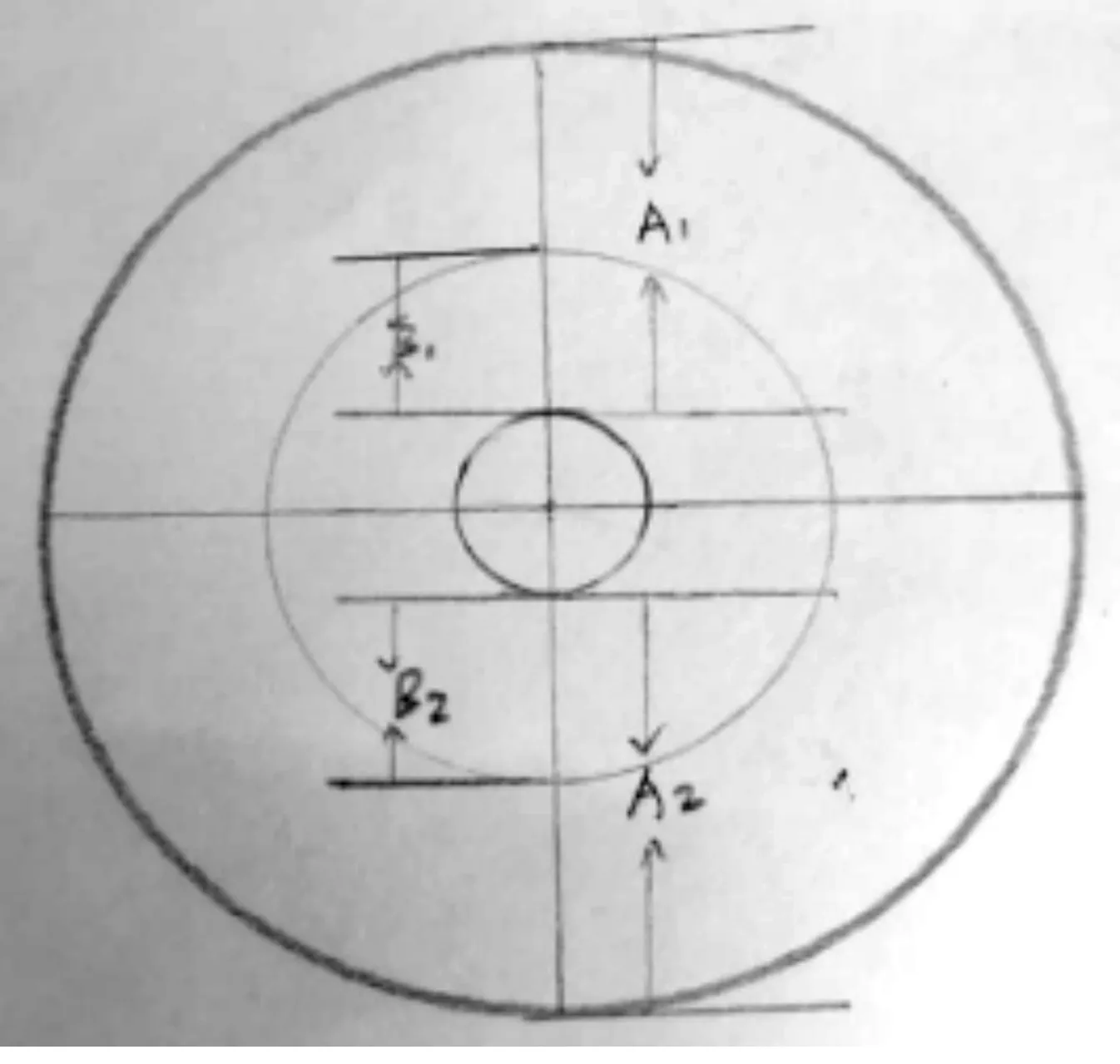
图1 生长速率法图示
孢子萌发法。基础培养基为1%葡萄糖溶液,基础培养基中加入不同质量的皂苷单体即为试验组。产孢人参锈腐病菌培养完成后,无菌水冲洗孢子及菌丝,采用Miracloth神奇滤布过滤掉菌丝,剩余即为孢子悬浮液。将孢子悬浮液稀释至所需浓度,不同试验处理加入相应质量的皂苷单体,观察1、2、4、6 h时间段皂苷单体对孢子萌发的影响。
菌丝干质量测量。基础培养基为马铃薯营养培养基(PD),取相同质量菌丝加入到装有150 mL的灭菌马铃薯营养培养基中,试验组加入不同质量浓度的皂苷单体,置于恒温振荡摇床中振荡培养,160 r/min,培养5 d;采用中速定性滤纸过滤菌丝,置于烘箱中35 ℃烘干,称其干质量。比较皂苷单体不同处理对人参锈腐病菌菌丝干质量的影响。
2.4 Rg1不同质量浓度下对人参粗壮柱孢菌(Ilyonectria robusta)侵染相关酶活力的影响
室内条件:采用相应试剂盒(北京安迪华泰科技有限公司和北京诚林生物科技有限公司)测定Rg1不同质量浓度诱导条件下人参粗壮柱孢菌(Ilyonectriarobusta)生长相关酶,过氧化物酶(POD)、过氧化氢酶(CAT)、多酚氧化酶(PPO)活性。
粗酶液制备:1.液体扩大培养。取孢子悬浮液1 mL,在无菌操作台内接入发酵培养基中(50 mL锥型瓶中装培养基27 mL+3 mL皂苷),25 ℃下160 r/min摇床培养4 d,制得菌体培养液。2.锈腐病菌菌体细胞的制备。将扩大培养后的培养液置于2 mL离心管,12 000 r/min离心5 min,除去上清液,得菌体细胞,待用。3.细胞破壁。取上一步骤粗提取的锈腐病菌菌体细胞于研钵中,加入液氮,充分研磨均匀。4.粗酶液的提取。将破壁后的锈腐病菌菌体细胞悬浮液1 mL,置于高速冷冻离心机中,12 000 r/min离心2 min,上清液即为粗酶液。
2.5 pH值对菌丝生长的影响
根据2.3测得Rg1最佳趋化质量浓度,在此条件下用HCl(1 mol/L)和NaOH(1 mol/L)无菌水溶液调节PDA培养基的pH值至4.0、5.0、6.0、7.0、8.0。用打孔器取刚长满平板的锈腐病菌菌饼接种到调好pH值的PDA平板中央,置于培养箱中25 ℃培养。每处理重复3次,9 d后,用十字交叉法测量菌落直径并测量菌丝干质量。
2.6 不同碳氮源对菌丝生长的影响
根据2.3测得Rg1最佳趋化质量浓度,在此条件下采用察氏培养基为基本培养基,分别以甘露醇、蔗糖、果糖、麦芽糖、木糖、葡萄糖和乳糖作为碳源,分别以尿素、硫酸铵、硝酸钾、牛肉膏、硝酸铵、硝酸钠为氮源。将锈腐病菌菌饼分别接种于不同碳、氮源处理的培养基平板中央,以不加碳氮、源的察氏培养基为对照,每处理重复3次,25 ℃培养9 d,后用十字交叉法测量菌落直径。
3 结果与分析
3.1 柯赫氏法则结果
本试验(图2)共鉴定出74株菌,并完成柯赫氏法则验证,均为人参锈腐病菌。
图2 锈腐病菌侵染人参
3.2 病原菌形态学观察
本试验共鉴定出74株菌,并完成柯赫氏法则验证,经形态学鉴定均为人参锈腐病菌。测定结果表明(图3),菌株气生菌丝生长茂盛,初灰白色,后至棕褐色,菌丝生长较慢,气生菌丝为絮状,并能以扩散或分生孢子座的方式产生孢子。培养9 d后菌落直径7.6 cm,菌丝宽2.3 cm,分生孢子无色,多为大型分生孢子,圆柱形或两端钝圆,孢子直或弯曲,有一个或多个横隔膜。有一些能产生单胞无隔膜小型分生孢子,生长发育后期能够产生厚垣孢子,厚垣孢子一般夹生或端生。
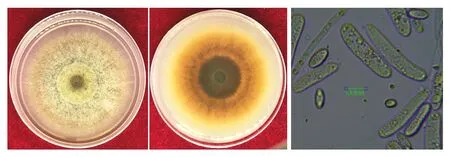
图3 人参锈腐菌分离及孢子形态观察
3.3 分子鉴定结果及系统发育树分析
选取其中4株代表性菌株,分别为XF001、XF002、XF003、XF004进行系统发育树构建。同时试验选用XF001进行后续试验。基于ITS rDNA系统发育分析结果显示,XF001菌株与登录号为MN091950.1的亲缘关系最近,处于系统发育树的同一分枝。因此,确定XF001为人参粗壮柱孢菌(Ilyonectriarobusta)。
3.4 具有明显趋化作用的Rg1皂苷单体质量浓度
生长速率法。PDA培养基中加入不同质量浓度Rg1皂苷单体,对人参锈腐病菌生长均有不同程度地促进作用,9 d后促进效果呈显著性差异。
当PDA培养基中加入的Rg1皂苷质量浓度为2 mg/L,25 ℃培养9 d时的菌丝颜色最深,为深棕褐色(图5)。菌落直径为(76.950 0±0.132 3)mm,菌丝生长促进率为10.710%。当皂苷质量浓度为0.5 mg/L时菌丝生长最慢,菌落直径为(69.583 3±4.125 6)mm,菌丝生长抑制率为3.844%。
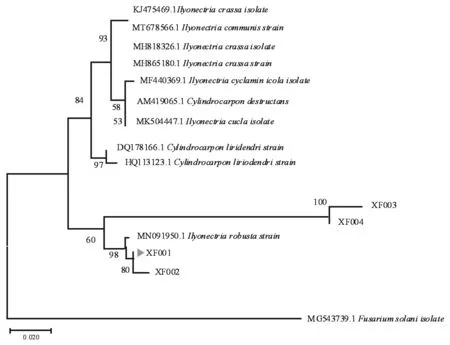
图4 基于ITS的rDNA系统发育树构建
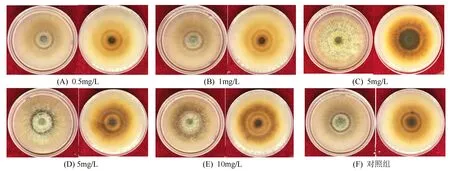
图5 生长速率照片
孢子萌发法。测定结果表明(表2),在6 h后人参皂苷Rg1对粗壮柱孢菌孢子的萌发呈显著性的促进作用。当Rg1质量浓度为2 mg/L时对柱孢菌孢子萌发促进效果最显著,SGR为(20.666 7±1.527 5)%。当Rg1质量浓度为0.5 mg/L时SGR为(14.666 7±0.577 4)%。与对照组相比对孢子萌发有抑制作用。
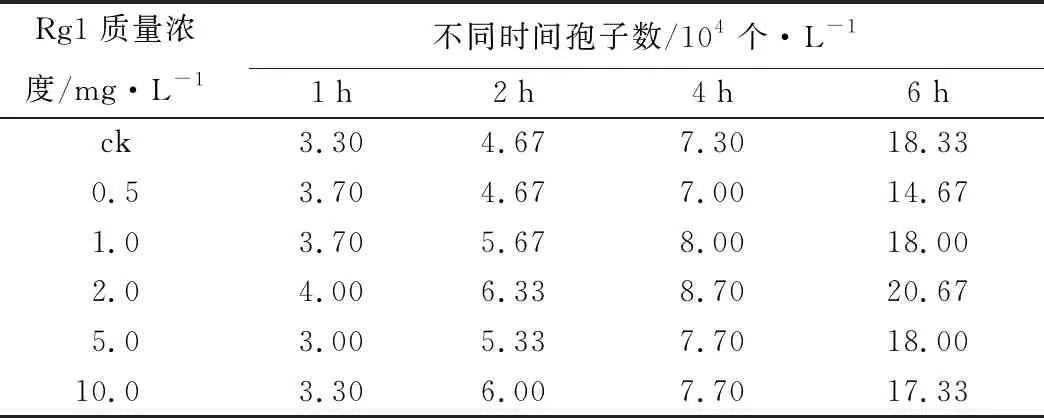
表2 不同质量浓度Rg1在1、2、4、6 h时柱孢菌孢子萌发率
菌丝干质量测量。菌丝干质量测定结果表明(表3),人参皂苷Rg1对粗壮柱孢菌孢子的菌丝生长具有较强的促进作用。当Rg1质量浓度为2 mg/L时对粗壮柱孢菌菌丝生长促进效果最好,菌丝干质量为(2.363 3±0.092 9)g。对照组菌丝干质量为(1.990 0±0.085 4)g;当Rg1质量浓度为0.5 mg/L时菌丝干质量为(1.963 3±0.066 6)g;当Rg1质量浓度为1 mg/L时菌丝干质量为(2.016 7±0.037 9)g;当Rg1质量浓度为5 mg/L时菌丝干质量为(2.116 7±0.025 2)g;当Rg1质量浓度为10 mg/L时菌丝干质量为(2.216 7±0.025 2)g。

表3 不同质量浓度Rg1对菌丝生长的影响
3.5 Rg1最适质量浓度对人参粗壮柱孢菌侵染相关酶活力
过氧化物酶(POD):试剂盒测定结果表明(表4),第5 d后当Rg1质量浓度为2 mg/L诱导条件下人参粗壮柱孢菌酶活性最强,且呈显著性差异。POD酶活性最高为(157.231 0±5.167 5)ng/L。当Rg1质量浓度为1 mg/L诱导条件下人参粗壮柱孢菌POD酶活性最低为(95.692 5±18.765 9)ng/L。

表4 侵染相关酶的标准曲线、线性范围
过氧化氢酶(CAT):试剂盒测定结果表明(表5),第5 d后当Rg1质量浓度为2 mg/L诱导条件下人参粗壮柱孢菌CAT酶活性最强,且呈显著性差异。CAT酶活性最高为(4.481 0±0.321 0)U/mL。对照组诱导条件下人参粗壮柱孢菌CAT酶活性最低为(1.607 5±0.962 4)U/mL。

表5 Rg1不同质量浓度时对人参粗壮柱孢菌POD、CAT、PPO、酶活性的影响
多酚氧化酶(PPO):试剂盒测定结果表明(表8),第5 d后当Rg1质量浓度为2 mg/L诱导条件下人参粗壮柱孢菌PPO酶活性最强,且呈显著性差异。PPO酶活性最高为(3.472 5±0.020 5)IU/L。当Rg1质量浓度为0.5 mg/L诱导条件下人参粗壮柱孢菌PPO酶活性最低为(1.585 0±0.114 6)IU/L。
3.6 Rg1最适质量浓度时不同pH值对菌丝生长的影响
培养9 d后,如图6和表6所示。人参粗壮柱孢菌在pH值4.0~8.0均可生长,其中pH值为5.0时病原菌生长最好,其菌落直径达(74.333 3±0.152 8)mm;菌丝干质量为(91.600 0±1.452 6)mg;在pH值为4.0时菌丝生长最慢,菌落直径为(58.600 0±0.458 3)mm;菌丝干质量为(45.766 7±0.305 5)mg;显著小于其他pH值条件下菌落直径(P<0.05)。pH值为6.0时菌落直径达(73.100 0±0.360 6)mm;菌丝干质量为(76.833 3±0.305 5)mg;pH值为7.0时菌落直径达(71.900 0±0.608 3)mm;菌丝干质量为(69.966 7±0.416 3)mg;pH值为8.0时菌落直径达(67.300 0±0.264 6)mm;菌丝干质量为(62.333 3±0.251 7)mg。
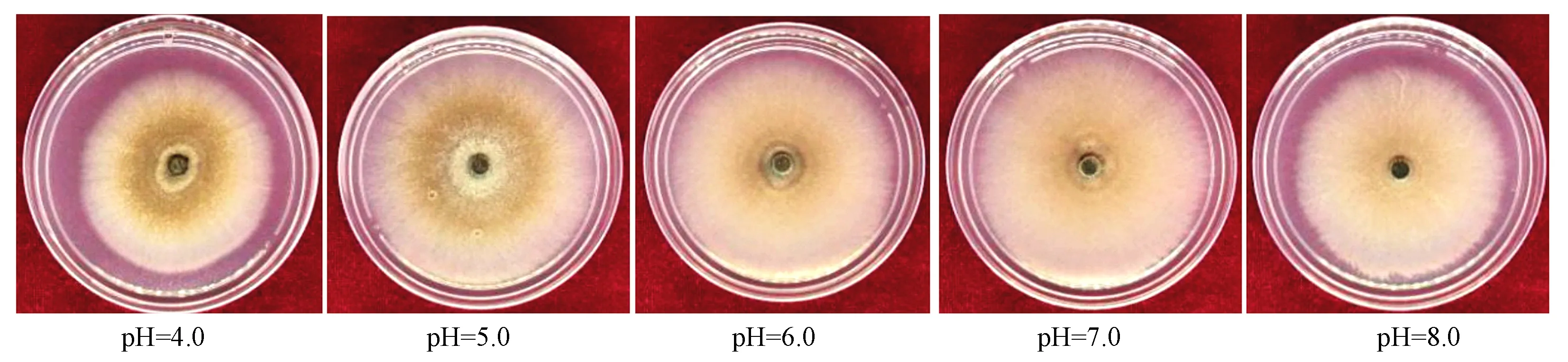
图6 不同pH值柱孢菌生长速率(9 d)
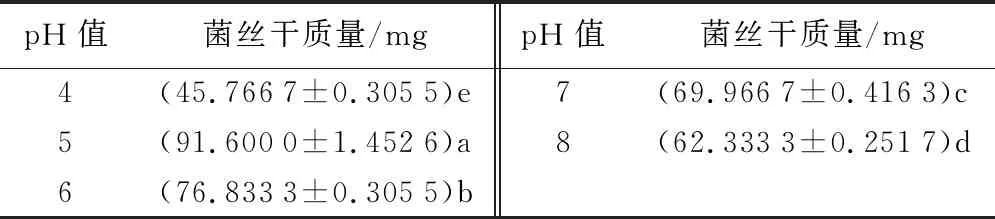
表6 不同pH值对菌丝干质量影响
3.7 Rg1最适质量浓度时不同碳源对菌丝生长的影响
研究表明,菌丝在不同碳源条件下培养至第9 d时,菌落生长均趋于缓慢。从表7可知,不同碳源对病原菌生长影响呈显著性差异(P<0.05)。与对照相比,甘露醇、蔗糖、麦芽糖和葡萄糖,均适宜病原菌生长;其中葡萄糖作为碳源菌丝生长最快,菌落直径为(70.666 7±2.362 9)mm,平均生长速率为6.963 mm/d,且菌丝致密,菌落较厚,边缘光滑;以甘露醇和蔗糖为碳源次之,菌落直径分别为(69.500 0±0.500 0)mm,平均生长速率为6.833 mm/d,(69.666 7±1.527 5)mm,平均生长速率为6.852 mm/d,菌落灰白色,菌丝致密;生长最差的碳源是乳糖,菌落直径(62.500 0±2.500 0)mm,平均生长速率为6.056 mm/d,菌丝呈现半透明状态,边缘平滑整齐。总体趋势由大到小为葡萄糖、蔗糖、甘露醇、麦芽糖、CK、果糖、木糖、乳糖。
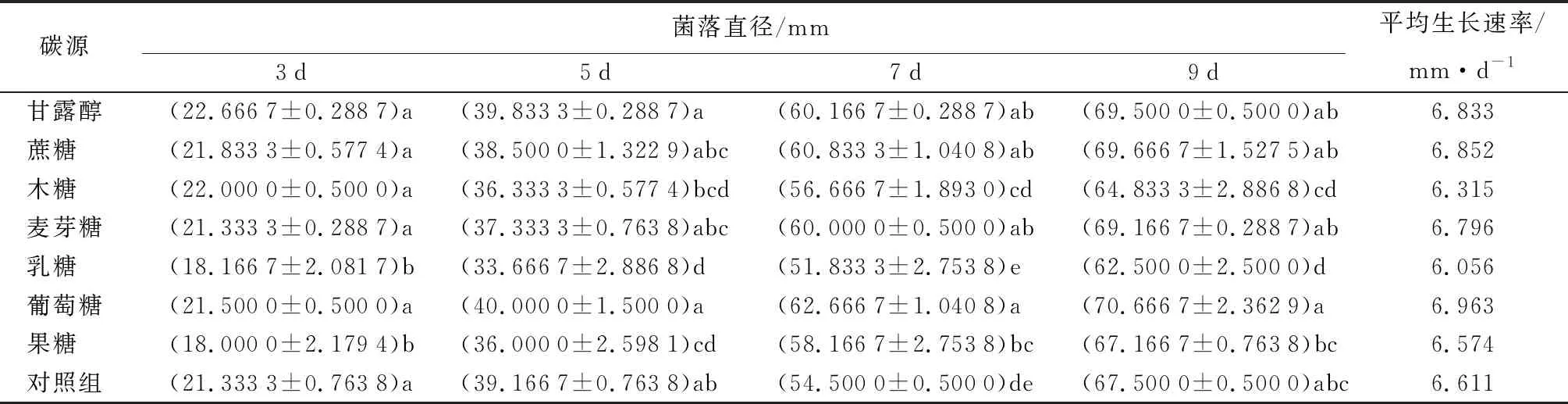
表7 病原菌在不同碳源上菌落直径和生长速率
3.8 Rg1最适质量浓度时不同氮源对菌丝生长的影响
研究表明,菌丝在不同氮源条件下培养至第9 d时,菌落生长均趋于缓慢(表8)。从表11可知,不同氮源对病原菌生长的影响呈显著性差异(P<0.05)。
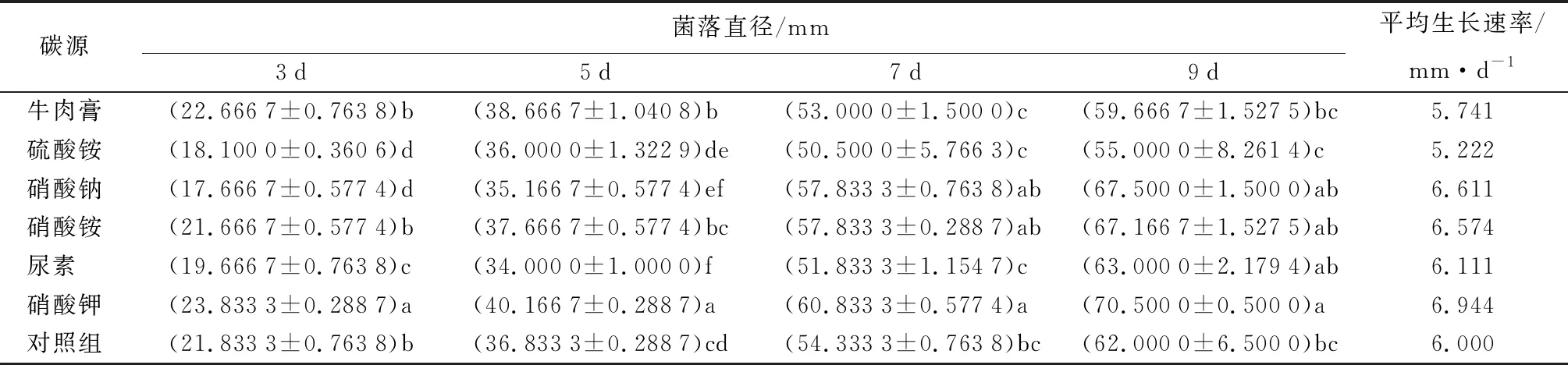
表8 不同氮源条件下病原菌菌落直径和生长速率
在氮源利用方面,硝酸钾作为氮源病原菌菌丝生长最好,菌落直径为(70.500 0±0.500 0)mm,平均生长速率为6.944 mm/d,菌落较厚,边缘光滑;其次是硝酸铵作为氮源,菌落直径为(67.166 7±1.527 5)mm,平均生长速率为6.574 mm/d,菌落略薄,边缘光滑;硫酸铵为氮源,生长最差,菌落直径(55.000 0±8.261 4)mm,平均生长速率为5.222 mm/d,菌落较厚,菌丝为白色丝绒状,边缘不规则。
4 结论与讨论
由柱孢菌属(Cylindrocarponspp)引起的人参锈腐病,因其可在土壤中可存活多年,且病原菌可逐年累积,是人参连作障碍中发生最普遍和最严重的土传病害。粗壮柱孢菌作为引起人参锈腐病分离频率最高,致病能力最强的病原菌,在人参锈腐病的研究中显得尤为重要。人参连作障碍,一直以来是人参栽培上的一大难题,不仅降低人参的产量和品质,带来巨大经济损失,同时严重制约着人参产业的可持续发展。人参皂苷是人参生长过程中产生的一类主要次生代谢产物,在植物体与微生物之间起着一定调节作用,而且由于皂苷在土壤中的累积,尤其是Rg1的质量浓度对人参锈腐病菌的趋化作用以及对人参本身的自毒作用,与人参连作障碍是否有关,关系有多大,是必须要解决的科学问题。
匙坤等[15]研究人参锈腐菌分别对低、中质量浓度的人参总皂苷表现出较强的化学趋向性响应,而且在最优趋化参数下人参锈腐菌的SGR、CGR以及MG等都得到了显著提高,但却随人参总皂苷质量浓度的升高而降低,尤其在进行高浓度培养时,人参锈腐菌仍然保持着正的化学趋向性响应。采用趋化性实验,确定人参锈腐菌分别对不同质量浓度的人参总皂苷表现出不同程度的化学趋向性响应。
CAT能够促使H2O2分解为分子氧和水,清除体内的过氧化氢,从而使细胞免于遭受H2O2的毒害[17]。多酚氧化酶(PPO)是一类核基因编码酶,受多个基因控制,主要存在质体类囊体腔中,在植物中主要指儿茶酚氧化酶。PPO对植物抵御外界胁迫、光合作用、生物合成等起重要作用,但在果蔬中PPO常引起负面效应,使颜色、味道、营养等受到破坏,严重影响制品的外观品质。
本研究通过生长速率法、菌丝干重法、孢子萌发法相结合研究Rg1对人参粗壮柱孢菌的影响,初步确定当Rg1质量浓度为2 mg/L时对引起人参锈腐病的粗壮柱孢菌(Ilyonectriarobusta)有显著促进作用。通过对人参粗壮柱孢菌侵染相关酶活力测定进一步确定当Rg1质量浓度为2 mg/L时对人参粗壮柱孢菌有显著促进作用。在Rg1皂苷最适诱导条件下CAT、PPO、POD能增强人参锈腐菌侵染人参的能力。
张鸿雁等[18]研究当pH值为6~7时生长速度达到高峰,pH值再增加,生长逐渐减弱,毁灭柱孢菌最适合生长pH值为6.2左右,中性偏酸环境。本研究结果表明在Rg1质量浓度为2 mg/L时最适粗壮柱孢菌生长的培养基pH值是5.0。最适粗壮柱孢菌生长的碳源是葡萄糖,氮源是硝酸钾。
综上,当人参皂苷Rg1质量浓度为2 mg/L时对人参粗壮柱孢菌的生长发育具有较强的促进作用,在此条件下粗壮柱孢菌的侵染相关酶的活力最高。研究结果为揭示人参忌地性以及连作障碍产生的原因提供参考依据,也为生产上更加有针对性的防治该病害奠定基础。

