具核梭杆菌对炎症小体NLRP3的诱导作用对食管鳞状细胞癌患者生存期的影响
张哲源,刘怡文,付 臻,杨 洪,张 宁,梁梦夏,李婉莹,孔金玉,孙 蔚,杨海军,
张耀文6,7),周福有1,6,8)
1)河南科技大学临床医学院;河南科技大学第一附属医院;河南省微生态与食管癌防治重点实验室;河南省肿瘤表观遗传重点实验室 河南洛阳 471003 2)河南科技大学附属安阳市肿瘤医院影像科 河南安阳455000 3)河南科技大学体育学院 河南洛阳 471003 4)河南科技大学附属安阳市肿瘤医院内镜诊疗中心 河南安阳 455000 5)河南科技大学附属安阳市肿瘤医院病理科 河南安阳 455000 6)河南省食管癌精准防治医学重点实验室 河南安阳 455000 7)河南科技大学附属安阳市肿瘤医院放疗科 河南安阳 455000 8)河南科技大学附属安阳市肿瘤医院胸外科 河南安阳 455000
食管癌发病率与病死率极高,我国以食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)为主。目前ESCC的治疗主要有手术、放化疗及免疫治疗等,但效果仍不理想[1]。研究[2]表明,多种病原微生物长期定植于机体可促进ESCC进展。具核梭杆菌(Fusobacteriumnucleatum,Fn)为毒力最强的口腔致病菌之一,与ESCC发生发展密切相关,但其具体致病机制尚不完全明确。研究[3]显示,病原微生物可通过调控宿主免疫应答引发炎症反应,协助肿瘤细胞逃避免疫监视,为自身长期定植提供有利条件。炎症反应由多种炎症小体诱发,其中核苷酸结合寡聚化结构域样受体蛋白 3(NOD-like receptor protein 3,NLRP3)是炎症小体中关键的调控蛋白之一[4],NLRP3可通过维持肿瘤细胞干性,促进多种肿瘤恶性进展并协助其化疗抵抗[5]。因此推测Fn可能通过诱导NLRP3表达,引发机体炎症反应,促进ESCC恶性进展。本研究首先检测Fn感染后ESCC细胞对顺铂(cis-diamine dichloroplatinum,CDDP)与紫杉醇(pachitaxel,PTX)的敏感性及NLRP3表达的变化,初步分析Fn诱导ESCC中NLRP3表达对CDDP与PTX化疗的影响,并通过检测ESCC组织中Fn感染及NLRP3蛋白的表达情况,进一步分析Fn对NLRP3的诱导效应与患者病理特征及生存期的关系,为ESCC治疗提供新思路和治疗手段。
1 材料与方法
1.1 ESCC及癌旁正常组织的来源本研究于术前获得患者知情同意,经河南科技大学附属安阳市肿瘤医院伦理委员会审核批准,共纳入2015年1至12月手术切除的213例ESCC及相应癌旁正常组织标本。纳入标准:①治疗性ESCC切除术后。②患者术前无呼吸系统等其他疾病。③术后病理诊断明确为ESCC,且未合并其他肿瘤。④病例资料信息全面。⑤随访时间5 a。⑥术后常规“CDDP+PTX”(TP)方案化疗,且未接受放疗或免疫治疗。病例的临床病理特征如下:男134例,女79例;年龄<60岁98例,≥60岁115例;吸烟106例,不吸烟107例;饮酒102例,不饮酒111例;低分化32例,中分化99例,高分化82例;侵及外膜146例,未侵及外膜67例;有淋巴结转移99例,无淋巴结转移114例;临床分期为Ⅰ/Ⅱ期123例,Ⅲ/Ⅳ期90例。
1.2 细胞、试剂与仪器ESCC细胞系KYSE30及 KYSE150(上海博谷生物科技有限公司),Fn菌株(ATCC 2558,美国路易斯维尔大学)。CDDP与PTX(美国Selleck Chemicals公司)。脑心浸液培养基(法国梅里埃公司);无菌脱纤维绵羊血、DAB显色液、pH 6.0柠檬酸抗原修复液(北京索莱宝科技有限公司);RPMI 1640培养基及胎牛血清(美国Gibco公司);CCK-8试剂盒(日本同仁化学研究所);SP法免疫组化试剂盒(北京中杉金桥生物技术有限公司);NLRP3及GAPDH兔抗人单克隆抗体(美国Abcam公司);RNAscope试剂盒及Fn 16S rRNA特异探针(美国Advanced Cell Diagnostics公司);山羊抗兔IgG和BCA蛋白定量试剂盒(江苏康为世纪生物科技有限公司);ECL发光显影液(美国Invitrogen公司)。NLRP3 上游引物5’-CGTGAGTC CCATTAAGATGGAGT-3’,下游引物5’-CTCGA CAGTGGATATAGAACAGA-3’,产物大小191 bp;GAPDH上游引物5’-GCACCGTCAAGGCTGAGAAC-3’,下游引物5’-TGGTGAAGACGCCAGTGGA-3’,产物大小138 bp(上海生工生物工程股份有限公司)。反转录及qRT-PCR试剂盒(南京诺唯赞生物科技股份有限公司);凝胶成像系统及荧光定量PCR仪(美国Bio-Rad公司);光学显微镜(日本Nikon公司);厌氧工作站(美国COY公司)。
1.3 细胞实验分组Fn在脑心浸液培养基(含体积分数5%无菌脱纤维绵羊血、10 g/L氯化血红蛋白和1 g/L维生素K1)中,于37 ℃体积分数85%N2、10%H2和5%CO2的厌氧工作站常规培养。利用革兰染色法及哥伦比亚血琼脂板检测Fn纯度,选取活力较好的Fn菌液[OD(600 nm)=1~2],待KYSE30及KYSE150细胞密度为60%~70%时,以感染复数=10将菌液加入细胞培养基中,分4组,分别感染12、24、48及72 h。另设未感染细胞作为对照。
1.4 KYSE30、KYSE150细胞CDDP与PTX的半数抑制浓度(IC50)测定采用CCK-8法。96孔板中每孔接种100 μL细胞悬液(每孔1 000个细胞),置于培养箱预培养24 h(37 ℃,体积分数5%CO2)。每种细胞均设置1个对照孔及不同浓度的实验孔(药物浓度从0.25 mg/L开始,0.25 mg/L递增,直至30.00 mg/L),按上述浓度分别加入CDDP与PTX,培养24 h。每孔加入CCK-8试剂10 μL,1 h后酶标仪测定450 nm处吸光度并计算IC50[6]。实验重复3次。
1.5 各组KYSE30、KYSE150 细胞中NLRP3蛋白表达的检测提取各组KYSE30及KYSE150细胞新鲜蛋白后,用BCA蛋白定量试剂盒检测浓度并定量。每泳道上样量为30 μg总蛋白,蛋白SDS-PAGE电泳分离,并转移至PVDF膜上。用含50 g/L脱脂牛奶的TBST室温封闭1 h,加入NLRP3(1∶1 000稀释)和GAPDH(1∶2 000稀释)抗体4 ℃孵育过夜。加入山羊抗兔IgG(1∶2 000稀释)室温孵育2 h,ECL发光显影,凝胶成像系统采集图像,并应用Image Lab软件进行条带灰度值测定,以目的蛋白与内参条带灰度值比值作为目的蛋白相对表达量。实验重复3次。
1.6 各组KYSE30、KYSE150 细胞中NLRP3 mRNA表达的检测采用Trizol法提取细胞总RNA,具体步骤参考文献[7]。反转录反应体系为5×RT缓冲液4 μL、RT酶混合液1 μL、引物混合液1 μL、RNA模板2 μL,加无RNA酶水至20 μL。反转录反应条件:37 ℃15 min,98 ℃ 5 min。qRT-PCR反应体系为2×qRT-PCR混合液10 μL,20 μmol/L上下游引物各0.1 μL,cDNA 模板2 μL,加ddH2O 至20 μL。反应条件:95 ℃1 min;95 ℃ 15 s,60 ℃ 30 s,72 ℃ 45 s,共 40 个循环。采用2-ΔΔCt法计算NLRP3 mRNA的相对表达量。实验重复3次。
1.7 ESCC及癌旁正常组织中Fn感染的检测取石蜡包埋的ESCC组织切片(片厚2.5 μm),常规脱蜡,RNAscope 双氧水孵育10 min,靶标修复试剂修复15 min,RNAscope 蛋白酶孵育10 min,加入Fn探针40 ℃杂交2 h;RNAscope显色液1~6号试剂,分别于40 ℃孵育30、15、30、15 min,室温孵育30、15 min;RED工作液室温孵育10 min,苏木精复染2 min,封片。400倍镜下取5个视野进行观察。参照文献[7-8]进行判定:细胞中单独的红色颗粒≥5个为Fn感染阳性细胞;每个视野阳性细胞比例均>30%为阳性标本。
1.8 ESCC及癌旁正常组织中NLRP3蛋白表达的检测取石蜡包埋的ESCC组织连续切片(片厚2.5 μm),常规脱蜡,梯度乙醇水化,柠檬酸高温修复20 min,过氧化物酶阻断剂避光封闭10 min,山羊血清封闭30 min,NLRP3抗体(1∶200稀释)4 ℃孵育过夜,山羊抗鼠/兔聚合物室温孵育30 min,SP试剂封闭10 min,DAB显色8 min,镜下监测显色结果,苏木精复染8 min,梯度乙醇脱水,二甲苯透明10 min,中性树胶封片。以已知NLRP3阳性表达的组织切片作为阳性对照;PBS代替一抗作为阴性对照。400倍镜下取5个视野进行观察。胞浆出现浅黄色、棕黄色或棕褐色颗粒为NLRP3阳性表达。按染色强度评分:0分,未着色;1分,浅黄色着色;2分,棕黄色着色;3分,棕褐色着色。按染色面积评分:每个视野阳性细胞比例均<5%为0分,5%~为1分,25%~为2分,50%~为3分,≥75%为4分。取2项评分之积:0分为阴性,≥1分为阳性[9]。将RNAscope及免疫组化结果2张连续切片中Fn及NLRP3同时判定为阳性的组织标本定义为Fn诱导NLRP3表达阳性组,以Fn+NLRP3阳性组表示;不满足2张连续切片同时阳性的为阴性组,以Fn+NLRP3阴性组表示。
1.9 统计学处理采用SPSS 26.0进行数据分析。不同组间KYSE30和KYSE150细胞CDDP与PTX 24 hIC50、NLRP3蛋白及mRNA相对表达量的比较均采用单因素方差分析和SNK-q检验。ESCC及癌旁正常组织中Fn感染率及NLRP3阳性表达率的比较采用McNemar检验,ESCC组织中Fn感染与NLRP3表达的一致性分析采用Cohen′sKappa检验。Fn+NLRP3阴性和阳性组患者临床病理特征的比较采用χ2检验,采用Kaplan-Meier法绘制2组的生存曲线并进行Log-rank检验。生存时间为入院至最后1次随访或死亡(随访时间为60个月)的时间,删失数据为随访至60个月仍存活的患者,未删失数据为由ESCC导致的死亡患者。检验水准α=0.05。
2 结果
2.1 各组KYSE30及KYSE150 细胞CDDP与PTX 24 hIC50的比较结果见表1。与Fn未感染组相比,各Fn感染组KYSE30及KYSE150细胞CDDP与PTX 24 hIC50均增高,且IC50随Fn感染时间的延长而逐渐增加。
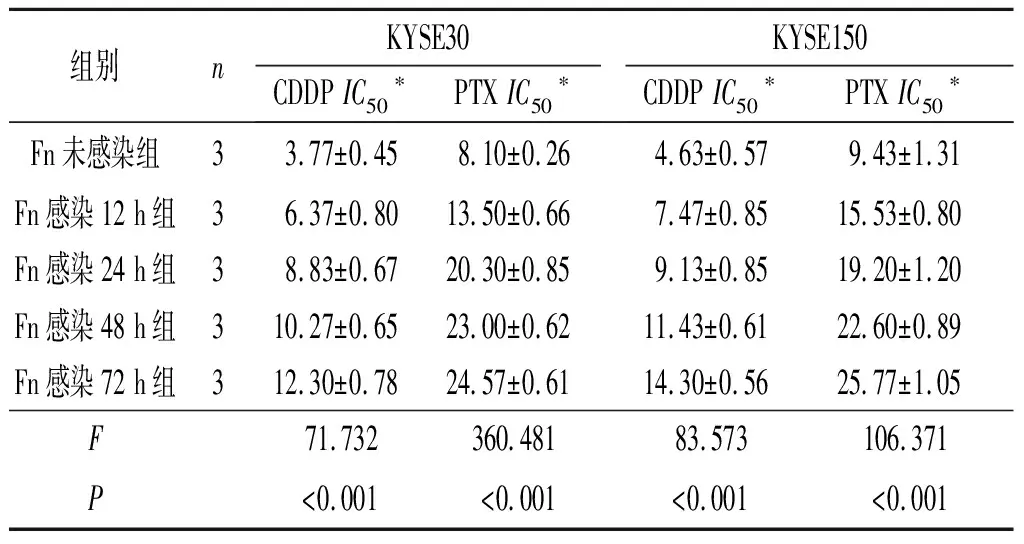
表1 各组KYSE30及KYSE150细胞CDDP与PTX 24 h IC50的比较 mg/L
2.2 各组KYSE30及KYSE150细胞中NLRP3蛋白及mRNA表达的比较结果见图1、表2。与Fn未感染组相比,各Fn感染组KYSE30及KYSE150 细胞中NLRP3蛋白及mRNA相对表达量均增高,且NLRP3蛋白及mRNA相对表达量均随Fn感染时间的延长而逐渐增加。
2.3 ESCC及癌旁正常组织中Fn感染与NLRP3的表达结果见表3~5。ESCC组织中Fn感染与NLRP3表达具有一致性。
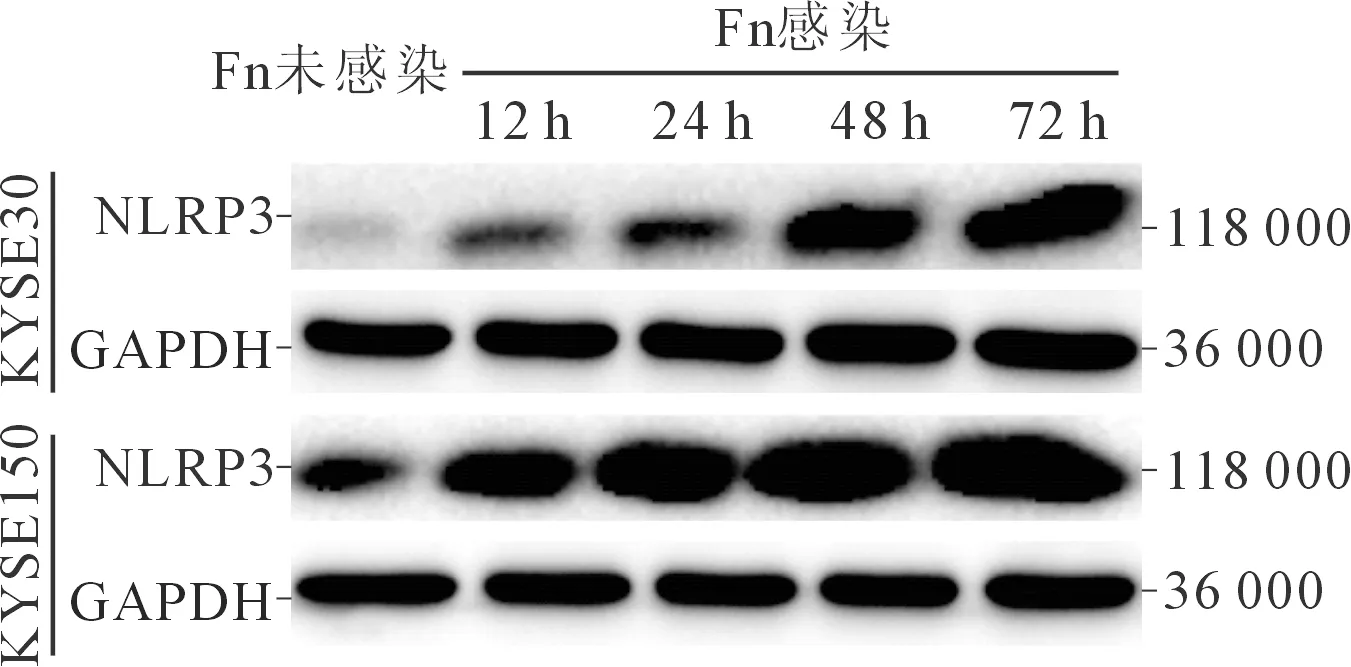
图1 各组KYSE30及KYSE150细胞中NLRP3蛋白的表达
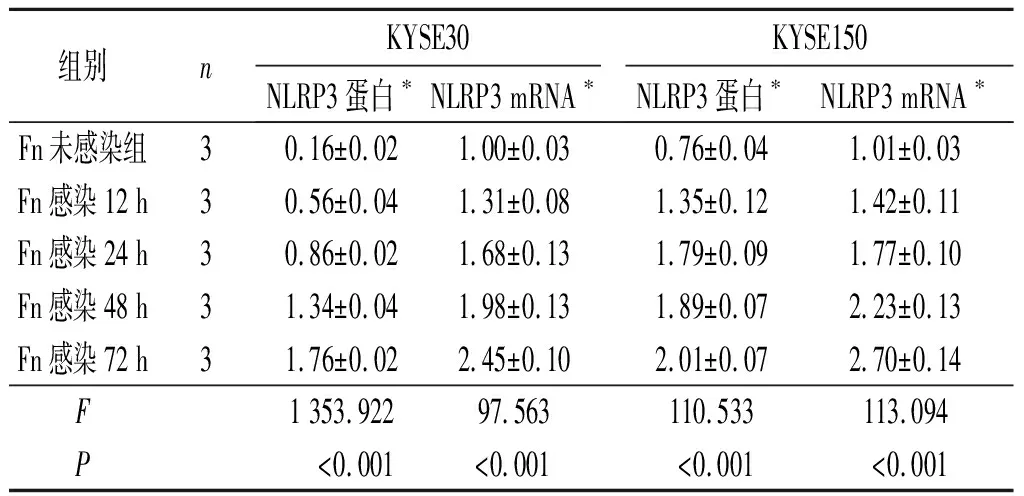
表2 各组KYSE30及KYSE150细胞中NLRP3蛋白及mRNA表达的比较
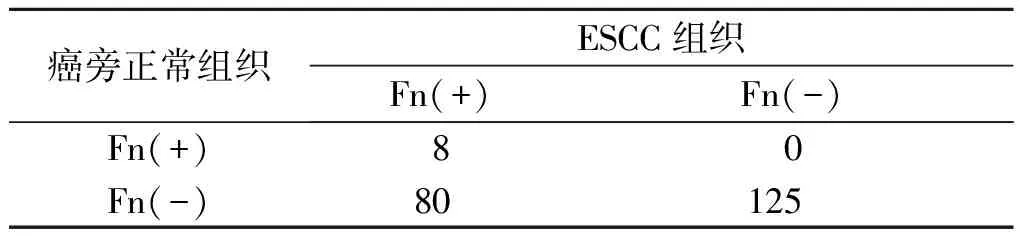
表3 ESCC及癌旁正常组织中Fn感染率的比较 例
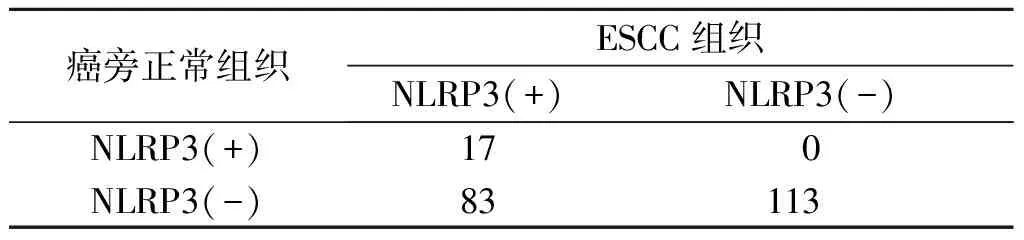
表4 ESCC及癌旁正常组织中NLRP3阳性表达率的比较 例
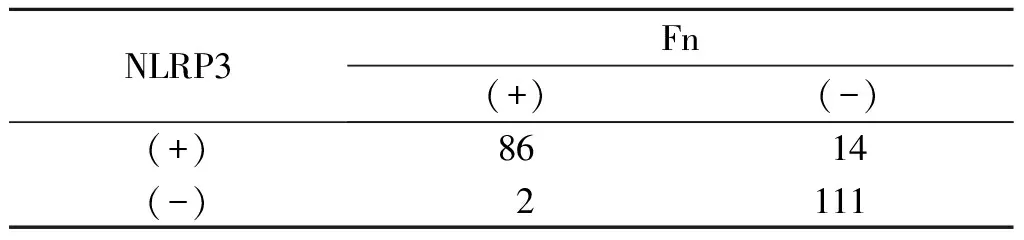
表5 ESCC组织中Fn感染与NLRP3表达的一致性 例
2.4 Fn+NLRP3阴性和阳性组病例临床病理特征的比较Fn+NLRP3阴性组127例,阳性组86例。Fn+NLRP3阳性组患者中男性、吸烟、饮酒者居多,且多为低分化,肿瘤浸润程度较深,淋巴结转移增加,临床分期多为Ⅲ/Ⅳ期(表6)。

表6 Fn+NLRP3阴性和阳性组病例临床病理特征的比较 例
2.5 Fn+NLRP3阴性和阳性组患者预后的比较两组的生存曲线见图2。Fn+NLRP3阳性组中位生存时间(四分位数)为19.00(9.00,35.00)个月,低于阴性组的40.00(20.00,-)个月(χ2=43.027,P<0.001)。
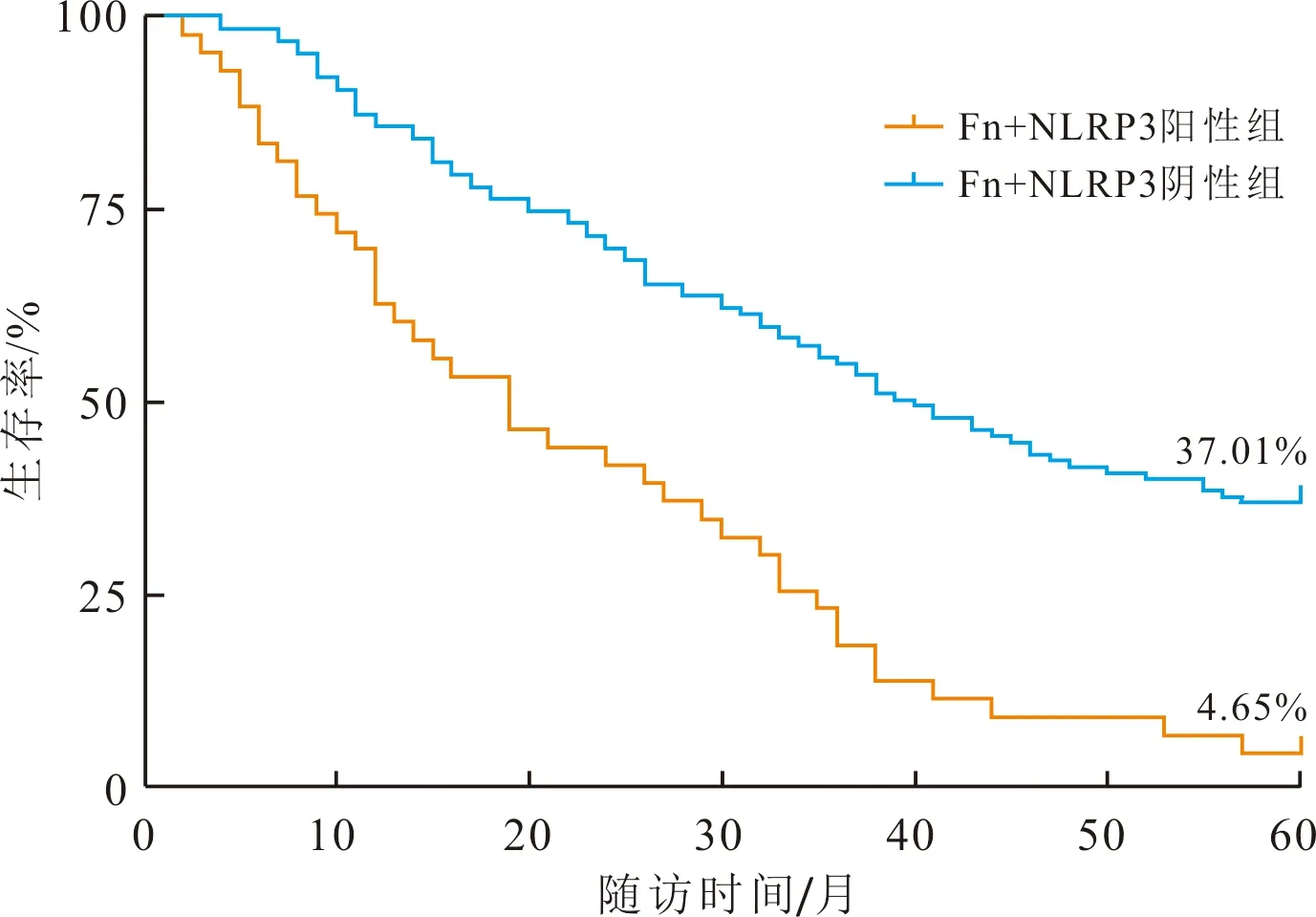
图2 Fn+NLRP3阴性组与阳性组ESCC患者术后5 a生存曲线
3 讨论
ESCC是常见的消化道恶性肿瘤,发病率与病死率较高。随着临床医学的不断进步,ESCC的治疗效果明显好转,但预后仍较差[1]。因此,寻找精准的早期指标、有效的预防措施及靶向治疗方法,非常重要。Fn为革兰阴性厌氧菌,广泛定植于口腔和消化道内,近年来被认定为具有毒性的条件致病菌,可促进口腔鳞状细胞癌、ESCC以及结肠癌等多种肿瘤的恶性进展[10]。本研究证实ESCC组织中Fn感染率高于癌旁正常组织,提示癌组织的微环境更适于Fn定植,但其具体致病机制尚未完全明确。
资料[4]显示,宿主抵抗病原微生物入侵的第一道保护屏障为机体的固有免疫系统,其主要成分为炎症复合体,而NLRP3是炎症复合体家族中重要成员之一,主要在胞浆监测危险信号,识别各种病原微生物及其代谢产物,激活Caspase-1,使IL-1β等促炎因子成熟并释放到胞外,从而调节免疫应答并引起炎症反应,增强肿瘤细胞增殖、侵袭及抗凋亡能力,且降低其对药物的敏感性。病原微生物对NLRP3炎症小体的活化作用参与了多种肿瘤的发生发展。幽门螺杆菌可活化胃癌及胃黏膜细胞中NLRP3蛋白,导致髓源性抑制细胞募集与增殖,增强胃癌细胞侵袭能力及抗凋亡能力[11];EB病毒可诱导鼻咽癌细胞NLRP3表达,促进其远处转移,并显著缩短患者生存期[12];HPV可激活宫颈癌细胞NLRP3蛋白,促进肿瘤恶性增殖和血管生成[13]。同时NLRP3在多种肿瘤的药物抵抗中也发挥着重要作用。如淋巴瘤细胞中NLRP3炎症小体通路的活化可促进其抗凋亡能力,降低化疗药物的疗效[14];胰腺癌细胞中NLRP3炎症小体通路被激活,可引起胰腺癌细胞分泌IL-1β增多,干性增强,导致治疗抵抗[15]。本研究发现随Fn感染时间的延长,ESCC细胞中NLRP3表达量逐渐增高,且CDDP与PTX化疗的敏感性逐渐减弱,提示NLRP3在Fn感染引起的化疗抵抗中发挥重要作用,表明Fn可通过诱导ESCC细胞中NLRP3表达,引发机体炎症反应,协助肿瘤细胞化疗抵抗。
本研究中ESCC组织免疫组化结果与细胞实验结果一致,即ESCC患者癌组织中NLRP3表达与Fn感染具有一致性,而癌旁正常组织中二者多为阴性表达,提示Fn可通过诱导NLRP3表达,为自身长期定植提供有利条件。本研究还发现Fn+NLRP3阳性组患者中男性、吸烟、饮酒者居多,提示长期吸烟、饮酒的男性患者口腔环境更加恶劣,Fn更容易感染并定植,从而诱导NLRP3表达。且随肿瘤分化程度降低,阳性组患者比例增加,提示Fn对NLRP3的诱导效应与肿瘤的恶性程度有关。且阳性组患者肿瘤组织浸润程度较深、淋巴结转移增加及临床分期多为Ⅲ/Ⅳ期,提示该效应促进了ESCC的恶性增殖及转移。同时,接受术后常规TP方案化疗的ESCC患者中,Fn+NLRP3阳性组患者中位生存时间缩短,提示Fn可通过诱导ESCC细胞中NLRP3表达削弱TP方案化疗疗效,严重影响患者预后,而有效清除Fn并抑制NLRP3表达可延长ESCC患者生存期。
由于肿瘤的发生发展是一个多因素、多步骤的演变过程,Fn的具体致病机制有待进一步探讨,但打破Fn在宿主体内持久定植的现状,并有效抑制NLRP3,对于积极有效地延缓ESCC化疗抵抗并延长患者生存期具有非常重要的意义。

