某院598例药品不良反应报告统计分析
江莹 陈璋璋 许青 吕迁洲 李晓宇
摘 要 目的:分析某三级甲等医院上报的药品不良反应(adverse drug reactions, ADR)的发生特点,以提高临床安全用药水平。方法:收集该院2021年上报至国家药品不良反应监测中心的ADR报告,对患者性别、年龄、原患疾病、怀疑药品、给药时间、给药频次等相关因素进行回顾性分析。结果:该院2021年上报的ADR总例数为598例,其中25.42%的ADR报告与抗肿瘤药物有关,其次为抗感染药物(24.25%);≥65岁年龄段患者的ADR报告率最高(45.32%)。ADR报告中以消化系统损害最为多见(30.11%);给药途径中以经静脉用药的ADR报告率最高(48.16%)。结论:在日常ADR监测中,应重点监测使用抗肿瘤药物、年龄≥65岁、经静脉给药和联用多种药物的患者。消化系统、皮肤及皮肤附件损害是常见的ADR信号。临床医生应不断提高安全用药的意识和认识,从而使患者获得更好的健康效益。
关键词 药品不良反应 合理用药 监测
中图分类号:R969.3 文献标志码:C 文章编号:1006-1533(2022)05-0024-04
引用本文 江莹, 陈璋璋, 许青, 等. 某院598例药品不良反应报告统计分析[J]. 上海医药, 2022, 43(5): 24-27; 57.
基金项目:国家自然科学基金青年基金项目(82003995)
Retrospective analysis of 598 cases of adverse drug reactions in a hospital
JIANG Ying, CHEN Zhangzhang, XU Qing, LYU Qianzhou, LI Xiaoyu
(Department of Pharamcy, Zhongshan Hospital, Fudan University, Shanghai 200032, China)
ABSTRACT Objective: The characteristics of adverse drug reactions (ADR) were determined, to provide information for rational use of drugs in clinic. Methods: ADR reports from the National Center For ADR during 2021 were retrospectively analyzed in terms of gender, age, disease, suspicious drugs, delivery time, delivery frequency. Results: A total of 598 ADR cases were reported, in which 25.42% were related to anti-tumor drugs, followed by anti-infective drugs (24.25%). The incidence of ADR was the highest in the age group ≥65 years old (45.32%), the system/organs injury mainly occurred in the digestive system(30.11%) and the incidence of ADR caused by intravenous infusion in the drug delivery route accounted for 48.16%. Conclusion: In daily monitoring of ADR, patients who are using anti-tumor drug, older than 65 years old, adopting intravenous infusion route and administrating multiple drugs should be monitored. Digestive system injury and skin and accessory injury are common ADR signals, and great attention should be paid to safe use of drugs so as to achieve better health benefit for patients.
KEy WORDS adverse drug reactions; rational drug use; monitoring
醫院所见药品不良反应(adverse drug reactions, ADR)多发生在病情发展或联用多种药物的患者中,上报至国家药品不良反应监测中心的ADR大部分发生于住院患者。为了解ADR的发生规律和特点,本研究回顾性分析某三级甲等医院2021年上报至国家药品不良反应监测中心的598例ADR报告的情况,以期提高临床医生安全用药的意识和认知。
1.1 资料来源
收集某三级甲等医院2021年上报至国家药品不良反应监测中心的598例ADR报告,提取相关信息,进行回顾性分析。
1.2 统计方法
按照《药品不良反应报告和监测管理办法》(卫生部令第81号)[1]所定标准对ADR进行其与药品的关联性评价和严重程度评估 ,同时参照《WHO药品不良反应术语集》[2]对ADR累及器官/系统情况及其主要临床表现进行统计。采用Excel 2013软件对患者年龄、性别、怀疑药品、合并用药、给药途径、用药起止时间、ADR过程描述、转归等信息进行描述性统计,计数资料以构成比表示。
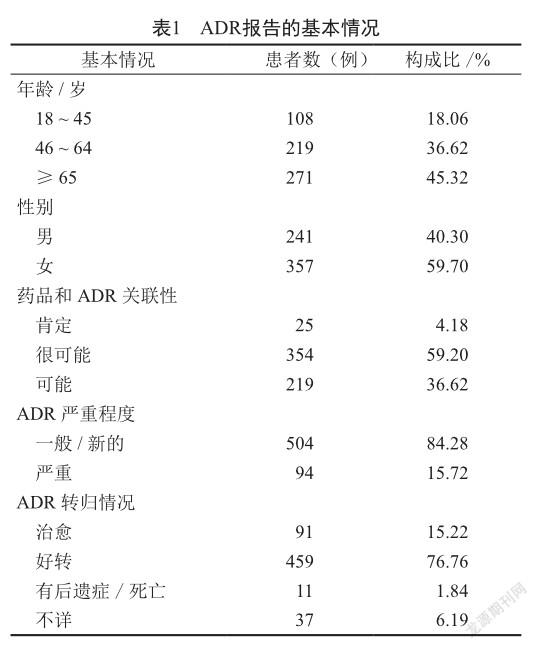
2.1 ADR报告的基本情况
在598例ADR报告中,女性患者为357例(59.70%),男性患者为241例(40.30%),女性患者占比高于男性患者。从患者年龄段看,≥65岁的最多(271例),其次为46 ~ 64岁患者(219例)。ADR严重程度,严重的为94例(15.72%),一般或新的为504例(84.28%)。药品和ADR关联性评价,肯定的为25例,很可能的为354例。598例ADR患者中,550例经停用药物等对症处理后治愈或好转,11例经治疗后有后遗症或死亡,37例转归情况不详(表1)。
2.2 ADR报告涉及的药品种类分布情况
598例ADR报告涉及的药品种类包括抗肿瘤药物、抗感染药物、免疫调节剂、解热镇痛药物、抗病毒药物、肠外/肠内营养制剂、专科药物等,其中排名前三的药品种类依次为抗肿瘤药物(152例,25.42%)、抗感染药物(145例,24.25%)和心血管系统药物(64例,10.70%。表2)。此外,375例(62.71%)ADR患者在联用≥3种药品。

2.3 ADR报告涉及的给药途径
598例ADR报告共涉及6种给药途径,其中经静脉用药的ADR报告数最高(288例,48.16%),以下依次为口服用药(276例,46.15%)、皮下注射(24例,4.01%)、肌内注射(5例,0.84%)、吸入用药(3例,0.50%)和局部用药(2例,0.33%)。
2.4 ADR累及器官/系统及其主要临床表现
参照《WHO药品不良反应术语集》对ADR累及系统/器官进行统计,发现598例ADR共累及11类器官/系统,其中以消化系统损害最为多见(199例次,30.11%),临床上主要表现为恶心/呕吐、消化道出血、肝功能损害等,其次为皮肤及皮肤附件损害(156例次,23.60%。表3)。

2.5 抗肿瘤药物严重ADR涉及的药品种类和主要临床表现
在94例严重ADR报告中,涉及抗肿瘤药物的报告数最多(47例),其中联合用药的39例,单独用药的8例,共涉及抗肿瘤药物品种15个,其中口服剂型3个(表4)。在47例抗肿瘤药物严重ADR报告中,涉及程序性细胞死亡受体-1(programmed cell death receptor-1, PD-1)/程序性细胞死亡受体配体-1(programmed cell death receptor ligand-1, PD-L1)抑制剂的报告数为29例,其中包括3级肠炎5例、3级心肌炎7例、3级肝炎4例、4级肝炎1例。这29例患者经糖皮质激素冲击治疗和对症治疗后有15例患者的ADR情况缓解,1例患者因肝衰竭导致全身多器官功能衰竭而死亡。此外,涉及络铂类药物的严重ADR报告数为10例,涉及酪氨酸激酶抑制剂的严重ADR报告数为4例。

3.1 患者年龄、性别对ADR发生率的影响
本研究发现,女性患者的ADR发生率高于男性患者(分别为59.70%和40.30%),这可能与男、女性解剖和生理上的差异有关,如体质量、身体组成、胃肠道动力、肝和肾功能都会影响药物的代谢。与男性相比,女性体质量低、器官小、体脂多,体液总量、胃肠道动力和肾小球滤过率也都较低,这些差异对药物的吸收、分布、代谢和消除都有一定的影响。患者年龄对ADR的发生也有显著影响,尤其是儿童和老年患者,这些患者在药物临床试验中通常未被广泛纳入研究。本研究发现,≥65岁年龄段患者的ADR发生率最高,其次是46 ~ 64岁年龄段患者,这与相关研究结果一致[3]。老年患者易发生ADR的主要原因包括:一方面,他们的器官代偿能力和生理功能都已有所减退,药物代谢和排泄速率減缓,使得药物易在体内蓄积;另一方面,他们合并的基础疾病较多,通常多药联用,药物相互作用风险较高。因此,在临床实践中,除须综合评估患者的病情外,还需考虑到患者的年龄、合并疾病、联用的药物等因素,为其制定个体化的治疗方案。
3.2 药品给药途径对ADR发生率的影响
ADR最易发生于经静脉给药的患者中。经静脉给药起效快、剂量可控,是临床上常用的给药途径,但因药物避开了肝脏首过效应而直接进入血液系统,对机体的刺激也随之增强,容易发生ADR。所以,临床用药应遵循“能口服的不采用肌内注射,能肌内注射的不采用经静脉给药”的原则,合理选择给药途径。
3.3 药品种类对ADR发生率的影响
多药联用在临床上非常普遍,是导致ADR高发的重要原因之一。研究表明,使用1种或2种药物的ADR发生率很低,而随着使用的药物品种数增加,ADR发生率也随之增加。在本研究中,375例ADR患者(62.71%)使用了≥3种药品,说明多药联用确会增加ADR的发生率。此外,可能与医院患者的构成有关,在本研究中,抗肿瘤药物的ADR报告率最高,涉及到的抗肿瘤药物包括微管蛋白活性抑制药、络铂类药物、单克隆抗体和靶向抗肿瘤药物等,ADR表现以血液系统、消化系统损害为主,与抗肿瘤药物无法精准识别肿瘤细胞,常会不同程度地损伤正常组织/器官有关。抗肿瘤药物常多药联用,这也增加了ADR的发生率。
抗菌药物的ADR报告率位列第二,其中排名前三的抗菌药物分别为左氧氟沙星注射液、头孢吡肟注射液和利奈唑胺注射液。左氧氟沙星为第三代喹诺酮类抗菌药物,其抗菌谱广、半衰期长、价格低廉,临床应用广泛,常见ADR有神经毒性和肌骨骼损伤等。本研究发现,左氧氟沙星注射液的主要ADR为消化系统和神经系统损害,提示应加强抗菌药物的合理用药意识,严格按照药品说明书上的适应证和用法用量规范用药,同时密切关注药品输注过程中患者的临床表现,对ADR做到早发现、早预防。头孢菌素类抗生素具有抗菌谱广、适应人群广的特点,是目前临床抗感染治疗的首选药物,但其过敏反应发生率较高,临床使用时应严格遵循有关诊疗规范。本研究还发现,利奈唑胺所致ADR累及血液系统的比例最高,患者临床表现有血小板减少、白细胞减少等,且主要发生于用药后的14 d内,提示在利奈唑胺用药初期应监测相关指标。
3.4 ADR累及的系统/器官及主要临床表现
本研究中,ADR累及的系统/器官以消化系统和皮肤及皮肤附件损害为主,主要临床表现为恶心/呕吐、腹痛、腹胀、红肿、皮疹、瘙痒等。由于这些症状容易捕捉,临床上较易作出判断,故上报率较高。对于无症状或需通过实验室检查发现的ADR,建议加强用药过程中的药学监护,做到早发现、早处理。
3.5 抗肿瘤药物严重ADR累及的系统/器官及应对策略
在本研究中,抗肿瘤药物的ADR报告率最高,严重ADR例数也最多,涉及到的抗肿瘤药物主要是靶向抗肿瘤药物PD-1/PD-L1抑制剂,其次为络铂类药物。有研究显示,PD-1/PD-L1抑制剂单药治疗的肝脏ADR发生率约为5%,严重心肌炎发生率约为0.09%,3 ~ 4级肝损伤发生率约为1% ~ 2%,ADR发生时间多为首次用药后的8 ~ 12周内[4]。根据美国肿瘤免疫治疗学会发布的免疫检查点抑制剂相关不良事件管理指南[5],对于大部分1 ~ 2级ADR,先暂停用药物治疗,待实验室检查指标好转后再恢复用药;对于≥3级ADR,酌情永久停用该药物治疗。
络铂类药物的严重ADR主要表现为消化系统、血液系统和神经系统损害。有研究显示,第一代络铂类药物顺铂的胃肠道和肾毒性明显,第二代络铂类药物卡铂的骨髓抑制毒性较强,而第三代络铂类药物奥沙利铂治疗的神经系统毒性发生率较高[6]。因此,在使用络铂类药物治疗时,应采取相应的ADR防治措施,如对于重度恶心/呕吐等消化系统毒性,常联合使用5-羟色胺受体拮抗剂和地塞米松进行防治;对于肾毒性,一般通过增加水分摄入或输液量,促进药物排泄来予以控制;对于血液毒性,可选用粒细胞集落刺激因子或粒细胞巨噬细胞集落刺激因子来纠正白细胞和血小板计数;对于神经系统毒性,可给予维生素B1和维生素C等,以改善中毒症状。
在临床实践中,收集、上报、分析和评价ADR信息不但能够帮助医护人员尽早发现药物警戒信号,而且也是保障用药安全的重要措施。特别是对于联合化疗、经静脉途径给药和≥65岁的患者,用药过程中更须密切监测相应的实验室检查指标,观察是否出现了可疑的ADR信号,并制定ADR应急处理规程;对于可能造成严重损害的ADR,应建立有效的预警机制,最大程度地提高药品使用的安全性。
参考文献
[1] 中华人民共和国卫生部. 《药品不良反应报告和监测管理办法》(卫生部令第81号)[EB/OL]. (2011-05-04) [2022-01-13]. https://www.nmpa.gov.cn/xxgk/fgwj/ bmgzh/20110504162501325.html.
[2] WHO药品不良反应术语集[J]. 中国药物警戒, 2007, 4(4): 250-256.
[3] Machado-Alba JE, Londo?o-Builes MJ, Echeverri-Cata?o LF, et al. Adverse drug reactions in Colombian patients, 2007-2013: analysis of population databases [J]. Biomedica, 2016, 36(1): 59-66.
[4] Naidoo J, Page DB, Li BT, et al. Toxicities of the anti-PD-1 and anti-PD-L1 immune checkpoint antibodies [J]. Ann Oncol, 2015, 26(12): 2375-2391.
[5] Brahmer JR, Abu-Sbeih H, Ascierto PA, et al. Society for Immunotherapy of Cancer (SITC) clinical practice guideline on immune checkpoint inhibitor-related adverse events [J]. J Immunother Cancer, 2021, 9(6): e002435.
[6] 金星, 吳文清, 伍延婷. 127例铂类抗癌药物不良反应报告回顾性分析[J]. 安徽医药, 2017, 21(5): 957-959.

