白蛋白结合型紫杉醇治疗乳腺癌患者安全性的系统评价
庞雨时 陈灿 王春晖 李倩雯 周荪惠 吕迁洲 李晓宇
摘 要 目的:系统评价白蛋白结合型紫杉醇治疗乳腺癌患者的安全性,为临床合理用药提供参考。方法:通过计算机检索PubMed、Embase、Scopus、Web of Science和Cochrane Library中有关白蛋白结合型紫杉醇治疗乳腺癌的随机对照试验报告。结果:共纳入12项随机对照试验,涉及4 227例患者。荟萃分析结果显示,与其他紫杉烷类药物组相比,白蛋白结合型紫杉醇组的总的、严重的和≥3级不良事件的发生率均没有显著差异。但在常见不良事件方面,白蛋白结合型紫杉醇组的神经病变发生率显著高于其他紫杉烷类药物组。亚组分析还显示,白蛋白结合型紫杉醇组的神经病变、中性粒细胞减少、贫血和疲劳的发生率均显著高于其他紫杉醇制剂组。结论:白蛋白结合型紫杉醇在治疗乳腺癌患者时并未表现出有更好的安全性,临床使用时应注意其治疗引起的神经和血液系统不良事件。
关键词 乳腺癌 白蛋白结合型紫杉醇 安全性 系统评价
中图分类号:R979.19; R737.9 文献标志码:A 文章编号:1006-1533(2022)05-0011-13
引用本文 庞雨时, 陈灿, 王春晖, 等. 白蛋白结合型紫杉醇治疗乳腺癌患者安全性的系统评价[J]. 上海医药, 2022, 43(5): 11-23. Safety of nanoparticle albumin-bound paclitaxel in breast cancer patients:
a systematic review
PANG Yushi1, 2, CHEN Can1, WANG Chunhui1, LI Qianwen1, 2, ZHOU Sunhui1, 2, LYU Qianzhou1, LI Xiaoyu1
(1. Department of Pharmacy, Zhongshan Hospital, Fudan University, Shanghai 200032, China; 2. School of Pharmacy, Fudan University, Shanghai 200032, China)
ABSTRACT Objective: To evaluate the safety of nanoparticle albumin-bound paclitaxel (nab-paclitaxel) in breast cancer patients and provide reference for clinical rational drug use. Methods: Reports of a randomized controlled trial (RCT) of nab-paclitaxel in the treatment of breast cancer were collected by searching PubMed, Embase, Scopus, Web of Science and Cochrane Library. Results: Twelve RCTs containing a total of 4 227 patients were included. The meta-analysis results showed that there were no significant differences in the incidence of total, serious and grade ≥3 adverse events in the nab-paclitaxel group compared with the other taxane groups. However, in terms of common adverse events, the incidence of nab-paclitaxel neuropathy was significantly higher than that of other taxanes. Subgroup analyses also showed a significant increase of the incidence of neuropathy, neutropenia, anemia, and fatigue in the nab-paclitaxel group compared with paclitaxel. Conclusion: The use of nabpaclitaxel in breast cancer patients does not show better safety and attention should be paid to the neurological and hematological adverse events caused by its use in clinic.
KEy WORDS breast cancer; nanoparticle albumin-bound paclitaxel; safety; systematic review
乳腺癌是女性最常見的肿瘤类型之一。根据WHO的统计[1],到2021年,乳腺癌将超过肺癌而成为全球女性最常见的肿瘤类型。2020年,全球新发乳腺癌病例数达230万人,占所有新发肿瘤病例数的11.7%,因乳腺癌而死亡的病例数为68.5万人。
紫杉烷类药物属于细胞毒类抗肿瘤药物,是乳腺癌标准治疗方案中非常重要的一个组分。紫杉烷类药物作用于微管蛋白,通过影响微管的功能来抑制肿瘤生长[2]。紫杉醇在水中的溶解度很小,溶剂型紫杉醇是使用聚氧乙烯蓖麻油和无水乙醇制备的,这也是导致紫杉醇注射治疗的超敏反应发生率高的主要原因[3]。多西他赛是紫杉醇的半合成衍生物,水中溶解度较紫杉醇高。白蛋白结合型紫杉醇以纳米微粒白蛋白为载体,给药后可通过血管内皮细胞膜上的白蛋白受体Gp60介导的胞吞作用和对肿瘤细胞分泌的富含半胱氨酸的酸性分泌蛋白的高亲和性而提高紫杉醇在肿瘤局部的浓度[4],进而增强抗肿瘤作用。白蛋白结合型紫杉醇能直接以生理盐水为溶媒,其没有溶剂型紫杉醇治疗的高超敏反应发生率问题,临床使用时无需使用糖皮质激素或抗组胺药物对患者进行抗过敏预处理[5]。
紫杉烷类药物治疗的不良事件涉及机体多种系统,尤以血液、神经系统和皮肤软组织病变居多。有研究显示,紫杉烷类药物治疗的发生率>20%的不良事件有白细胞减少、中性粒细胞减少、感觉神经病变、脱发、肝功能异常、乏力、恶心、呕吐、贫血、皮疹、肌痛/关节痛等[6]。本研究通过系统检索相关文献,评估白蛋白结合型紫杉醇与其他紫杉烷类药物对照治疗乳腺癌患者的不良事件发生情况,为临床合理用药提供循证医学依据。
1.1 纳入与排除标准
1.1.1 研究类型
公开发表的随机对照试验(randomized controlled trial, RCT)报告,语种不限。
1.1.2 研究对象
年龄>18岁、有组织学或细胞学证据的乳腺癌患者。
1.1.3 干预措施
干预组患者的药物治疗方案中包含白蛋白结合型紫杉醇,对照組患者的药物治疗方案中包含其他紫杉烷类药物(溶剂型紫杉醇、紫杉醇脂质体或多西他赛)。
1.1.4 结局指标
总不良事件、严重不良事件、≥3级不良事件和各种常见不良事件的发生率。
1.1.5 排除标准
①动物试验报告;②观察性研究报告;③非对照研究报告;④无法提取数据或无相关结局指标的文献;⑤重复的文献;⑥综述和系统评价文献。
1.2 文献检索策略
通过计算机检索PubMed、Embase、Scopus、Web of Science和Cochrane Library,检索时段为建库起至2021年7月5日。检索主题词为“albumin-bound paclitaxel”和“breast neoplasms”,自由词为“nab-paclitaxel”“ABI-007”“Abraxane”“albumin-bound paclitaxel”“breast neoplasms”“breast tumor”“breast cancer”“breast carcinoma”“mammary cancer”“mammary carcinoma”和“mammary neoplasms”。检索字段间使用布尔逻辑运算符连接。
1.3 文献筛选与数据提取
由两名研究者独立完成文献筛选与数据提取。如存在分歧,通过讨论协商解决或寻求第三方裁决。提取的数据包括:①纳入文献的基本信息(第一作者、研究国家、发表年份等);②偏倚风险评估的关键指标;③研究的干预措施、患者年龄、结局指标评价标准和结果数据。
1.4 偏倚风险评估
采用《Cochrane干预措施系统评价手册》中的偏倚风险评估工具进行偏倚风险评估,评估内容包括随机序列生成、分配隐藏、患者/研究者盲法、结局评估者盲法、数据结果完整性、选择性报告和其他偏倚来源7个方面。
1.5 荟萃分析和统计学方法
采用Review Manager 5.4软件中的随机效应模型进行荟萃分析。计数资料采用相对危险度(relative risk, RR)和95%置信区间(confidence interval, CI)来表示。采用χ2和I2检验对纳入研究进行异质性分析,P≤0.10或I2>50%被认为具有显著异质性。对于存在显著异质性的研究,通过敏感性分析来探讨异质性来源。此外,根据对照组的不同(溶剂型紫杉醇和多西他赛)进行亚组分析,P<0.05表示差异具有统计学意义。
2.1 文献检索和筛选结果
共检索获得32 373篇相关文献,去除重复文献后剩余4 628篇文献。通过标题和摘要筛选,有46篇文献进入全文筛选阶段,最终纳入本研究的为12篇文献(图1)。

2.2 纳入文献的特征
本研究共纳入12 项RCTs[7-18],其中9项研究的对照药物为其他紫杉醇制剂,3项研究的对照药物为多西他赛。所有研究的结局指标评价标准均为美国国家癌症研究所等制定的不良事件通用术语标准(Common Terminology Criteria for Adverse Events, CTCAE)3.0或4.0版。12项研究合计包括4 227例乳腺癌患者(干预组2 179例,对照组2 048例),均为女性,平均年龄50 ~ 60岁(表1)。
2.3 纳入研究的偏倚风险评估
在纳入的12项研究中,有5项研究提到了随机序列的产生方法。此外,除1项研究未提及是否实施了分配隐藏和盲法外,其余11项研究均为开放性研究。所有研究均报告了预先规定的全部结局指标,在数据结果完整性和选择性报告上为低偏倚风险(图2)。
2.4 荟萃分析结果
2.4.1 总、严重和≥3级不良事件发生率
分别有5项研究[7, 9, 11, 14, 16(]合计包括1 341例患者)、6项研究[7-9, 12, 16-17](合计包括2 380例患者)和9项研究[7-11, 13-16](合计包括2 541例患者)分别报告了总、严重和≥3级不良事件的发生率。白蛋白结合型紫杉醇组和对照组患者的总不良事件发生率分别为97.6%(653/669)和97.3%(654/672),差异无统计学意义(图3,RR=1.00, 95% CI: 0.99 ~ 1.01, P=0.90, I2=0%)。白蛋白结合型紫杉醇组和对照组患者的严重不良事件发生率[分别为21.0%(247/1 176)和22.3%(268/1 204)]相当(图4,RR=1.00, 95% CI: 0.68 ~ 1.46, P=0.98, I2=75%),≥3级不良事件发生率[分别为63.5%(813/1 281)和58.4%(736/1 260)]也类似(图5,RR=1.04, 95% CI: 0.90 ~ 1.21, P=0.58, I2=89%)。




2.4.2 常见不良事件发生率
分别有9项研究[8-9, 11-14, 16-18](合计包括3 176例患者)、9项研究[7-9, 11-13, 16-18](合计包括3 041例患者)和6项研究[7, 11-12, 14, 16-17](合计包括2 055例患者)分别报告了白细胞减少、中性粒细胞减少和贫血的发生率。荟萃分析结果显示,白蛋白结合型紫杉醇组与对照组患者的白细胞减少发生率分别为61.6%(1 015/1 648)和66.4%(1 015/1 528),差异无统计学意义(图6,RR=0.89, 95% CI: 0.78 ~ 1.02, P=0.08, I2=92%);中性粒细胞减少发生率分别为72.6%(1 147/1 580)和65.0%(949/ 1 461),差异也无统计学意义(图7,RR=1.06, 95% CI: 0.95 ~ 1.17, P=0.29, I2=86%);贫血发生率分别为72.8%(724/995)和64.5%(684/1 060),差異亦无统计学意义(图 8,RR=1.09, 95% CI: 0.99 ~ 1.20, P=0.08, I2=20%)。
神经病变是紫杉烷类药物治疗的特征性不良事件。在本研究纳入的12项研究中,有10项研究[7-9, 11-14, 16-18](合计包括3 238例患者)报告了神经病变的发生率。荟萃分析结果显示,白蛋白结合型紫杉醇组和对照组患者的神经病变发生率分别为73.8%(1 239/1 678)和62.1%(968/1 560),差异具有统计学意义(图9,RR=1.17, 95% CI: 1.09 ~ 1.25, P<0.000 1, I2=37%)。

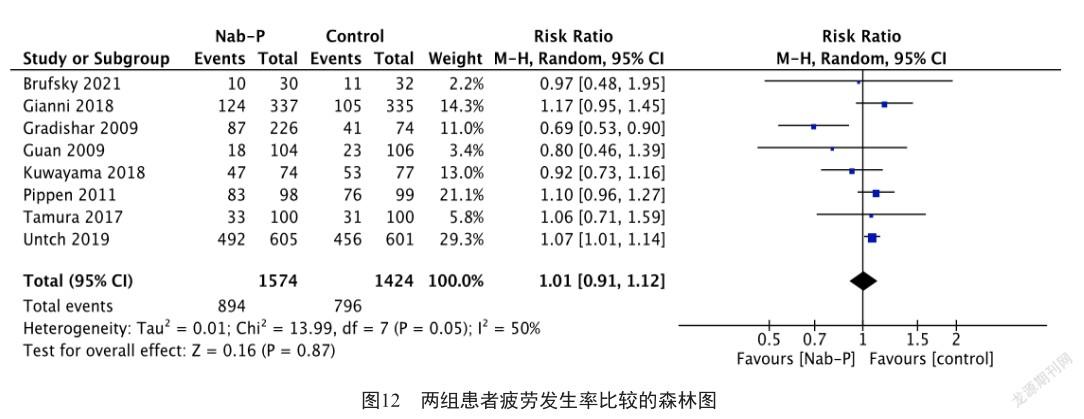
此外,分别有6项研究[8, 11, 13, 16-18](合计包括2 127例患者)、9项研究[7-8, 11-14, 16-18](合计包括2 566例患者)和8项研究[7, 9, 11, 13-14, 16-18](合计包括2 998例患者)分别报告了关节痛、脱发和疲劳的发生率。荟萃分析结果显示,白蛋白结合型紫杉醇组和对照组患者的关节痛发生率分别为33.4%(386/1 155)和33.1%(322/972),差异无统计学意义(图10,RR=1.06, 95% CI: 0.94 ~ 1.20, P=0.32, I2=0%);脱发发生率分别为77.9%(1 045/1 341)和80.1%(981/1 225),差异也无统计学意义(图11,RR=0.96, 95% CI: 0.89 ~ 1.05, P=0.39, I2=64%);疲劳发生率分别为56.8%(894/1 574)和55.9%(796/1 424),差异亦无统计学意义(图12,RR=1.01, 95% CI: 0.91 ~ 1.12, P=0.87, I2=50%)。
2.5 敏感性分析和亚组分析


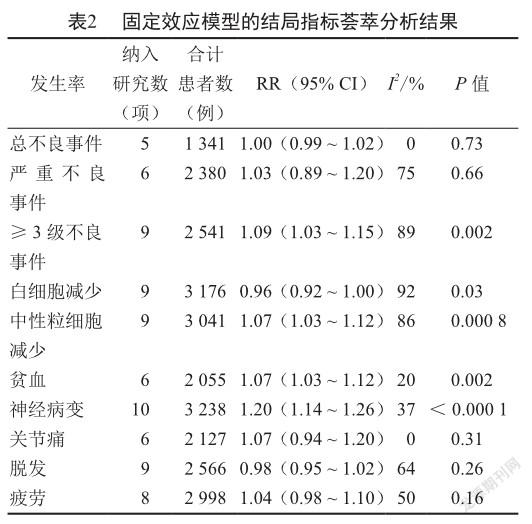
采用固定效应模型对本研究的各种结局指标进行定量合成,结果显示≥3级不良事件、白细胞减少、中性粒细胞减少和贫血发生率4个结局指标的荟萃分析结果发生了显著变化:与对照组患者相比,白蛋白结合型紫杉醇组患者的≥3级不良事件发生率(RR=1.09, 95% CI: 1.03 ~ 1.15, P=0.002, I2=89%)、中性粒细胞减少发生率(RR=1.07, 95% CI: 1.03 ~ 1.12, P=0.000 8, I2=86%)和贫血发生率(RR=1.07, 95% CI: 1.03 ~ 1.12, P=0.002, I2=20%)均显著增高,而白细胞减少发生率(RR=0.96, 95% CI: 0.92 ~ 1.00, P=0.03, I2=92%)则显著降低(表2)。
对于I2≥50%研究的结局指标,采用逐一剔除各项研究的方法来进行敏感性分析,结果发现大多数结局指标的荟萃分析结果未发生显著变化。但在剔除“Gradishar 2009”研究时,发现白蛋白结合型紫杉醇组患者的疲劳发生率高于对照组,且差异有统计学意义(RR=1.07, 95% CI: 1.02 ~ 1.13, P=0.008, I2=0%)。此外,对白细胞减少和脱发发生率2个结局指标的分析结果也显示,剔除“Gradishar 2009”研究时,I2的变化较大,然对效应值的影响还无统计学意义。这些分析结果表明,“Gradishar 2009”研究是最主要的异质性来源,但其对大多数结局指标的荟萃分析结果没有显著影响。
按对照组干预措施对纳入研究进行分类,再分为溶剂型紫杉醇组和多西他赛组进行亚组分析。结果显示,与溶剂型紫杉醇组相比,白蛋白结合型紫杉醇组患者的中性粒细胞减少发生率(RR=1.10, 95% CI: 1.04 ~ 1.16, P=0.000 5, I2=0%)、贫血发生率(RR=1.05, 95% CI: 1.01 ~ 1.10, P=0.02, I2=0%)和疲劳发生率(RR=1.08, 95% CI: 1.02 ~ 1.15, P=0.009, I2=0%)均显著增高。白蛋白结合型紫杉醇组患者的神经病变发生率也显著高于溶剂型紫杉醇组(RR=1.14, 95% CI: 1.04 ~ 1.26, P=0.006, I2=53%)和多西他赛组(RR=1.13, 95% CI: 1.00 ~ 1.26, P=0.04, I2=0%)。对于白细胞减少、关节痛和脱发发生率,亚组分析结果与合并分析结果一致(表3)。
本研究结果显示,白蛋白结合型紫杉醇治疗乳腺癌患者的安全性并不优于其他紫杉烷类药物,且神经病变和贫血的发生率更高。一项旨在比较白蛋白结合型紫杉醇与溶剂型紫杉醇疗效与安全性的系统评价也发现,白蛋白结合型紫杉醇治疗的神经病变事件更常见[19]。另一项对5项RCTs的荟萃分析则显示,与其他紫杉烷类药物相比,白蛋白结合型紫杉醇治疗患者的神经病变、皮疹、中性粒细胞减少和疲劳发生率更高,但在严重不良事件方面,只有神经病变发生率显著更高[20]。本研究结果与上述研究结果一致。
本研究還通过亚组分析比较了白蛋白结合型紫杉醇与溶剂型紫杉醇和多西他赛治疗的不良事件发生率,结果显示与溶剂型紫杉醇相比,白蛋白结合型紫杉醇治疗患者的神经病变、中性粒细胞减少和疲劳发生率更高,其中神经病变发生率也显著高于多西他赛治疗患者。一项对白蛋白结合型紫杉醇治疗实体瘤患者安全性的系统评价还发现,与溶剂型紫杉醇相比,白蛋白结合型紫杉醇治疗患者更易发生血液系统不良事件[21]。但该研究亦显示,与多西他赛相比,白蛋白结合型紫杉醇治疗患者的疲劳和脱发发生率更低。此与本研究结果不同,原因可能是该研究包含了广泛实体瘤患者,而不同癌种的不同治疗方案是会影响安全性评价结果的。
周围神经病变是紫杉烷类药物治疗的常见不良事件,患者表现为感觉、运动和自主神经功能异常[22],以手、足感觉异常多见,如感觉迟钝、麻木或触电样感觉等[23],其中急性症状可在治疗1个周期后发生,慢性病变则能持续数月甚至数年[24]。紫杉烷类药物治疗的周围神经病变的发病机制现尚未完全明确,但有相关病理生理学研究认为,这是由此类药物引起的微管功能障碍、神经元线粒体损伤和氧化应激等导致的[25]。紫杉烷类药物治疗引起的周围神经病变一般会在停药或减量后有所减轻,由于目前尚无特效药,专家共识[26]推荐可使用营养神经的药物(如维生素B类药物、烟酰胺、叶酸等)来改善患者的感觉异常症状。

本研究纳入了较近期的相关文献,故其结果能为临床合理用药提供更新的循证医学依据。但本研究也存在一定的局限性:一是对于纳入研究中的合并用药因素的分析不足。患者的肿瘤分期、分型和基础情况不同,肿瘤治疗方案也可能不同。本研究未按不同治疗方案进行亚组分析,无法完全排除联合用药导致不良事件的可能。二是未对白蛋白结合型紫杉醇组和对照组进行累积剂量分层分析。有研究[27]显示,紫杉烷类药物治疗的神经毒性与其累积剂量有关。因此,紫杉烷类药物治疗的剂量、频率和周期都可能影响安全性评价结果。
本研究结果显示,白蛋白结合型紫杉醇治疗的安全性并不优于其他紫杉烷类药物,且神经病变和贫血的发生率更高。所以,临床使用白蛋白结合型紫杉醇时,不仅应注意其治疗的神经毒性,也应密切监测患者血常规检查指标值的变化。
参考文献
[1] Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]. CA Cancer J Clin, 2021, 71(3): 209-249.
[2] Weaver BA. How Taxol/paclitaxel kills cancer cells [J]. Mol Biol Cell, 2014, 25(18): 2677-2681.
[3] Gelderblom H, Verweij J, Nooter K, et al. Cremophor EL: the drawbacks and advantages of vehicle selection for drug formulation [J]. Eur J Cancer, 2001, 37(13): 1590-1598.
[4] Desai N, Trieu V, Yao Z, et al. Increased antitumor activity, intratumor paclitaxel concentrations, and endothelial cell transport of cremophor-free, albumin-bound paclitaxel, ABI-007, compared with cremophor-based paclitaxel [J]. Clin Cancer Res, 2006, 12(4): 1317-1324.
[5] U.S. Food and Drug Administration. Abraxane? for injectable suspension (paclitaxel protein-bound particles for injectable suspension) (albumin-bound), for intravenous use [EB/OL].[2022-01-13]. https://www.accessdata.fda.gov/drugsatfda_ docs/label/2020/021660s047lbl.pdf.
[6] 邊莉, 耿翠芝, 欧阳取长, 等. 注射用白蛋白结合型紫杉醇与原研药Abraxane用于转移性乳腺癌的生物等效性和延长用药疗效分析[J]. 中华医学杂志, 2018, 98(16): 1236-1241.
[7] Brufsky A, Kim SB, Zvirbule ?, et al. A phase Ⅱ randomized trial of cobimetinib plus chemotherapy, with or without atezolizumab, as first-line treatment for patients with locally advanced or metastatic triple-negative breast cancer(COLET): primary analysis [J]. Ann Oncol, 2021, 32(5): 652-660.
[8] Ciruelos E, Apellániz-Ruiz M, Cantos B, et al. A pilot, phaseⅡ, randomized, open-label clinical trial comparing the neurotoxicity of three dose regimens of nab-paclitaxel to that of solvent-based paclitaxel as the first-line treatment for patients with human epidermal growth factor receptor type 2-negative metastatic breast cancer [J]. Oncologist, 2019, 24(11): e1024-e1033.
[9] Gianni L, Mansutti M, Anton A, et al. Comparing neoadjuvant nab-paclitaxel vs paclitaxel both followed by anthracycline regimens in women with ERBB2/HER2-negative breast cancer—the Evaluating Treatment with Neoadjuvant Abraxane (ETNA) trial: a randomized phase 3 clinical trial[J]. JAMA Oncol, 2018, 4(3): 302-308.
[10] Gradishar WJ, Tjulandin S, Davidson N, et al. Phase Ⅲ trial of nanoparticle albumin-bound paclitaxel compared with polyethylated castor oil-based paclitaxel in women with breast cancer [J]. J Clin Oncol, 2005, 23(31): 7794-7803.
[11] Guan ZZ, Li QL, Feng F, et al. Superior efficacy of a cremophor-free albumin-bound paclitaxel compared with solvent-based paclitaxel in Chinese patients with metastatic breast cancer [J]. Asia Pac J Clin Oncol, 2009, 5(3): 165-174.
[12] Jain MM, Gupte SU, Patil SG, et al. Paclitaxel injection concentrate for nanodispersion versus nab-paclitaxel in women with metastatic breast cancer: a multicenter, randomized, comparative phaseⅡ/Ⅲ study [J]. Breast Cancer Res Treat, 2016, 156(1): 125-134.
[13] Kuwayama T, Nakamura S, Hayashi N, et al. Randomized multicenter phase Ⅱ trial of neoadjuvant therapy comparing weekly nab-paclitaxel followed by FEC with docetaxel followed by FEC in HER2- early-stage breast cancer [J]. Clin Breast Cancer, 2018, 18(6): 474-480.
[14] Pippen J, Paul D, Vukelja S, et al. Dose-dense doxorubicin and cyclophosphamide followed by dose-dense albuminbound paclitaxel plus bevacizumab is safe as adjuvant therapy in patients with early stage breast cancer [J]. Breast Cancer Res Treat, 2011, 130(3): 825-831.
[15] Rugo HS, Barry WT, Moreno-Aspitia A, et al. Randomized phaseⅢ trial of paclitaxel once per week compared with nanoparticle albumin-bound nab-paclitaxel once per week or ixabepilone with bevacizumab as first-line chemotherapy for locally recurrent or metastatic breast cancer: CALGB 40502/ NCCTG N063H (alliance) [J]. J Clin Oncol, 2015, 33(21): 2361-2369.
[16] Tamura K, Inoue K, Masuda N, et al. Randomized phase Ⅱstudy of nab-paclitaxel as first-line chemotherapy in patients with HER2-negative metastatic breast cancer [J]. Cancer Sci, 2017, 108(5): 987-994.
[17] Untch M, Jackisch C, Schneeweiss A, et al. NAB-paclitaxel improves disease-free survival in early breast cancer: GBG 69-GeparSepto [J]. J Clin Oncol, 2019, 37(25): 2226-2234.
[18] Gradishar WJ, Krasnojon D, Cheporov S, et al. Significantly longer progression-free survival with nab-paclitaxel compared with docetaxel as first-line therapy for metastatic breast cancer [J]. J Clin Oncol, 2009, 27(22): 3611-3619.
[19] Lee H, Park S, Kang JE, et al. Efficacy and safety of nanoparticle-albumin-bound paclitaxel compared with solvent-based taxanes for metastatic breast cancer: a metaanalysis [J]. Sci Rep, 2020, 10(1): 530.
[20] Li Y, Lu X, Lin Q, et al. Is nab-paclitaxel better than conventional taxanes as neoadjuvant therapy for breast cancer? A meta-analysis [J]. J Int Med Res, 2020, 48(8): 300060520943473.
[21] He F, Liu J, Shen X, et al. Adverse event profile for nanoparticle albumin-bound paclitaxel compared with solvent-based taxanes in solid-organ tumors: a systematic review and meta-analysis of randomized clinical trials [J]. Ann Pharmacother, 2021: 10600280211058385.
[22] De Iuliis F, Taglieri L, Salerno G, et al. Taxane induced neuropathy in patients affected by breast cancer: literature review [J]. Crit Rev Oncol Hematol, 2015, 96(1): 34-45.
[23] Flatters SJL, Dougherty PM, Colvin LA. Clinical and preclinical perspectives on chemotherapy-induced peripheral neuropathy (CIPN): a narrative review [J]. Br J Anaesth, 2017, 119(4): 737-749.
[24] Velasco R, Bruna J. Taxane-induced peripheral neurotoxicity[J]. Toxics, 2015, 3(2): 152-169.
[25] Staff NP, Fehrenbacher JC, Caillaud M, et al. Pathogenesis of paclitaxel-induced peripheral neuropathy: a current review of in vitro and in vivo findings using rodent and human model systems [J]. Exp Neurol, 2020, 324: 113121.
[26] 紫杉類药物相关周围神经病变规范化管理专家共识专家委员会. 紫杉类药物相关周围神经病变规范化管理专家共识[J]. 中国医学前沿杂志(电子版), 2020, 12(3): 41-51.
[27] Marupudi NI, Han JE, Li KW, et al. Paclitaxel: a review of adverse toxicities and novel delivery strategies [J]. Expert Opin Drug Saf, 2007, 6(5): 609-621.

