外周血中胸腺活化调节趋化因子17与老年慢性阻塞性肺疾病病人肺功能快速下降的相关性
王永胜 李东旭 孟宪伟 王培培 赵瑞雪
COPD在我国中老年人中发病率高达13.7%[1], 即使经过正规治疗,每年肺功能亦有不同程度降低[2]。COPD病人肺功能减退速度不一,老年人基础情况差,伴发疾病多,肺功能快速下降者具有更高的感染率、急性加重次数及入院风险[3-4]。挖掘老年COPD病人肺功能快速下降相关因素对采取个体化干预方案具有重要的意义。当前尚未有公认的与COPD病人肺功能快速下降相关的生物标志物[5-6],炎性指标虽对诊断COPD急性加重有着良好效能,但其与肺功能远期变化的报道尚不多见[7]。胸腺活化调节趋化因子17(thymus and activation-regulated chemokine/CC chemokine ligand 17,CCL17)作为一类炎症介质,与哮喘、过敏性鼻炎等多种气道炎症的进展和预后相关[5]。本研究旨在发掘老年COPD病人肺功能快速下降相关因素,验证CCL17水平与后者之间的相关性,现报道如下。
1 材料和方法
1.1 纳入与排除标准 纳入标准:符合中华医学会全科医学分会慢性阻塞性肺疾病基层诊疗指南中COPD诊断标准[1],处于稳定期,年龄≥60岁的病人。排除标准:随访期间接受肺部手术治疗;恶性肿瘤、严重肝肾功能异常,合并其他肺部感染、支气管哮喘、支气管扩张、肺结核等;肺功能检查不配合;伴有变应性鼻炎、类风湿关节炎、自身免疫性疾病等可能影响血清CCL17水平的疾病。剔除标准:剔除失访及转院脱落病例。
1.2 临床材料 本研究已由医院伦理学委员会批准。纳入2018年8月至2019年12月收治于我院的203例COPD稳定期病人作为研究对象,其中男180例,女23例;年龄60~85岁,平均(67.09±5.63)岁;慢性阻塞性肺疾病全球倡议(GOLD)分级Ⅰ、Ⅱ、Ⅲ级分别有25、90、88例;综合评估:A组4例、B组19例、C组121例、D组59例。记录全体研究对象随访1年内FEV1下降量(增加计为正数,减少计为负数)及四分位数,将全体研究对象的FEV1下降量值的第1百分位数至第25百分位数所对应的病人纳入快速下降组,其余纳入对照组。
1.3 方法
1.3.1 研究方案:所有研究对象接受正规治疗,收集病人血清炎性因子、CCL17水平及肺功能等基线资料。病人随访截止2020年12月21日,均随访1年,若无特殊每2~3个月门诊复查1次,记录随访期间急性加重次数。根据有无肺功能快速下降将病人分为快速下降组和对照组,对比2组基线资料,计算随访1年后与入组时FEV1的差值(ΔFEV1)。通过单因素及多因素Logistic回归分析肺功能快速下降的相关因素,以及血清CCL17水平与ΔFEV1之间的相关性。
1.3.2 肺功能检测及质控:所有病人肺功能检查于缓解期进行,由2名经过培训的医师操作。保持检测环境干净、温度适宜,检测前病人先休息15 min,检测时病人可站立或端坐。医师向病人演示操作步骤,确保病人正确使用仪器并呼气超过3 s,呼气过程中无咳嗽中断。FEV1下降量:记录入组时和随访1年时的FEV1值,取两者之差计作为ΔFEV1。
1.3.3 GOLD分级:入组时根据吸入支气管舒张剂后测得的FEV1占预计值百分比(FEV1%pred)对肺功能进行分级。GOLD1:FEV1%pred≥80%;GOLD2:50%≤FEV1%pred<80%;GOLD3:30%≤FEV1%pred<50%;GOLD4:FEV1%pred<30%。
1.4 观察指标 入组时采病人2 mL静脉血,自然凝固后离心10 min(转速2000 r/min),取上清液置于-80 ℃冰箱中。试剂盒采用上海蓝基生物科技有限公司产人CCL17双抗体夹心ELISA试剂盒。采用日立Hitachi7600全自动生化分析仪测定FPG;采用美国Beckman流式细胞仪(双抗体夹心酶联免疫吸附试验)检测血清TNF-α、IL-6、IL-8水平,试剂盒购自上海酶联生物科技有限公司;采用Beckman全自动生化分析仪,通过散射比浊法测定CRP水平,试剂盒购自深圳国赛生物科技有限公司,通过ELISA法测定血清淀粉样蛋白A(SAA)水平,试剂盒购自美国R&D公司;另取血样3 mL,不抗凝分离血清,取上清液-20 ℃保存,采用电化学发光法及配套试剂盒测定降钙素原(PCT)水平。
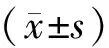
2 结果
2.1 一般资料比较 随访期间有3例失访、2例转院、1例死亡被排除,共纳入有效病例197例(快速下降组50例,对照组147例)。快速下降组急性加重次数高于对照组,BMI低于对照组(均P<0.01),2组吸烟状态比例构成差异有统计学意义(P<0.05);2组其余资料比较差异无统计学意义(P>0.05)。见表1。

表1 2组病人一般资料比较
2.2 实验室检查结果比较 快速下降组SAA、CCL17、FPG均高于对照组(P<0.05);2组其余资料比较差异无统计学意义(P>0.05)。见表2。
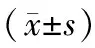
表2 2组病人实验室检查结果比较
2.3 CCL17与ΔFEV1的相关性 Pearson相关分析显示,CCL17水平与ΔFEV1呈正相关(r=0.525,P<0.001)。
2.4 COPD病人肺功能快速下降相关因素的多因素分析 SAA(OR=1.108,P<0.001)、CCL17(OR=1.024,P=0.000)和吸烟(OR=11.424,P=0.001)为病人肺功能快速下降独立危险因素,BMI(OR=0.639,P=0.002)为独立保护因素。
2.5 CCL17预测病人肺功能快速下降风险 CCL17预测老年COPD病人随访1年后发生肺功能快速下降的最佳截点为364.04 pg/mL, 此时AUC为0.876,诊断灵敏度和特异度分别为80.00%、81.60%。
3 讨论
COPD作为一种慢性炎症性肺部疾病,严重影响着病人生活质量[8]。尤其对于老年病人,肺功能的快速下降将激增不良预后风险,寻找能提供远期肺功能预测信息的指标对于老年COPD病人的个体化治疗意义非凡。有研究表明,CCL17与COPD、哮喘等多种肺部疾病病情和预后相关[9]。据此,本研究探讨老年COPD病人血清CCL17水平与肺功能快速下降的相关性。
炎症反应是COPD发病机制的核心,本研究结果显示,快速下降组急性加重次数及SAA、FPG水平均高于对照组,BMI低于对照组,2组吸烟状态比例构成差异有统计学意义;SAA和吸烟状态为病人肺功能快速下降的独立危险因素,BMI为独立保护因素。吸烟是许多肺部疾病早已公认的预后独立危险因素,也是COPD常见发病因素之一。SAA是一种受炎症刺激则升高的急性时相反应蛋白,通过核因子信号转导通路参与炎症反应,协同趋化因子网络以促进白细胞迁移。许多肺部疾病病人SAA水平较正常人显著升高,而本次研究中COPD病人SAA与肺功能相关,再次验证炎症反应支配着气道重塑发展及肺功能变化的过程。BMI体现病人营养状态,COPD属于消耗性疾病,营养不良的COPD病人在调节营养后可显著改善肺功能,减低急性呼吸道感染发生率[10]。本研究结果支持了这一观点,同时也启示临床工作者应留意COPD病人的营养指导。
白细胞介素是炎症反应的关键参与者之一,而CCL17可调节白细胞介素表达,形成多种疾病发病机制的重要环节[11]。本研究中,快速下降组CCL17水平高于对照组,CCL17与ΔFEV1呈正相关,且为肺功能快速下降的独立危险因素。辅助性T细胞2(Th2)和嗜酸性粒细胞在COPD炎症反应中的作用有关,CCL17作为Th2诱导剂,通过募集后者和促进细胞因子分泌引起嗜酸性粒细胞浸润[12]。嗜酸性粒细胞可促进气管壁组织坏死、成纤维细胞增殖、气管壁胶质沉积,在气道重塑进展中扮演重要角色。由此可见,CCL17可能在COPD炎症过程中发挥杠杆作用,其水平可反映肺部炎症程度。
本次研究也存在不足,未在随访期间对FEV1进行多次定期测量,且目前许多学者对肺功能快速下降的定义不一,本研究采用日本学者Sato等[13]的定义,但有其他学者以FEV1下降≥30 mL/年、FEV1下降≥15%作为肺功能变化的标准[14]。故因研究的分组标准不同,血清CCL17水平与肺功能快速下降之间的关系仍需更多证据证实。
综上所述,血清CCL17水平与老年COPD病人肺功能快速下降相关,未来可能成为预测COPD预后的有效手段。

