慢性炎症及端粒长度与阿尔茨海默病病人认知功能的相关性研究
刘雅玲 潘晓东 周辰 束婷婷
AD是一种以进行性认知障碍和行为损害为主要表现的中枢神经系统退行性疾病,其发生机制尚未明确,目前认为衰老机制在AD的发病过程中有重要作用。端粒学说是国际上公认的衰老学说之一。端粒长度(TL)作为一种生物学标记物容易量化,可能有助于了解AD的病因[1]。目前已有研究发现TL与认知功能相关,较短的端粒与AD发病风险增加相关[2]。此外,近年来有多项研究表明,AD病人脑内β淀粉样蛋白(amyloid-beta,Aβ蛋白)沉积伴随着明显的炎性反应,提示脑内的慢性炎症也可能参与了神经系统病理生理过程[3]。
本研究旨在分析慢性炎症、TL与认知功能的关系,并探讨不同的TL水平病人MoCA评估认知亚领域损害特点。探讨慢性炎症水平和TL在AD病人认知功能障碍发生发展过程中的作用。
1 对象与方法
1.1 研究对象 连续选取在江苏省老年病医院2014年8月至2018年12月就诊的老年人群347例,最终入组并完成全部相关检查135例,其中认知正常者(NC组)49例,男31例,女18例,年龄60~93岁;AD组86例,男48例,女38例,年龄60~102岁。纳入标准:(1)年龄>60岁;(2)完成相关的神经心理学量表评估;(3)具有初中及以上学历;(4)家庭成员平均月薪在3000元以上,本人和家属同意参与研究。排除标准:(1)最近3个月内有急性疾病发作;(2)明确诊断为路易体痴呆、额颞叶痴呆、嗜银颗粒性痴呆、血管性痴呆等;(3)有明确精神疾病病史;(4)有严重血液系统疾病史。AD的诊断符合美国国立神经疾病及交流障碍与卒中研究所-AD及相关疾病学会制订的“很可能为AD”的诊断标准(2011年)。本研究所有检查均征得病人本人或家属同意,并签署知情同意书。
1.2 研究方法
1.2.1 一般资料采集:记录病人的年龄、性别、职业、受教育年限、既往病史(高血压、糖尿病、冠心病、脑血管病等)、服药情况(是否服用他汀类、抗血小板药物、ACEI/ARB类等药物)、吸烟史、饮酒史、SBP及DBP水平。清晨空腹抽取肘静脉血,送检验科行生化指标(包括肝肾功能、FPG、LDL-C、白蛋白、hs-CRP、血Hcy)、HbA1c、凝血功能的检测。
1.2.2 认知功能评估:量表评估由我院统一培训的医师完成,对入组人群采用MoCA量表评估其认知功能。疾病诊断及认知水平由2名具有神经内科中级以上职称的医生共同诊断。
1.2.3 TL测定:清晨空腹采集外周静脉血5 mL,离心后取血细胞置于-80 ℃冰箱中保存,使用商业化试剂盒提取DNA,采用实时定量聚合酶链式反应(qRT-PCR)法测定外周血白细胞TL,具体操作按照试剂盒(上海捷瑞生物工程有限公司)说明进行。内参为36B4单拷贝基因,DNA扩增体系的总体积为10μL。端粒的反应条件为: 95 ℃预变性10 min;95 ℃变性5 s,56 ℃退火10 s,72 ℃延伸60 s,共20个循环。相对TL(T/S比值)即样本中端粒重复拷贝数(T)和单拷贝基因拷贝数(S)的比值。运用 2-△△Ct公式,其中ΔΔCt=(待测样品端粒Ct值-待测样品36B4 Ct 值)/(对照样品端粒Ct 值-对照样品36B4 Ct值),计算待测样本的相对TL[4-5]。
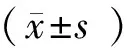
2 结果
2.1 研究资料比较 2组性别、既往病史、用药史、SBP、白蛋白、肌酐(Cr)、LDL-C、纤维蛋白原等基线资料差异无统计学意义(P>0. 05),年龄、受教育年限、DBP、HbA1c、血Hcy、hs-CRP、TL、MoCA评分差异有统计学意义(P<0.05或0.01)。见表1。
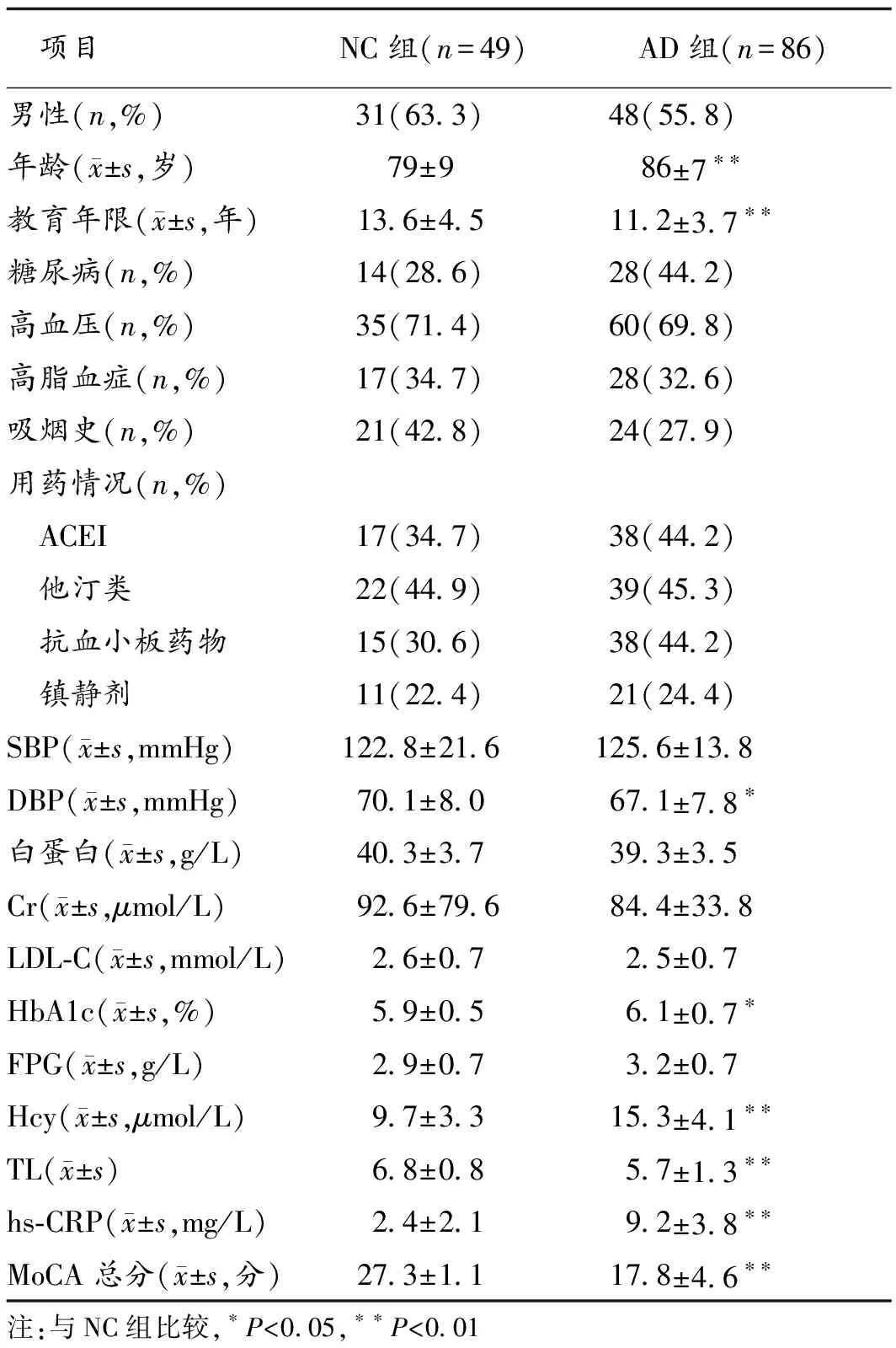
表1 2组研究资料比较
2.2 MoCA与TL、hsCRP的相关性分析 Pearson相关性分析显示MoCA评分与TL呈弱正相关(r=0.234,P<0.01),与hs-CRP呈负相关(r=-0.499,P<0.01)。
2.3 AD影响因素分析 以是否存在AD为因变量,以年龄、教育年限、DBP、TL、hs-CRP、Hcy、HbA1c为自变量,采用Logistic回归进行分析,结果显示,Hcy、hs-CRP是AD的独立危险因素,较长的端粒是认知功能的保护性因素(P<0.01)。见表2。
2.4 AD病人不同TL亚组MoCA评分、Hcy、hs-CRP水平比较 AD病人以TL三分位数进行分组,按TL第一个、第二个三分位数作为截止值,将AD组病人分为TL1组(端粒对数值2.19~5.28),TL2组(端粒对数值5.29~6.55),TL3组(端粒对数值6.56~8.02)。3组间Hcy、hs-CRP水平差异无统计学意义;而TL3组MoCA总分、视空间与执行能力、注意力与计算、抽象、延迟记忆评分高于TL1组(P<0.05),TL3组注意力与计算评分同时也高于TL2组(P<0.05)。见表3。
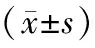
表3 不同TL亚组MoCA评分、Hcy、hs-CRP水平比较
3 讨论
AD发病机制尚未明确,已有研究认为Aβ沉积、神经元纤维缠结以及胆碱能神经元退行性病变参与发病过程。目前认为AD是一个系统性疾病,由多基因、多因素致病,衰老和炎症机制在AD发病中的作用日益受关注。
细胞衰老是复杂综合的系统疾病,端粒学说认为TL可反映衰老程度。人端粒DNA以5′-TTAGGG-3′为重复单位,其主要功能是保持基因组的稳定性。TL的变化导致基因表达的变化,包括衰老相关基因表达和衰老相关分泌表型。神经胶质细胞向衰老过渡,局部神经元群体出现继发性功能障碍[6]。有研究发现端粒缩短时神经元细胞复制能力受限,分裂急剧下降,海马体积减少,造成认知受损[7],较短的TL与AD发病风险增加相关[8];但也有研究认为TL和AD发病风险之间存在U型关联,更长和更短的TL都与AD患病风险增加有关[9]。
炎症学说认为脑内慢性低滴度炎症反应也是AD的一种重要病理损伤形式。有研究表明,外周炎症因子可造成血脑屏障(blood-brain barrier,BBB)损伤,漫长的炎症过程使BBB损伤不可逆,外周-中枢间的天然屏障破坏。外周炎症因子可通过BBB进入大脑,激活脑内主要炎症效应细胞——小胶质细胞,高表达炎性因子介导中枢神经系统慢性炎性反应,损伤神经元,促进突触变性,进而诱发或加重神经系统的退行性变[10-11]。hs-CRP是一种在肝脏合成的相对稳定的外周炎性因子,灵敏度高,炎症刺激后可迅速升高[12]。有研究发现:在AD脑组织老年斑及神经元纤维缠结中存在CRP及CRP样免疫反应[13];AD病人的外周血hs-CRP水平亦高于健康对照者[14]。
本研究显示,Hcy、hs-CRP是AD的独立危险因素,更长的端粒是AD的保护性因素,且TL与hs-CRP对AD发病风险不存在交互效应。研究结果与其他学者的研究结果一致[7,13],提示TL缩短和炎症反应共同参与了AD疾病进程。
本研究进一步探讨了AD组病人TL与hs-CRP的相关性,发现二者无明显关联(r=0.099,P>0.05)。AD组不同TL亚组hs-CRP水平差异也无统计学意义。AD病人在确诊前体内经过了一个漫长的慢性炎症阶段,伴随着炎症损伤和细胞的更替,TL可能随之波动变化,同时TL的调节也是机体内外环境和遗传因素交互作用的结果,受多重因素的影响[15-16],所以TL与炎症之间的关系可能非单纯线性,在AD不同阶段表现不一,需要更大样本量的数据进一步探讨。
AD是一个系统性疾病,细胞衰老也是复杂综合的系统模型。本研究进一步探讨了不同TL水平AD病人MoCA评估认知亚领域的差异。TL明显缩短与AD病人认知损害的联系是全方面的,各个认知域的损害都与之有关,而不仅仅局限于记忆。本研究未发现TL1组与TL2组MoCA评估认知域间差异,TL2组仅注意力与计算的评分低于TL3组(P<0.05),这与衰老过程中认知能力损害所观察到的先后顺序一致,从一个侧面反映了衰老机制在AD发生发展中的地位[17-18]。
本研究也存在一定局限性:样本量相对小,TL与炎症之间的关系尚不明确,有待进一步扩大样本量去探讨分析;由于获得活体中枢神经系统的细胞存在许多困难,本研究获取端粒的样本为外周血细胞,无法取得脑内这些定位功能区的端粒样本,以验证不同TL与不同认知域损害的相关性。
综上,慢性低度炎症是AD的可能危险因素,更长的端粒是AD的保护性因素,更短的端粒可能导致视空间与执行力、注意力、计算能力、抽象和记忆力方面认知损害更明显。

