江西铅山红芽芋TIFY 9基因克隆与功能分析
赵红 邓雨晴 曾淑琴 曾荧 张彩霞 张慧博 张丽佳 张玲 张妮 尹明华














摘要:为了深入探究江西铅山红芽芋TIFY 9基因的功能,通过江西铅山红芽芋试管苗转录组数据库筛选到江西铅山红芽芋TIFY 9基因的核心片段,利用RT-PCR 技术克隆该基因,并采用生物信息学方法、转基因瞬时表达和实时定量 PCR进行序列分析、亚细胞定位、器官表达分析和功能分析。结果表明:江西铅山红芽芋TIFY 9基因cDNA总长度为522 bp,G+C 含量为58.62%;由174个氨基酸组成,分子量19 073.87 u,等电点9.30,为亲水性蛋白;二级结构由α-螺旋(31.61%)、β-片层(12.64%)、无规则卷曲(55.75%) 构成,三级结构为单体;主要存在细胞核中;在进化上与Colocasia esculenta(芋)的亲缘关系较近,与Colocasia esculenta(芋)hypothetical protein Taro_030839(MQL98131.1)在进化上具有最高的亲缘关系。江西铅山红芽芋TIFY 9蛋白具有典型植物TIFY 9的结构特征,氨基酸序列及核酸序列与同源物种同源性高达100%,在进化上高度保守。烟草叶片亚细胞定位分析表明,TIFY 9定位于细胞质和细胞核中。实时定量PCR结果显示,TIFY 9基因在江西铅山红芽芋中的表达存在器官特异性,在江西铅山红芽芋不同组织部位均有表达,且在叶中和球茎膨大初期表达量最高。在烟草花叶病毒胁迫下,与TIFY 9非转基因烟草相比较,TIFY 9转基因烟草的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)、最大光化学效率(Fv/Fm)、实际光化学量子效率(ΦPS Ⅱ)、光化学淬灭系数(qP)及电子传递效率(ETR)显著增加,而非光化学淬灭系数(NPQ)显著下降,表明TIFY 9基因响应病毒胁迫应答可能是依赖光合作用的提高。
关键词:江西铅山红芽芋;TIFY 9基因;基因克隆;功能分析;转基因表达
中图分类号: S632.301文献标志码: A
文章编号:1002-1302(2022)05-0041-09
收稿日期:2021-04-27
基金项目:国家自然科学基金(编号:32060092、31960079);2021年度江西省教育厅科学技术研究项目(编号:GJJ211729);上饶市科技局平台载体建设项目(编号:2020I001、2019I017)。
作者简介:赵 红(1966—),女,江西上饶人,硕士,高级实验师,主要从事植物生物技术研究工作。E-mail:928807480@qq.com。
通信作者:尹明华,硕士,教授,主要从事植物生物技术研究工作。E-mail:yinminghua04@163.com。
江西铅山红芽芋(Colocasia esculenta L. Schoot var. cormosus‘Hongyayu’)属于天南星科本草植物,药食兼优,药用可宽肠胃、补脾胃、腹中痞块、消痨散结、调节免疫,食用营养丰富、清淡爽口、粉糯细腻,是老幼皆宜的美味佳肴[1]。2013年4月,江西铅山红芽芋核准为国家地理标志农产品,现已成为江西省上饶市铅山县“两红”(红芽芋和河红茶)产业之一[2]。TIFY 蛋白属于植物特有GATA 转录因子家族,由于花序分生组织表达的锌指蛋白(zinc-finger protein expressed in inflorescence meriste,ZIM)家族具有高度保守的 TIFY 功能结构域,因此TIFY 蛋白也被命名为 TIFY 基因家族。根据保守结构域的组成,TIFY 家族蛋白可分为 4 个亚家族 (TIFY、JAZ、ZML 和 PPD)和2个亚群(亚群Ⅰ含 C2C2-GATA 结构域,亚群Ⅱ不含该结构域)[3]。TIFY 蛋白是控制植物中各种生物途径的主要关键因子,在植物发育过程中参与防御和應激反应,以应对生物和非生物胁迫响应[4-5]。TIFY1是首个在拟南芥中被鉴定的TIFY 家族转录因子[6]。目前,TIFY家族已被克隆和鉴定[7-9]。植物病毒有“植物癌症”之称,可通过维管束侵染植物,造成生物胁迫逆境,经济损失巨大,因此培育无病毒植株至关重要[10]。因此,对江西铅山红芽芋TIFY 9基因进行克隆和功能分析对培育江西铅山红芽芋的脱毒品种具有重要意义。近年来,TIFY 蛋白在植物抗逆胁迫中的研究成为热点,多集中在植物应对一些非生物胁迫如干旱、盐碱、渗透等逆境上,而对于生物胁迫相关研究较少。有研究表明,玉米的ZmJAZ基因对某些生物胁迫真菌(如丝黑穗、茎腐病和炭疽病)具有一定程度的胁迫响应[11]。目前,对红芽芋的研究主要集中在脱毒快繁[2]、微芋诱导[1]、下游加工[12]、成分分析[13]等方面,关于红芽芋TIFY 9蛋白的克隆及其功能分析尚未见报道。利用RT-PCR 技术克隆江西铅山红芽芋TIFY 9基因,并采用生物信息学方法、烟草转基因技术和实时定量 PCR进行序列、功能和组织表达分析,旨在为揭示江西铅山红芽芋TIFY 9的生物学功能提供理论依据,为从分子水平选育江西铅山红芽芋脱毒品种提供新思路。
1 材料与方法
1.1 试验材料
江西铅山红芽芋试管苗。试验于2020年5月至2021年4月在上饶师范学院生命科学学院进行。
1.2 试验方法
1.2.1 总RNA的提取和cDNA第1链的合成 用Trizol 试剂提取江西铅山红芽芋试管苗的总 RNA,提取步骤按说明书进行,使用紫外分光光度计和琼脂糖凝胶电泳检测 RNA 的浓度和完整性。以提取获得的 RNA为模版,按照 M-MLV cDNA 第1链合成试剂盒说明书合成 cDNA 第1链。逆转录引物用 Oligo(dT) 18 Primer:5′-GGCCACGCGTCGACTAGTACTTTTTTTTTTTTTTTTTT-3′,具体步骤按说明书进行。
1.2.2 TIFY 9基因的克隆 利用转录组组装的Unigene序列信息(TRINITY_DN3508_c0_g1),运用 Primer Premier 5.0 设计引物(F:GGGCGTGGTCCTCGGATAACA;R:AGACGGTGACGGTGCCGTTGT)。PCR扩增条件:95℃ 2 min;95 ℃ 30 s,51 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 10min。PCR 产物经 1%琼脂糖凝胶电泳检测后,将含有目的基因的条带与 pMD19-T 载体连接并用热激法转化到感受态细胞 Escherichia coli DH5α,经鉴定正确的阳性转化子提取质粒送往生工生物工程(上海)有限公司进行测序。
1.2.3 TIFY 9基因的生物信息学分析 使用 BioEdit软件翻译基因序列为氨基酸序列,用 ProtParam预测酶的理化性质,用 ProtScale預测酶的疏/亲水性。使用GOR I软件在线预测酶的二级结构。使用SWISS-MOLD在线预测酶的三级结构。采用 WoLFPsort在线预测基因的表达部位。通过软件DNAMAN和 Bioedit进行氨基酸序列比对,利用MEGA5.0软件进行系统进化树的构建。
1.2.4 基因克隆和载体构建 以提供的目的基因序列设计引物(去掉终止密码子TAG/TAA/TGA),CZ-T9-BamHⅠ-JF:ATGTCTAGACTCGAGATGTCCAAGTCTTACGTCG;CZ-T9-BamHⅠ-GFPR:GGCCGCTGTACACATGCAGGGAGGAGAGGGAAG,粗体部分为载体同源重组序列,以转录组筛选的cDNA为模板,以所述引物进行PCR扩增(采用南京诺唯赞生物科技股份有限公司Phanta Max Super-Fidelity DNA Polymerase)。PCR反应体系(总体积50 μL)包括 17 μL ddH2O、25 μL 2×Phanta Max Buffer、1 μL dNTP Mix(均为10 mmol/L)、2 μL 模板DNA、2 μL引物1(10 μmol/L)、2 μL引物2(10 μmol/L)和 1 μL Phanta Max Super-Fidelity DNA Polymease(1 U/μL)。PCR反应程序为:95 ℃ 30 s;95 ℃ 15 s,51 ℃ 15 s,72 ℃ 1 min,39个循环;72 ℃ 5 min。将PCR产物进行凝胶电泳。将条带切胶回收,即为目的基因片段。用BamHI酶切载体pCambia2301-KY-GFP线性化,回收后和目的基因片段重组反应(采用赛默飞世尔科技公司或TaKaRa公司相应限制性内切酶产品)。酶切反应体系包括2 μL 10×K Buffer、5 μL 载体质粒、2 μL BamHⅠ和ddH2O(补足 40 μL)。酶切产物纯化后与上述PCR产物进行重组反应(重组反应试剂盒为南京诺唯赞生物科技股份有限公司的ClonExpress-Ⅱ One Step Cloning Kit)。重组连接反应体系(总体积10 μL)包括4 μL 线性化载体、1 μL 插入片段、2 μL 5×CE Ⅱ Buffer、1 μL Exnase Ⅱ和ddH2O(补足10 μL)。上述反应液使用移液器轻轻吸打混匀,短暂离心将反应液收集至管底。置于37 ℃反应30 min,随后立即置于冰上冷却。重组产物转化大肠杆菌DH5α细胞。挑取PCR阳性的转化子摇菌培养提取质粒,同时扩增产物送测序。扩增和测序引物为插入目的基因两侧的载体序列(目的基因较短则只进行一侧测序),分别为35S-F:5′-GACGCACAATCCCACTATCC-3′;GFP-JR:5′-GGGTGAGCTTGCCGTAGGTG-3′。
1.2.5 烟草叶片亚细胞定位 播种烟草,培养约1个月用于试验;将构建好的载体质粒转入农杆菌GV3101,涂布卡那霉素抗性平板,挑取单克隆于YEB液体培养基在28 ℃摇床内小摇、大摇培养 2 d,菌体4 000 r/min离心4 min,去上清后菌体用用10 mmol/L MgCl2(含120 μmol/L乙酰丁香酮)悬浮液重悬菌体,调整D600 nm值为0.6左右;用无针头的1 mL注射器吸取农杆菌液,从烟草叶片下表皮(背面)压迫注射;将注射完成的烟草植株弱光培养2 d,即可观察;接种2 d后取注射区域的烟草叶片,制作玻片,在激光共聚焦显微镜(FluoView FV1Oi,OLYMPUS公司)下观察、拍照;同时以空载体转化的农杆菌作为对照重复上述操作。叶绿体荧光信号说明:叶绿体荧光信号激发波长640 nm,发射波长675 nm;绿色荧光蛋白(GFP)信号说明:绿色荧光蛋白GFP激发光488 nm,发射光510 nm。
1.2.6 烟草TIFY 9转基因PCR检测和GUS组织化学染色 烟草叶片用农杆菌侵染后均经过4次筛选/继代,诱导出抗性芽,再转入伸长培养基中。采用PCR对其再生苗进行鉴定,得到TIFY 9基因的烟草转基因株系。PCR检测引物:载体上游引物35S-F:GACGCACAATCCCACTATCC;目的基因下游引物:GCAGGGAGGAGAGGGAAG。使用南京诺唯赞公司Taq 酶扩增体系和条件。2×Taq Master Mix 扩增体系(共20 μL)包括7μL ddH2O、10 μL 2×Taq Master Mix、1 μL 模板DNA、1 μL引物1(10 μmol/L)、1 μL 引物2 (10 μmol/L)。PCR反应程序:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 60 s,35个循环;72 ℃ 5 min。GUS组织化学染色:采集烟草TIFY 9转基因株系和非转基因株系移栽苗的叶片组织,加GUS染液于37 ℃过夜染色;染色后的叶片再用75%的乙醇脱色(去除叶绿素),也于37 ℃过夜。倒掉脱色乙醇后再用75%乙醇清洗后观察并拍照。
1.2.7 烟草TIFY 9转基因株系和非转基因株系移栽苗的病毒接种和光合指标检测 培养3个月后,取含烟草花叶病毒的烟草试管苗叶片放在研钵中并加入适量磷酸缓冲液研磨成糊状病样汁液;然后在烟草TIFY 9转基因株系和非转基因株系移栽苗幼嫩的叶面上洒少许等量金刚砂,蘸取含烟草花叶病毒的烟草试管苗等量病样汁液在洒了金刚砂的叶面上轻抹 3次(模拟蚜虫的病毒田间传播),之后用无菌水清洗叶面;然后放入智能人工气候室内浇灌MS液体培养基培养;2个月后采用Li-6400便携式光合测定仪(LI-COR公司,美国)仪测定烟草TIFY 9转基因株系和非转基因株系移栽苗的光合参数和叶绿素荧光参数。所有数据表示为平均值±标准差,并使用SPSS 19.0软件进行统计分析,应用单因素方差分析(One-way ANOVA)检验TIFY 9基因组织表达的差异显著性(α=0.05)。
1.2.8 TIFY 9基因的组织表达分析 分别取江西铅山红芽芋试管苗的根、茎、叶、试管球茎(初期、中期和末期)RNA 500 ng,反转录为cDNA。荧光定量 PCR(qRT-PCR,SYBR Green Ⅰ)检测内参基因为GAPDH。设计引物(F:TGCCCTGAGCGTTCCCTAC;R:ACCCGCCTCCACTTCTTCC;长度:178 bp;Tm:583 ℃)。qRT-PCR 检测采用20 μL反应体系,PCR反應程序:95 ℃ 10 min;95 ℃ 10 s,60 ℃ 34 s,95 ℃ 15 s,40个循环。使用 2-ΔΔCT 法计算基因表达水平。试验重复3次。所有数据表示为平均值±标准差,并使用SPSS 19.0软件进行统计分析,应用单因素方差分析(One-way ANOVA)检验TIFY 9基因组织表达的差异显著性(α=0.05)。
2 结果与分析
2.1 cDNA序列
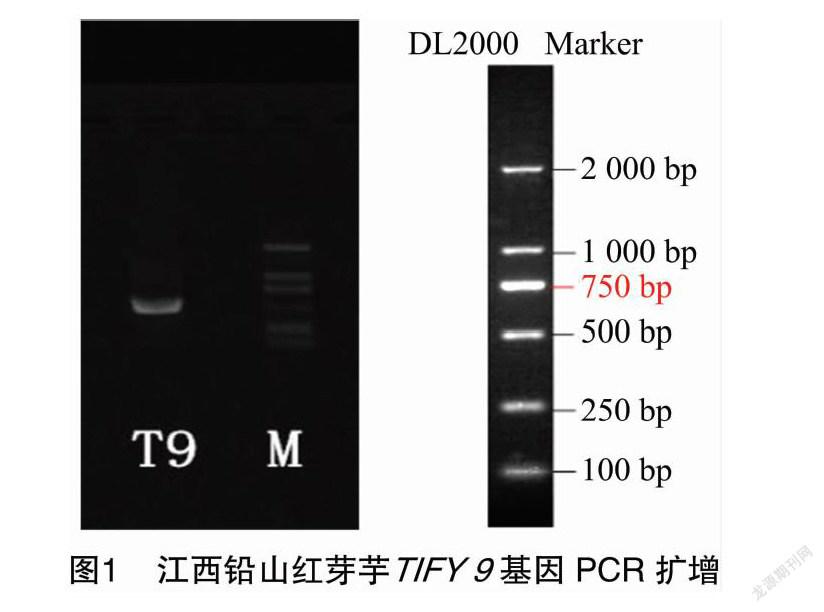
通过PCR扩增技术(图1),江西铅山红芽芋TIFY 9基因cDNA总长度为522 bp(图2),G+C含量为58.62%。
2.2 氨基酸序列
Protparam预测显示江西铅山红芽芋TIFY 9氨基酸序列见图3。该基因由174个氨基酸组成,分子量19 073.87 u,等电点9.30,为亲水性蛋白。各氨基酸的数量和比例为Ala(A)(18,10.3%)、Arg(R)(13,7.5%)、Asn(N)(7,4.0%)、Asp(D)(8,4.6%)、Cys(C)(3,1.7%)、Gln(Q)(3,1.7%)、Glu(E)(9,5.2%)、Gly(G)(6,3.4%)、His(H)(1,06%)、Ile(I)(8,4.6%)、Leu(L)(13,7.5%)、Lys(K)(9,5.2%)、Met(M)(6,3.4%)、Phe(F)(7,40%)、Pro(P)(17,9.8%)、Ser(S)(21,12.1%)、Thr(T)(10,5.7%)、Trp(W)(2,1.1%)、Tyr(Y)(3,1.7%)、Val(V)(10,5.7%)。带负电残基总数(Asp+Glu)为17,正电荷残基总数(Arg+Lys)为22。估计半衰期为30 h(哺乳动物网织红细胞,体外);>20 h(酵母,体内);>10 h(大肠杆菌,体内)。不稳定指数:失稳指数(Ⅱ)计算为5469,这将蛋白质分类为不稳定的。
2.3 亲疏水性分析
从图4可知,高峰值(正值)的区域表示疏水的区域,而低谷值(负值)的区域是亲水区域。其最大疏水值为1.5左右,说明在该多肽中该处的疏水性最强;亲水峰最大值为-2.5左右,整个蛋白质表现出高度的亲水性,说明该蛋白为亲水性蛋白质。
2.4 二级结构分析
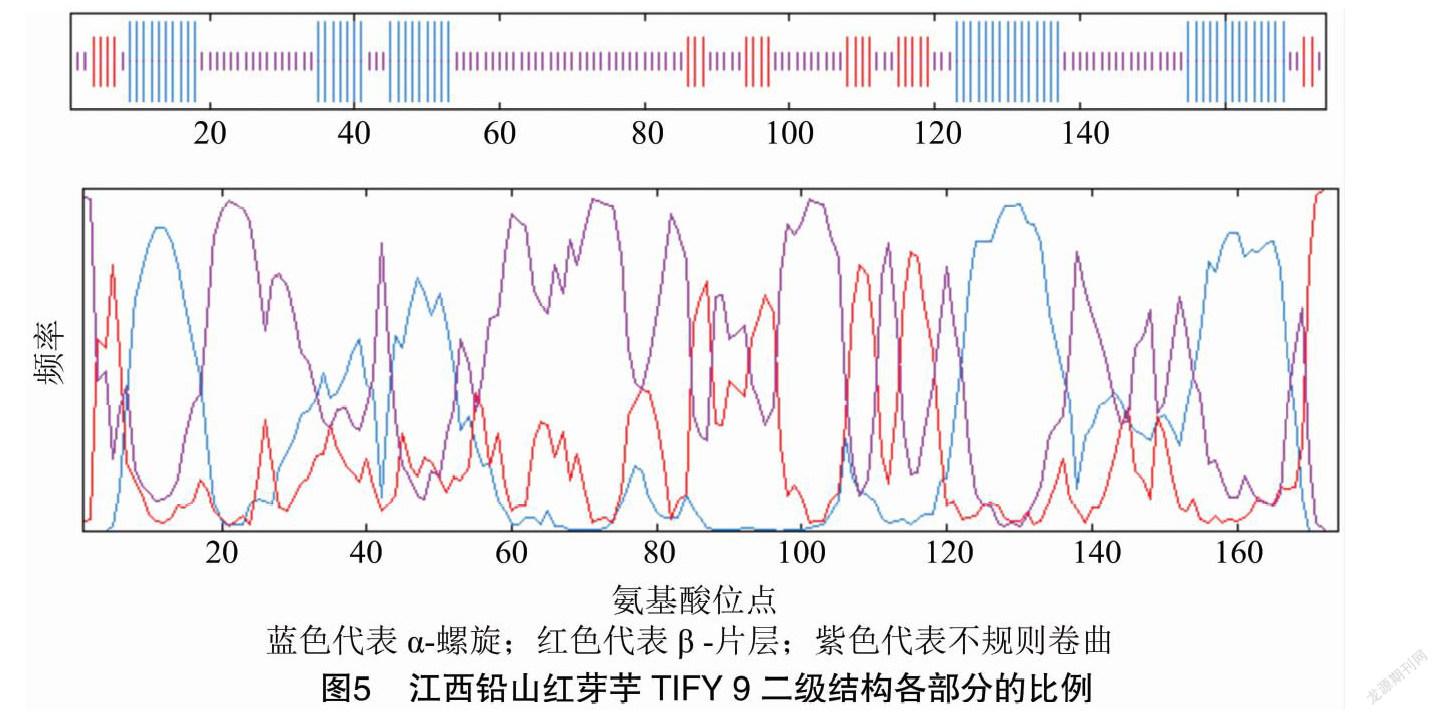
GOR 预测显示江西铅山红芽芋TIFY 9二级结构由α螺旋(Hh,31.61%)、β-片层(Ee,12.64%)、 无规则卷曲(Cc,55.75%)构成(图5)。从分布位点上来看,C端和N端主要含α-螺旋、无规则卷曲和β-片层,且无规则卷曲、β-片层和 α-螺旋则散布于整个蛋白质中。
2.5 三级结构分析
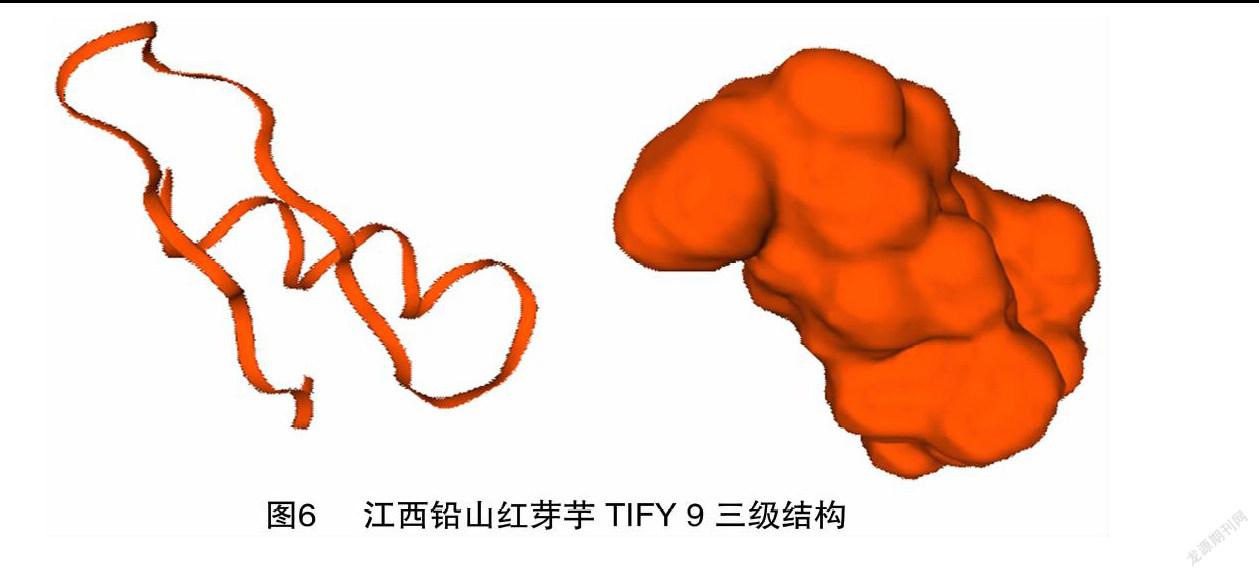
SWISS-MODEL预测显示江西铅山红芽芋TIFY 9的三级结构为同源三聚体(图6)。
2.6 亚细胞定位
采用 WoLFPsort在线软件对江西铅山红芽芋TIFY 9基因的表达部位进行预测。图7显示,定位于细胞核中的数量为12,线粒体中的数量为1,叶绿体中的数量为1。表明江西铅山红芽芋TIFY 9基因主要存在细胞核中。
2.7 系统进化分析
从构建的进化树(图8)可见,江西铅山红芽芋与Colocasiaesculenta(芋)在一个大分支下,这说明江西铅山红芽芋TIFY 9在进化上与Colocasia esculenta(芋)的亲缘关系较近,与Colocasia esculenta hypothetical peotein Taro_030839(MQL98131.1)在进化上具有最高的亲缘关系。
2.8 同源蛋白的序列比对信息
同源蛋白的序列比对信息见图9,其中※号区域是该蛋白家族的保守结构域。
2.9 目的片段扩增与瞬时表达载体构建
以提供的目的基因序列设计引物(去掉终止密码子TAG/TAA/TGA)进行PCR扩增,对PCR产物凝胶电泳结果显示,在目标位置扩增到单一条带,大小正确。将条带切胶回收,即为目的基因片段(图10)。用BamHⅠ酶切载体pRI101-GFP线性化,回收后和目的基因片段重组反应。重组产物转化大肠杆菌DH5α细胞。挑取PCR阳性的转化子摇菌培养提取质粒,对重组质粒进行酶切检测(图11),同时扩增产物送测序。测序比对结果显示,目的基因已插入载体,表达载体构建准确(图12)。
2.10 亚细胞定位分析
通过烟草叶片瞬时表达,将TIFY 9融合绿色荧光蛋白(GFP)的载体质粒TIFY 9-GFP转入农杆菌,吸取农杆菌液,压迫注入烟草叶片下表皮(背面)进行烟草病毒增殖蛋白1亚细胞定位分析(图13)。利用激光共聚焦显微镜观察,融合GFP的TIFY 9转化烟草叶片只在细胞质和细胞核膜观察到绿色荧光,表明TIFY 9定位于细胞质和细胞核。
2.10 转基因烟草鉴定、GUS组织化学染色和光合特征
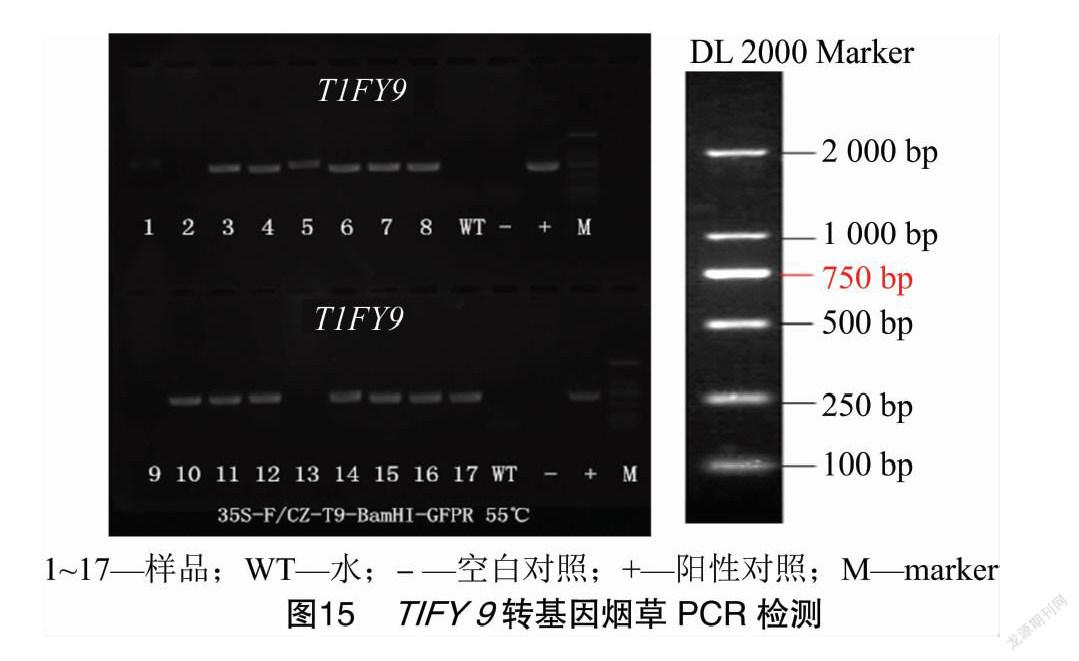
烟草叶片用农杆菌侵染后均经过3次筛选/继代,诱导出抗性芽,再转入伸长培养基,最后将其移栽成活(图14)。经PCR检测(图15),获得TIFY 9转基因烟草和TIFY 9非转基因烟草。在PCR检测基础上,对2种烟草进行GUS染色验证(图16)。结果表明,PCR检测和GUS检测结果一致。然后模拟蚜虫的病毒田间传播,在烟草TIFY 9转基因株系和非转基因株系移栽苗涂抹含烟草花叶病毒的烟草试管苗等量病样汁液,2个月后测定烟草TIFY 9转基因株系和非转基因株系移栽苗的光合参数和叶绿素荧光参数。结果表明,与TIFY 9非转基因烟草相比较,TIFY 9转基因烟草的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)、最大光化学效率(Fv/Fm)、实际光化学量子效率(ΦPSⅡ)、光化学淬灭系数(qP)及电子传递效率(ETR)显著增加,而非光化学淬灭系数(NPQ)显著下降(表1)。
2.11 不同器官及球茎膨大不同时期TIFY 9基因的表达分析
以江西铅山红芽芋的GAPDH为内参,利用实时荧光定量PCR分析江西铅山红芽芋TIFY 9基因在江西铅山红芽芋不同器官中的表达情况。结果显示,江西铅山红芽芋TIFY 9基因在根、茎、叶中均有表达,但在不同组织器官的表达情况差异显著(图17),其中江西铅山红芽芋TIFY 9基因在叶和球茎膨大初期中表达量最高。
3 结论与讨论
TIFY蛋白是植物特有的转录因子,在植物的生長发育、响应逆境胁迫和信号转导等过程中发挥重要作用[14-15]。前期研究中,笔者所在课题组发现1个江西铅山红芽芋TIFY9基因在超低温疗法脱毒处理的脱毒苗叶片中的表达量下调,说明它是一个芋花叶病毒(DsMV)、黄瓜花叶病毒(CMV)、芋羽状斑驳病毒(TFMoV)等病毒侵染后诱导的基因[1]。在本试验中,亚细胞定位预测结果显示江西铅山红芽芋TIFY 9主要定位在细胞核、线粒体和叶绿体中,与烟草叶片TIFY 9转基因瞬时过表达的亚细胞定位分析结果一致,也与转录因子核定位特征一致[16]。有研究表明,龙血树DcTIFY基因在根和茎中的表达量最高[17],而在本试验中,江西铅山红芽芋TIFY 9基因在叶和球茎膨大初期中表达量最高。江西铅山红芽芋TIFY 9基因在叶中的表达水平显著高于其他部位(根和茎),且在球茎膨大初期的表达水平
显著高于其他时期(中期和晚期),说明它可能在叶片中和球茎膨大初期发挥着重要的作用,推测江西铅山红芽芋TIFY 9基因可能参与了调控球茎膨大成熟过程。在本试验中,江西铅山红芽芋TIFY9 转录因子与Colocasia esculenta(芋)hypothetical peotein Taro_030839(MQL98131.1)在进化上具有最高的亲缘关系(100%),说明江西铅山红芽芋TIFY 9相对保守。有研究表明,TIFY基因在病原体反应中起着重要作用[8,18]。在本试验中,江西铅山红芽芋TIFY 9蛋白编码174个氨基酸,为亲水性不稳定蛋白,因此分析判断江西铅山红芽芋TIFY 9基因可能与病毒胁迫逆境相关。经禾甲安处理后的番木瓜感病植株中CpTIFY10A-like基因表达量显著升高,而番木瓜环斑病毒(PRSV)基因表达量显著降低,推测禾甲安可诱导CpTIFY10A-like基因高效表达,致使PRSV基因表达量大幅度降低[19]。本试验模拟蚜虫的病毒田间传播,在烟草TIFY 9转基因株系和非转基因株系移栽上苗涂抹含烟草花叶病毒的烟草试管苗等量病样汁液,与TIFY 9非转基因烟草相比较,TIFY 9转基因烟草的光合参数(Pn)、气孔导度(Gs)、蒸腾速率(Tr)、最大光化学效率(Fv/Fm)、实际光化学量子效率(ΦPSⅡ)、光化学淬灭系数(qP)及电子传递效率(ETR)显著增加,而非光化学淬灭系数(NPQ)显著下降,说明江西铅山红芽芋TIFY 9基因响应病毒胁迫应答可能是依赖光合作用的提高。本研究通过克隆江西铅山红芽芋TIFY 9基因并对其进行生物学信息、组织表达量、亚细胞定位和功能分析,为今后深入进一步探索江西铅山红芽芋TIFY 9基因的功能及表达蛋白互作提供理论参考,同时为研究江西铅山红芽芋TIFY 9基因在江西铅山红芽芋抗芋花叶病毒(DsMV)、黄瓜花叶病毒(CMV)、芋羽状斑驳病毒(TFMoV)等病毒侵染过程的分子调控机理打下基础,对江西铅山红芽芋脱毒育种具有重要意义。
参考文献:
[1]刘星月,朱强龙,李慧英,等. 红芽芋脱毒试管芋诱导及植株再生[J]. 园艺学报,2020,47(12):2427-2438.
[2]周庆红,刘星月,王葡萄,等. 脱毒红芽芋不同世代生长特性及产量分析[J]. 种子,2020,39(2):96-98.
[3]杨锐佳,张中保,吴忠义. 植物转录因子TIFY家族蛋白结构和功能的研究进展[J]. 生物技术通报,2020,36(12):121-128.
[4]Thireault C,Shyu C,Yoshida Y,et al. Repression of jasmonate signaling by a non-TIFY JAZ protein in Arabidopsis[J]. The Plant Journal,2015,82(4):669-679.
[5]Ebel C,BenFeki A,Hanin M,et al. Characterization of wheat (Triticum aestivum) TIFY family and role of Triticum Durum TdTIFY11a in salt stress tolerance[J]. PLoS One,2018,13(7):e0200566.
[6]Nishii A,Takemura M,Fujita H,et al. Characterization of a novel gene encoding a putative single zinc-finger protein,ZIM,expressed during the reproductive phase in Arabidopsis thaliana[J]. Bioscience,Biotechnology,and Biochemistry,2000,64(7):1402-1409.
[7]溫 东,王梦月,米要磊,等. 中药火麻仁基原植物大麻的TIFY基因家族鉴定及功能分析[J]. 中国实验方剂学杂志,2020,26(24):134-143.
[8]Ye H Y,Du H,Tang N,et al. Identification and expression profiling
analysis of TIFY family genes involved in stress and phytohormone responses in rice[J]. Plant Molecular Biology,2009,71(3):291-305.
[9]Zhu D,Bai X,Luo X A,et al. Identification of wild soybean (Glycine soja) TIFY family genes and their expression profiling analysis under bicarbonate stress[J]. Plant Cell Reports,2013,32(2):263-272.
[10]Llave C. Virus-derived small interfering RNAs at the core of plant-virus interactions[J]. Trends in Plant Science,2010,15(12):701-707.
[11]Zhang Z B,Li X L,Yu R,et al. Isolation,structural analysis,and expression characteristics of the maize TIFY gene family[J]. Molecular Genetics and Genomics,2015,290(5):1849-1858.
[12]李 云,牛丽亚,涂 瑾,等. 亲水胶体对红芽芋全粉理化特性和消化特性的影响[J]. 中国粮油学报,2020,35(2):12-17.
[13]姜绍通,程元珍,郑 志,等. 红芽芋营养成分分析及评价[J]. 食品科学,2012,33(11):269-272.
[14]Clarke J D,Volko S M,Ledford H,et al. Roles of salicylic acid,jasmonic acid,and ethylene in cpr-induced resistance in Arabidopsis[J]. The Plant Cell,2000,12(11):2175-2190.
[15]Vanholme B,Grunewald W,Bateman A,et al. The tify family previously known as ZIM[J]. Trends in Plant Science,2007,12(6):239-244.
[16]罗冬兰,巴良杰,陈建业,等. 香蕉MaTIFY1转录因子特性及其在成熟过程中基因表达分析[J]. 园艺学报,2017,44(1):43-52.
[17]丁旭坡,马纳纳,庞宽壮,等. 海南龙血树4个DcTIFY10转录因子的鉴定和表达分析[J]. 分子植物育种,2019,17(19):6287-6294.
[18]Song S S,Qi T C,Fan M,et al. The bHLH subgroup IIId factors negatively regulate jasmonate-mediated plant defense and development[J]. PLoS Genetics,2013,9(7):e1003653.
[19]吕金慧,王府润,陈 萍. 番木瓜CpTIFY10A-like基因克隆及表达分析[J]. 南方农业学报,2020,51(6):1308-1315.

