脓毒症患者早期外周血外泌体中miR-1-3p的表达分析
刘振密 刘晓君 王 熙 马永辉 陈友莲 陈怀生
暨南大学第二临床医学院/南方科技大学附属医院/深圳市人民医院重症医学科 (广东 深圳 518020)
脓毒症是重症医学科常见危重病,死亡率高,严重威胁着人类健康,病患年增长量超过1900万,死亡率超过25%[1]。脓毒症最新的定义是感染引起的宿主反应失控导致的致命性器官功能障碍,序贯器官功能评分(SOFA)≥2分[2]。脓毒症的具体发病机制尚未完全明确,目前大多数学者认为其发病核心机制为全身炎症反应失衡。近来越来越多研究表明在全身炎症反应进展期间,细胞分泌的外泌体在调节疾病进展中起不同作用,而外泌体中不同生物功能成分包括蛋白质、mRNA、微小RNA(microRNA,miRNA),对脓毒症的受损器官及其预后均有不同的影响[3]。外泌体是从内吞细胞器释放的纳米级细胞外囊泡,称为几乎所有类型细胞的多囊泡体[4-5]。已知外泌体具有生物功能成分,包括蛋白质,信使RNA(mRNA)和microRNA(miRNA),并介导邻近和远处细胞之间的细胞间通讯[6]。本研究通过检测脓毒症患者外周血中外泌体的miR-1-3P的表达水平,并监测这些脓毒症患者的血常规、C-反应蛋白、降钙素原(PCT)、白介素6(IL6)等指标,了解脓毒症患者外周血中外泌体的miR-1-3P的表达水平,并探讨其与常用的炎症指标之间的关系。
1 资料与方法
1.1 一般资料于2019年1月至2019年8月纳入17例脓毒症患者,其中男性11名,女性6名。年龄29~102岁,平均年龄(65±22)岁。APACHE Ⅱ评分(25.65±7.60)分,SOFA评分(11.06±5.53)分。患者的主要感染部位主要为肺部、腹腔、血液等部位。另取9例健康志愿者作为对照组。研究获本院医学伦理委员会同意,并签署知情同意书。
纳入标准:符合脓毒症sepsis3.0[2]的脓毒症诊断标准;年龄>18岁;患者知情同意。排除标准:伴有严重基础疾病,如心肺复苏后、特重型颅脑损伤,预后极差,可能成为主要死因的病症;预计24h内死亡的患者;合并自身免疫性疾病。
1.2 治疗与检测患者进入ICU后,根据感染情况选用抗感染药物治疗。如果休克,则给与早期液体复苏治疗,并根据患者病情选用机械通气等生命支持。患者常规检测血常规、C-反应蛋白、降钙素原(PCT)、白介素6(IL6)等指标。患者及9例健康志愿者均留取2mL血样,并3000r/min离心15min,取上清液,置于-80°C冰箱中备用。
将血清通过商业化试剂盒分别提取外周血中外泌体后,对外泌体中含有miR-1-3p表达进行荧光定量PCR(quantitative real-time PCR,qRT-PCR)检测,同时也对血浆外泌体中U6表达进行检测,并以U6表达作为内参。全部试验均为三复孔检测,取其平均值。计算方法:先在对照组及实验组中,用目的基因平均Ct值减去内参基因表达平均Ct值(ΔCt),得到差值;然后以2为底数,以差值的相反数作为指数,计算其最终数值,从而得出该基因的相对表达量(2-ΔCt);最后根据最终的相对表达量进行做图比较两组之间表达差异。
1.3 统计学方法正态分布数据采用(±s)表达,非正态分布数据采用四分位法表达。miR-1-3p与实验室结果的关系研究采用双变量相关分析。SPSS 20.0软件进行数据分析,P<0.05提示差异具有统计学意义。
2 结 果
17例患者的性别、年龄、诊断、评分系统,实验室检查感染和炎症相关的指标,包括白细胞计数(WBC)、降钙素原(PCT)、超敏C反应蛋白(hsCRP)和白介素6(IL-6)。记录外泌体中miR-1-3p相对表达量,以及患者的临床结局、ICU住院日和机械通气日。患者的临床及实验室检查特征见表1。
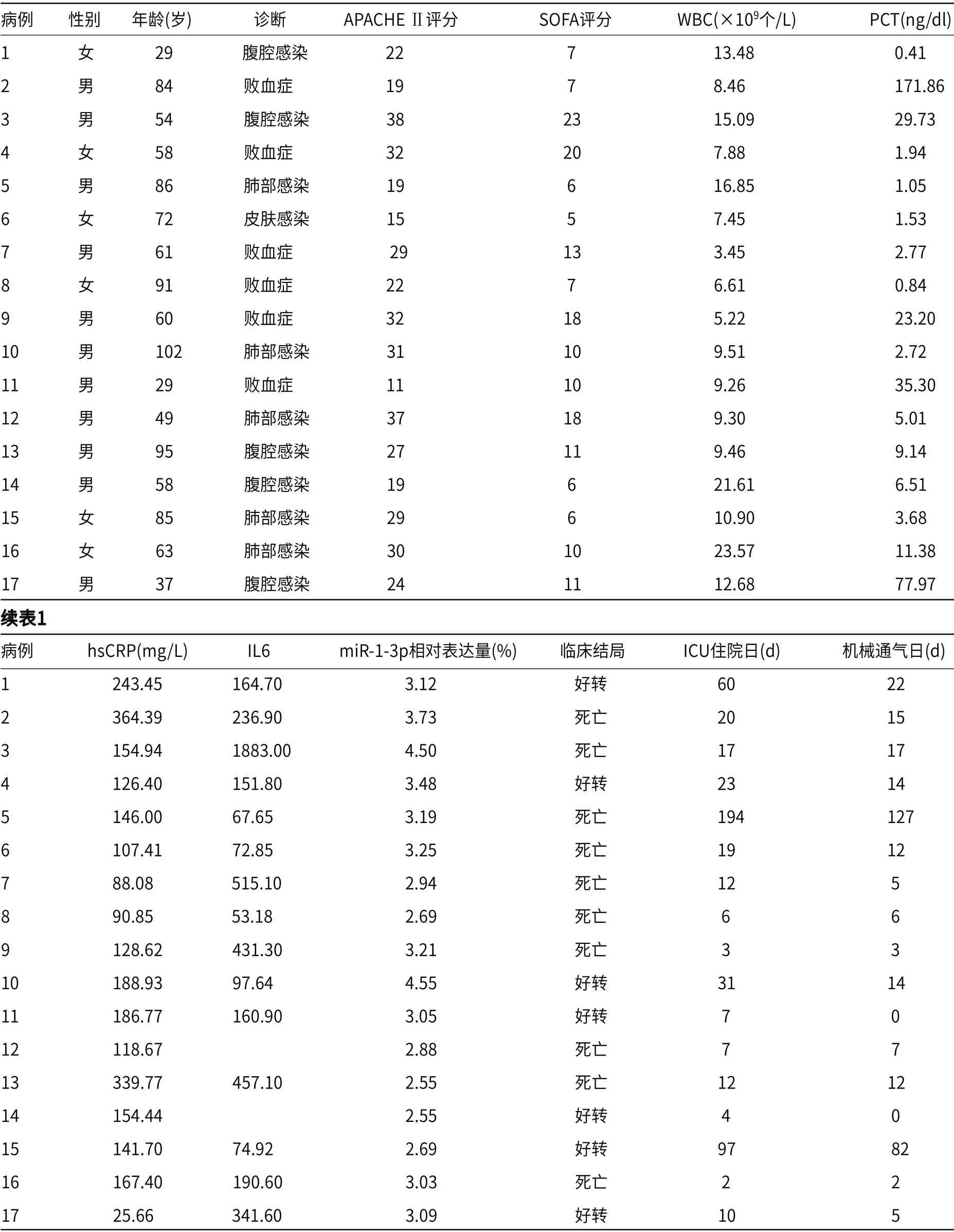
表1 脓毒症患者临床特征表
与健康者比较,脓毒症患者的外周血外泌体中miR-1-3p相对表达量明显增高(图1),脓毒症患者外周血外泌体中miR-1-3p相对表达量增高具有统计学意义(P<0.001)。

图1 脓毒症与健康对照者外周血外泌体miR-1-3p相对表达量差异。
健康对照者外周血外泌体miR-1-3p相对表达量与炎症因子相关性研究,结果提示,患者外周血外泌体miR-1-3p相对表达量与外周血WBC、PCT、hsCRP缺乏相关性(p值均>0.05),而与IL-6具有明显相关性(相关系数r=0.514,P=0.035,见图2)。
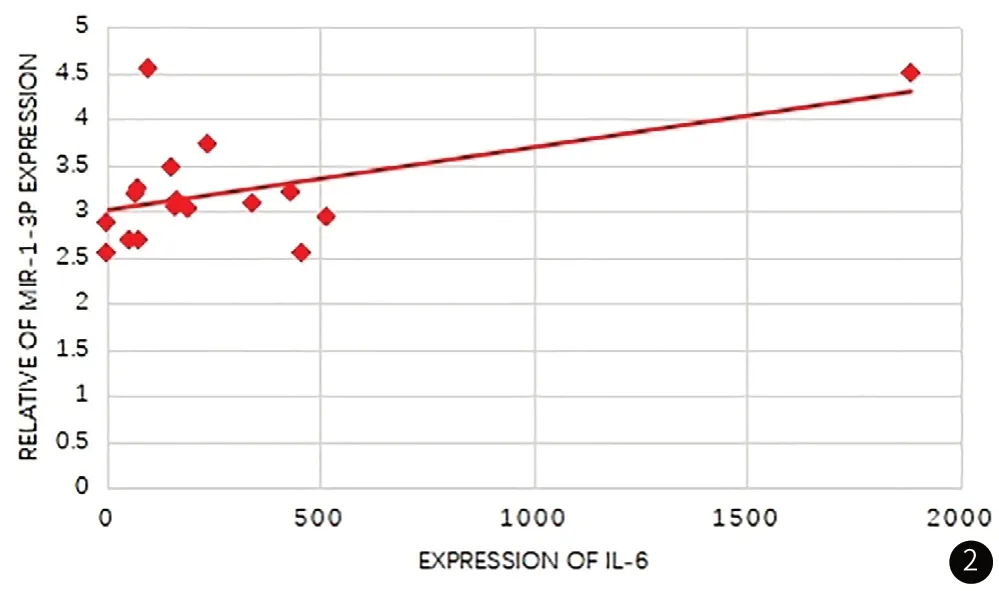
图2 脓毒症患者外周血外泌体miR-1-3p相对表达量与IL-6相关。
3 讨 论
脓毒症为感染引起的宿主反应失控,进而导致危及生命的多器官功能障碍,严重危害人类健康。关于脓毒症的发病机制有较多学说,目前普遍认为感染导致的失控的炎症反应对机体的自身伤害作用才是脓毒症发生的核心机制。虽然目前临床与脓毒症相关的生物标志物有很多,但却没有一项生物标志物能够确切地反映脓毒症患者的预后。随着基础研究的深入,发现人体的多种液体(包括血浆和尿液)的外泌体可被视为脓毒症和炎性组织损伤的生物标志物,外泌体中的miRNA在脓毒症的炎症反应损伤及器官功能障碍有着不同的调节作用[3]。Goodwin等[7]的研究发现在人类脓毒症中,随着休克的发展,血浆miRNA发生明显改变,观察到发生休克的脓毒症患者中miR-15a和miR-27a的下调以及miR-34a的上调,通过使用miRNA数据库进行的生物信息学分析,提示miR-15a、miR-27a和miR-34a参与相关途径(包括LPS-刺激的信号传导,内皮细胞周期,VEGF信号传导和NF-κB信号传导)靶基因的调节。另外Wu等[8]报道内皮祖细胞(EPC)外泌体显着改善了脂多糖(LPS)诱导的内皮血管通透性,并在体外和体内均恢复了内皮细胞的增殖,迁移和血管生成能力,通过功能丧失研究发现,富含EPC外泌体的miR-126可转移到内皮细胞上,并且对外泌体功能至关重要,这些发现表明EPC外泌体具有治疗ALI/ARDS的治疗潜力,其中外泌体miR-126通过负调节关键分子,如含发芽相关EVH1域的蛋白1(SPRED1)。所以,监测患者血浆中miRNA的定量变化对脓毒症的诊断、进展和治疗有重要意义。
如上所述,外泌体是从内吞细胞器释放的纳米级细胞外囊泡,称为几乎所有类型细胞的多囊泡体,其生物功能成分包括蛋白质、mRNA、miRNA。而miRNA是一类由19至24个核苷酸单位组成的内源性非编码RNA分子,广泛存在于真核生物中[9]。miRNA参与众多生理病理过程,如细胞增殖、分化、凋亡、迁移和损伤等。miR-1-3p是一种与多种恶性肿瘤进展相关的miRNA,Shang等[10]研究证实与正常组织和细胞相比,膀胱癌组织和细胞的miR-1-3p和SFRP1的表达显着降低,而人膀胱癌细胞系J82在这些表达中的降低最为明显(P<0.05),MiR-1-3p上调膀胱癌细胞中SFRP1的表达,miR-1-3p的过表达可以抑制膀胱癌细胞的增殖,侵袭和迁移能力。而近年研究发现miR-1-3p与心血管疾病发生发展有关,张荣峰等[11]发现急性ST段抬高型心肌梗死患者血清中miR-1-3p相对表达量低于急性非ST段抬高型心肌梗死组,且与TC、LDL-C、NT-proBNP、左室舒张末期内径(LVEDD)程负相关。而本研究通过检测本重症医学科17例脓毒症患者的外周血外泌体中的miR-1-3p的表达量,通过与9例健康者对比发现脓毒症患者的外周血外泌体中miR-1-3p相对表达量明显增高(图1),另外患者外周血外泌体miR-1-3p相对表达量与外周血WBC、PCT、hsCRP缺乏相关性(P>0.05),而与IL-6具有明显相关性(相关系数r=0.514,P=0.035,图2)。IL-6是由IL-1与肿瘤坏死因子-α (TNF-α)诱导产生的多效细胞因子,在炎症反应过程中发挥着核心调节功能,是关键的炎症反应递质。IL-6的检测值在细菌感染时明显升高,可以作为感染评估和检测的常用指标,且其水平与患者疾病的严重程度呈正相关[12]。此外,IL-6对脓毒症及病情严重程度的判定具有重要意义。有研究表明,脓毒症患者血清 IL-6 水平显著高于非脓毒症患者,脓毒性休克患者血清IL-6水平显著高于非脓毒性休克患者[13]。本研究脓毒症患者外周血外泌体中miR-1-3p相对表达量明显增高及其与炎症因子IL-6的相关性,可能是miR-1-3p参与脓毒症炎症反应调控的结果,可能成为脓毒症预测的一个指标,但其具体作用和机制需待进一步深入研究。

