饲料中乳酸菌水平对红白锦鲤生长、免疫力、消化酶活性及体色的影响
曲木,唐子鹏,运永光,刘艳,翟胜利
(天津市金水族水产养殖有限公司 天津市水族动物功能性饲料企业重点实验室,天津 301800)
锦鲤(Cyprinus carpioL.)源于中国,体色多样,有“水中活宝石”之称,历经多年的杂交选育,目前已成为我国养殖的主要观赏鱼种类之一。红白锦鲤(Cyprinus carpio haematopterus)体表底色为白色,嵌有艳丽的红色斑纹,是锦鲤的主流品系之一,深受人们的喜爱。锦鲤健康状况会直接影响其观赏价值,如果锦鲤免疫力低下或患某些疾病,其体色会变得暗淡。因此,研究锦鲤免疫力及消化酶活力很有必要。
乳酸菌(Lactic Acid Bacteria,LAB)是一类革兰氏阳性杆菌或球菌、不形成芽胞、不运动、过氧化氢酶反应呈阴性及对葡萄糖发酵能产生50%以上乳酸的细菌的总称。乳酸菌在自然界中分布广泛,是一种非常重要的益生菌,在水产养殖业中具有非常广泛的应用前景,可以改善水域环境、抑制有害微生物、提高机体免疫力及促进水产动物生长等[1]。
本试验以红白锦鲤为养殖对象,在饲料中添加不同水平的乳酸菌,探讨乳酸菌对红白锦鲤生长、免疫力、消化酶活性及体色的影响。
1 材料与方法
1.1 试剂与仪器
试验用乳酸菌(菌液活菌密度为2×109cfu/mL),河南君安生物科技有限公司;基础饲料(粗蛋白含量32%),天津市晨辉饲料有限公司。
无水乙醇,分析纯,天津市大茂化学试剂厂;酸性磷酸酶测定试剂盒、碱性磷酸酶测定试剂盒、谷草转氨酶测定试剂盒、谷丙转氨酶测定试剂盒、总抗氧化能力测定试剂盒、丙二醛测定试剂盒、过氧化氢酶测定试剂盒、总超氧化物歧化酶测定试剂盒、脂肪酶测定试剂盒及α-淀粉酶测定试剂盒,南京建成生物工程研究所。
HH-6数显恒温水浴锅,力辰仪器科技有限公司;JP-020超声波清洗机,洁盟清洗设备有限公司;TD5KR台式冷冻离心机,长沙东旺实验仪器有限公司;WH-2微型旋涡混合仪,上海沪西分析仪器厂有限公司;Sky-1530酶标仪,Thermo公司;FA-1004电子分析天平,力辰仪器科技有限公司;UV-1800紫外分光光度计,翱艺仪器(上海)有限公司;JZ-350色差仪,深圳市金准仪器设备有限公司;FSH-2A可调高速匀浆机,常州市金坛友联仪器研究所;BCD-196SMK(E)冰箱,美的集团股份有限公司。
1.2 试验鱼与养殖管理
以红白锦鲤为养殖对象,选取规格一致、健康活泼的红白锦鲤900尾,随机分为6个组(其中5组为试验组,1组为对照组),每组3个重复,每个重复50尾鱼,养殖于18个规格为3 m×5 m×1 m的水泥池中。试验开始前对试验鱼进行消毒处理,暂养一周后分组,基础饲料训化2周后,开始正式试验,养殖周期为8周。试验期间养殖水体氨氮含量≤0.2 mg/L、亚硝酸盐含量≤0.1 mg/L、pH=8.4,养殖期间平均水温为19 ℃。饲料投喂时间为每日08:00与16:00,按照鱼总重的2%称重饲料后投喂。
1.3 饲料配方
将菌液按照体积分数0.25%、0.75%、2.25%、6.75%和20.25%溶入纯水中,均匀喷洒基础饲料(粗蛋白含量32%)表面,乳酸菌添加量分别为0.05×108cfu/g、0.15×108cfu/g、0.45×108cfu/g、1.35×108cfu/g和4.05×108cfu/g,所配制试验饲料依次记为Diet 1、Diet 2、Diet 3、Diet 4和Diet 5,对照组喷洒相同体积的纯水。试验饲料在投喂前一天喷洒,在阴凉通风处晾干,置于-20 ℃冰箱保存。
1.4 样本采集及指标测定
1.4.1 样本采集
养殖试验结束后,取样,每个重复取9尾鱼,共27尾。血样采集方法为尾静脉采血,解剖后取肝胰脏、中肾、脾、肌肉和肠等组织,血液在冰浴条件下用离心机4 000 r/min离心15 min取其上清液,所取样本于冰箱-20 ℃中冷冻保存。
1.4.2 指标测定
(1)生长指标测定。计算增重率、特定生长率、饵料系数、蛋白质效率及肝体比等,具体公式为:

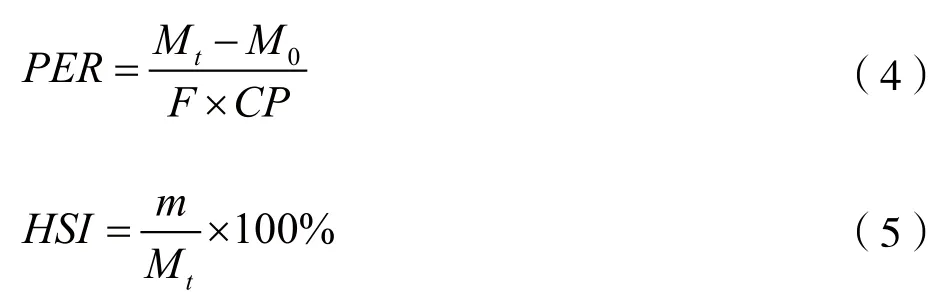
式中:WGR为增重率,%;SGR为特定生长率,%/d;FCR为饲料系数;PER为蛋白质效率;HIS为肝体比,%;Mt为终末体重,g;M0为初始体重,g;t为试验天数,d;F为饲料摄入量干重,g;CP为饲料粗蛋白质含量,g;m为肝重,g。
(2)免疫指标及消化酶活性测定。免疫指标需要测定酸性磷酸酶(Acid Phosphatase,ACP)、碱性磷酸酶(Alkaline Phosphatase,AKP)、谷草转氨酶(Glutamic-Oxalacetic Transaminase,GOT)、谷丙转氨酶(Glutamic-Pyruvic Transaminase,GPT)、总抗氧化能力(Total Antioxidant Capacity,T-AOC)、丙二醛(Malonaldehyde,MDA)、过氧化氢酶(Catalase,CAT)、总超氧化物歧化酶(Total Superoxide Dismutase,SOD)、脂肪酶(Lipase,LPS)和α-淀粉酶(α-Amyiase,α-AMS)10个指标,其中血清室温融化后直接进行指标测定,按照组织∶0.85%生理盐水=1∶4制成20%匀浆液,根据试剂盒测定需要在此基础上进行稀释,指标测定严格按照南京建成生物工程研究所所研制的试剂盒说明书进行。
(3)ΔL*、Δa*、Δb*值测定。养殖初始与养殖终末分别用色差仪测定红白锦鲤红斑处L*、a*、b*值。
1.5 数据分析
试验数据采用SPSS 18.0统计分析软件进行单因素方差分析(One-way ANOVA)检验各试验组间差异显著性,若差异达到显著水平(P<0.05),则进行Duncan氏法多重比较分析。试验数据以平均值±标准差(±SD)表示。
2 结果与分析
2.1 饲料不同乳酸菌水平对红白锦鲤生长指标及肝体指数的影响
饲料不同乳酸菌水平对红白锦鲤生长指标及肝体指数的影响见表1。在所有处理中,红白锦鲤增重率在Diet 1(乳酸菌水平为0.05×108cfu/g)饲料组达到最高,且显著高于其他组(P<0.05);特定生长率在Diet 1组最高,与Diet 2(乳酸菌水平为0.15×108cfu/g)、Diet 3(乳酸菌水平为 0.45×108cfu/g)组无显著性差异(P>0.05),但显著高于其他各组(P<0.05);饵料系数在Diet 2饲料组最低,与Diet 1、Diet 3饲料组差异不显著(P>0.05);Diet 2饲料组蛋白质效率显著升高(P<0.05);肝体比在Diet 4(乳酸菌水平为1.35×108cfu/g)饲料组最低,且与Diet 1、Diet 5(乳酸菌水平为4.05×108cfu/g)饲料组差异不显著(P>0.05),但显著低于其他饲料组(P<0.05)。

表1 饲料不同乳酸菌水平对红白锦鲤生长指标及肝体指数的影响
2.2 饲料不同乳酸菌水平对红白锦鲤免疫力的影响
2.2.1 饲料不同乳酸菌水平对红白锦鲤ACP活性的影响
饲料不同乳酸菌水平对红白锦鲤ACP活性的影响见表2。在所有处理中,红白锦鲤肝胰脏和血清中ACP活性在Diet 5饲料组最低,且显著低于Diet 1、Diet 2饲料组(P<0.05),但与其他饲料组差异不显著(P>0.05);红白锦鲤肾中ACP活性在Diet 4饲料组最低,且显著低于Diet 1、Diet 2饲料组(P<0.05),但与其他饲料组差异不显著(P>0.05);红白锦鲤脾中ACP活性在Diet 3饲料组最低,且与Diet 4、Diet 5饲料组差异不显著(P>0.05),但显著低于其他饲料组(P<0.05)。

表2 饲料不同乳酸菌水平对红白锦鲤ACP活性的影响
2.2.2 饲料不同乳酸菌水平对红白锦鲤AKP活性的影响
饲料不同乳酸菌水平对红白锦鲤AKP活性的影响见表3。在所有处理中,Diet 2饲料组红白锦鲤肝胰脏中AKP活性显著高于其他各组(P<0.05);中肾中AKP活性在Diet 1饲料组显著升高(P<0.05);饲料乳酸菌水平对红白锦鲤脾中AKP活性无显著性影响(P>0.05);血清中AKP活性在Diet 1饲料组最低,且与Diet 4、Diet 5饲料组差异不显著(P>0.05),但显著低于其他饲料组(P<0.05)。

表3 饲料不同乳酸菌水平对红白锦鲤AKP活性的影响
2.2.3 饲料不同乳酸菌水平对红白锦鲤GOT、GPT活性的影响
饲料不同乳酸菌水平对红白锦鲤GOT、GPT活性的影响见表4。在所有处理中,红白锦鲤肝胰脏中GOT活性在Diet 1饲料组达到最高,与Diet 2、Diet 3饲料组差异不显著(P>0.05),但显著高于其他饲料组(P<0.05);Diet 1饲料组血清中GOT活性显著高于其他各组(P<0.05)。锦鲤肝胰脏中GPT活性在Diet 1饲料组达到最高,与Diet 2饲料组差异不显著(P>0.05),但显著高于其他饲料组(P<0.05);Diet 2饲料组血清中GPT活性显著高于其他各组(P<0.05)。

表4 饲料不同乳酸菌水平对红白锦鲤GOT、GPT活性的影响
2.2.4 饲料不同乳酸菌水平对红白锦鲤T-AOC的影响
饲料不同乳酸菌水平对红白锦鲤T-AOC的影响见表5。在所有处理中,红白锦鲤肝胰脏及脾中T-AOC在Diet 1饲料组达到最高,与Diet 2饲料组没有显著差异(P>0.05),但显著高于其他饲料组(P<0.05);中肾中T-AOC在对照组最高,且显著高于其他各组(P<0.05);Diet 1饲料组红白锦鲤血清中T-AOC显著高于其他各组(P<0.05)。

表5 饲料不同乳酸菌水平对红白锦鲤T-AOC的影响
2.2.5 饲料不同乳酸菌水平对红白锦鲤MDA含量的影响
饲料不同乳酸菌水平对红白锦鲤MDA含量的影响见表6。在所有处理中,红白锦鲤肝胰脏中MDA的含量在Diet 1饲料组最低,且显著低于Diet 3、对照组(P<0.05),与其他饲料组差异不显著(P>0.05);中肾中MDA的含量在Diet 1饲料组最低,与Diet 2、Diet 3饲料组差异不显著(P>0.05),但显著低于其他饲料组(P<0.05);脾中MDA的含量在Diet 2饲料组最低,与Diet 3饲料组差异不显著(P>0.05),但显著低于其他饲料组(P<0.05);血清中MDA的含量在Diet 2饲料组达到最低,且与Diet 1、Diet 4饲料组差异不显著(P>0.05),但显著低于其他饲料组(P<0.05)。

表6 饲料不同乳酸菌水平对红白锦鲤MDA含量的影响
2.2.6 饲料不同乳酸菌水平对红白锦鲤CAT活性的影响
饲料不同乳酸菌水平对红白锦鲤CAT活性的影响见表7。在所有处理中,红白锦鲤脾中CAT活性在Diet 2饲料组达到最高,且显著高于其他饲料组(P<0.05);中肾中CAT活性在Diet 2饲料组达到最高,与Diet 1饲料组差异不显著(P>0.05),但显著高于其他饲料组(P<0.05);血清中CAT活性在Diet 1饲料组达到最高,与Diet 2饲料组差异不显著(P>0.05),但显著高于其他饲料组(P<0.05)。

表7 饲料不同乳酸菌水平对红白锦鲤CAT活性的影响
2.2.7 饲料不同乳酸菌水平对红白锦鲤SOD活性的影响
饲料不同乳酸菌水平对红白锦鲤SOD活性的影响见表8。在所有处理中,红白锦鲤肝胰脏中SOD活性在Diet 2饲料组达到最高,且显著高于其他饲料组(P<0.05);中肾SOD活性在Diet 2饲料组达到最高,且显著高于Diet 3、对照组(P<0.05);脾中SOD活性在Diet 1饲料组达到最高,显著高于Diet 5饲料组(P<0.05),但与其他饲料组差异不显著(P>0.05)。

表8 饲料不同乳酸菌水平对红白锦鲤SOD活性的影响
2.3 饲料不同乳酸菌水平对红白锦鲤消化酶活性的影响
2.3.1 饲料不同乳酸菌水平对红白锦鲤LPS活性的影响
饲料不同乳酸菌水平对红白锦鲤LPS活性的影响见表9。在所有处理中,红白锦鲤肝胰脏及中肾LPS活性在Diet 2饲料组最高,与Diet 5饲料组无显著差异(P>0.05),但显著高于其他各组(P<0.05);Diet 2饲料组红白锦鲤脾中LPS活性显著高于对照组(P<0.05),血清中LPS活性显著高于其他各组(P<0.05);肠中LPS活性在Diet 2饲料组最高,且显著高于Diet 1及Diet 3饲料组(P<0.05)。

表9 饲料不同乳酸菌水平对红白锦鲤LPS活性的影响
2.3.2 饲料不同乳酸菌水平对红白锦鲤α-AMS活性的影响
饲料不同乳酸菌水平对红白锦鲤α-AMS活性的影响见表10。在所有处理中,红白锦鲤肝胰脏、中肾、肠及血清中α-AMS活性在Diet 2饲料组达到最高,且显著高于其他饲料组(P<0.05);脾中α-AMS活性在Diet 1饲料组达到最高,与Diet 2饲料组差异不显著(P>0.05),但显著高于其他饲料组(P<0.05)。
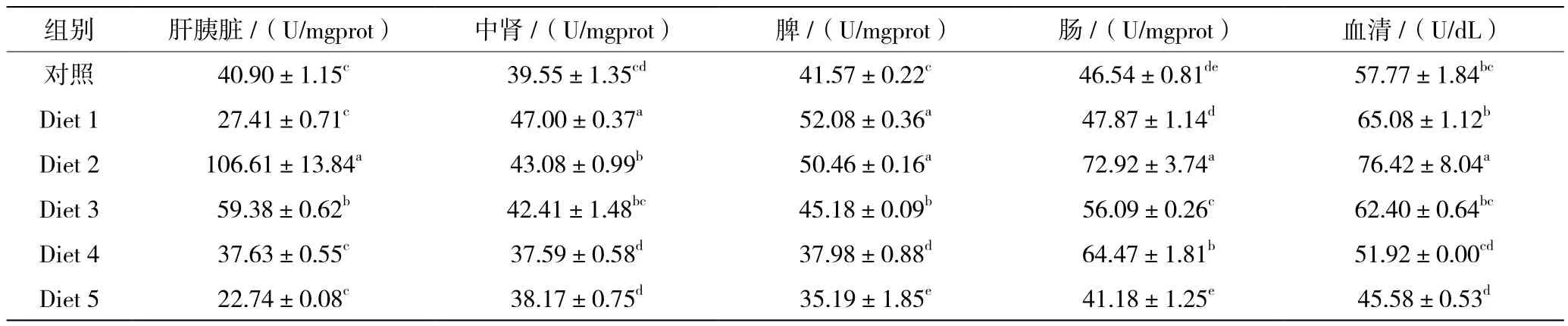
表10 饲料不同乳酸菌水平对红白锦鲤α-AMS活性的影响
2.4 饲料不同乳酸菌水平对红白锦鲤体色的影响
饲料不同乳酸菌水平对红白锦鲤体色的影响见表11。在所有处理中,红白锦鲤ΔL*值、Δb*值在Diet 1饲料组达到最高,显著高于其他饲料组(P<0.05);Δa*值在Diet 3饲料组达到最高,与Diet 1饲料组差异不显著(P>0.05),但显著高于其他饲料组(P<0.05)。

表11 饲料不同乳酸菌水平对红白锦鲤体色的影响
3 讨论
3.1 饲料不同乳酸菌水平对红白锦鲤生长性能的影响
乳酸菌可以产生多种酶以分解不易吸收的大分子量蛋白质,使水产动物的营养得到保证,同时可以降解饲料消化过程中产生的抗营养因子,提高动物的摄食率,在养殖水体中泼洒乳酸菌亦可有效提高幼鱼的运动和摄食能力[2]。赵倩等[3]研究表明,添加乳酸菌可以促进草鱼的生长,降低饵料系数,提高饲料利用率,同时增加其肥满度。史东杰等[4]研究证明,添加含有乳酸菌的微生态制剂对锦鲤的生长有促进作用,增重率与特定生长率均显著增加,且饵料系数显著降低。SON等[5]研究证明,将乳酸菌添加到石斑鱼饲料中投喂28 d后,石斑鱼的增重率以及蛋白质效率显著提高。以上试验结果均与本试验结果相似,证明在饲料中添加不同水平的乳酸菌可以促进红白锦鲤的生长,并降低饵料系数。相同的研究结果也见于石斑鱼、草鱼的研究中[6-7]。
3.2 饲料不同乳酸菌水平对红白锦鲤免疫指标的影响
目前,乳酸菌已经被大量应用于水产养殖业中,其主要是通过乳酸菌菌体或其他代谢产物对肠道黏膜免疫的作用来在水产动物体内发挥免疫增强作用。王永胜等[8]研究发现,使用乳酸菌饲喂凡纳滨对虾可使其血清、肌肉及肝脏中的SOD、AKP活性显著高于对照组。王之怡等[9]研究了乳酸乳球菌Q-9胞外多糖对AKP、T-AOC、T-SOD、CAT活性及MDA含量的影响,发现鲤鱼的AKP活性、MDA含量显著降低,而T-AOC、T-SOD、CAT得到显著提升。关素华等[10]采用拥挤试验来研究德式乳酸杆菌对黄河鲤抗应激能力的影响,发现添加乳酸菌组的黄河鲤在应激前后SOD和CAT均显著高于对照组,而MDA含量显著降低。曾庆辉等[11]用德氏乳酸菌含量分别为0 cfu/g、1×105cfu/g、1×106cfu/g、1×107cfu/g和 1×108cfu/g的饲料饲喂黄河鲤,发现当乳酸菌含量为1×106~1×107cfu/g时黄河鲤皮肤黏液中AKP、SOD、CAT、T-AOC活性均显著高于对照组,同时MDA含量显著降低。郑玉[6]发现在饲料中加入适量的乳酸菌可以显著提高棕点石斑鱼以及凡纳滨对虾体内ACP和AKP的活性。本试验测定了红白锦鲤组织及血清中ACP、AKP、GOT、GPT、T-AOC、MDA、CAT和SOD八个指标,发现乳酸菌添加量为0.05×108~0.15×108cfu/g时,红白锦鲤免疫指标达到最佳。
3.3 饲料不同乳酸菌水平对红白锦鲤消化酶活性的影响
消化酶是鱼体消化过程的重要代谢酶,其中脂肪酶和淀粉酶分别代表了鱼体对脂肪及糖类的消化利用能力。王颖等[7]研究发现在草鱼饲料中添加2%富含枯草芽孢杆菌、乳酸菌及酵母菌的微生态制剂可以显著提高草鱼中肠淀粉酶和脂肪酶活性,并且可以丰富肠道菌群种类,提高有益菌数量;林艾影等[12]研究发现,乳酸菌可以显著提高军曹鱼幼鱼肠道内α-AMS及LPS的活性,这与本试验结果相同。现有的乳酸菌对养殖动物消化酶活性及肠道菌群影响的研究多集中于肉鸡等食用动物,在水产品养殖方面的研究较少,其相关作用机理还需进一步研究。
3.4 饲料不同乳酸菌水平对红白锦鲤体色的影响
体色是反映红白锦鲤外表是否美观的重要指标,但有关于乳酸菌对动物体色的影响还未见报道。本试验研究发现,在乳酸菌添加量为0.05×108cfu/g时,红白锦鲤各色度值均显著高于其他试验组,因此红白锦鲤饲料中乳酸菌的建议添加量为0.05×108cfu/g。
4 结论
在本试验条件下,由试验结果可得出以下结论。(1)乳酸菌的添加量为0.05×108~0.15×108cfu/g时,红白锦鲤生长指标达到最佳,在该添加量下可提高红白锦鲤增重率、蛋白质效率及特定生长率,同时降低饵料系数,促进了红白锦鲤的增长。(2)乳酸菌的添加量为0.05×108~0.15×108cfu/g时,红白锦鲤免疫指标达到最佳,提高了红白锦鲤的抗氧化能力。(3)乳酸菌的添加量为0.15×108cfu/g时,红白锦鲤组织及血清中消化酶活性显著提高。(4)乳酸菌的添加量为0.05×108cfu/g时红白锦鲤红斑处ΔL*、Δb*值最高,添加量为0.45×108cfu/g时红白锦鲤红斑处Δa*值最高,但与0.05×108cfu/g无显著差异。
综上所述,在本试验条件下,红白锦鲤饲料中乳酸菌的最适添加量为0.05×108~0.15×108cfu/g。

