温莪术药渣再提取工艺及其美白活性研究
夏 禹,张文珍,黄 真,仇凤梅,钟晓明
浙江中医药大学药学院,杭州 310053
温莪术为姜科姜黄属植物温郁金CurcumawenyujinY.H.Chen et C.Ling的干燥主根茎[1],有抗氧化、抗炎抑菌[2]、抗风湿、抗肿瘤[3]、改善免疫系统功能[4]、抗病毒[5]等多种药理作用,是具有广泛应用价值的传统中药。温莪术主要成分为挥发油、姜黄素类、多糖类、酚酸类和生物碱类化合物[6],其中挥发油占1%~2.5%,是温莪术主要药效物质之一,目前已被提取制剂应用于临床。但是,许多制药工厂在提取温莪术油多采用水蒸气蒸馏法,而此法在提取挥发油时效率较低,导致提油后大量的温莪术药渣堆积,且因其暂无有效利用途径、处理成本高等原因,每年只能将成百上千吨的药渣当做废弃物丢弃,严重造成资源浪费和环境污染。而有学者[7,8]对温莪术经水蒸气蒸馏法提取挥发油所剩药渣的化学成分进行分析,发现温莪术药渣中仍含有多种姜黄素类化合物、莪术二酮等活性成分。而姜黄素类化合物已被证实具有抗菌、抗氧化、美白等生物活性[9-11],这说明温莪术药渣的二次开发利用仍有非常大的可行性。
温郁金提取物目前已收录于2021年版《已使用化妆品原料名称目录》,然而却未见其在化妆品领域的相关研究文献报道。美白作为化妆品最常见的功效宣称之一,近年来也逐渐受到人们的追捧[12],而皮肤颜色主要是由黑色素决定的。当细胞受到内源性(如α-MSH)刺激物作用时,会通过多种信号通路诱导小眼畸形相关转录因子(MITF)的表达,从而激活酪氨酸酶,促进黑色素的生成。另外,活性氧(ROS)也在黑色素生成过程中起到十分重要的作用,ROS是酪氨酸酶催化氧化过程中的引发剂和反应物,通过相关蛋白的作用诱导黑色素合成基因的表达,导致黑色素含量的升高[13]。故抑制酪氨酸酶活性、抗氧化是目前公认美白的两个关键靶点。
因此,本研究旨在挖掘温莪术药渣在化妆品领域上的潜在价值,以其美白活性成分总姜黄素得率为指标,利用响应面法优化温莪术药渣的最佳提取工艺,同时考察最佳提取工艺条件下温莪术药渣提取物对DPPH、ABTS自由基清除作用和大鼠黑色素瘤B16细胞黑色素合成及酪氨酸酶活性的影响。为扩大温莪术植物资源的利用及其在化妆品领域应用的开发提供科学依据,并促进各行业二次开发利用中药渣资源,从而推动地方经济及产业的进一步发展。
1 材料与方法
1.1 材料与试剂
实验用温莪术药渣于浙江省瑞安市通明温郁金专业合作社购买。姜黄素对照品(批号:S19245-5 g,杭州高晟生物科技有限公司);DPPH(批号:GC19475-100 mg,南京翼飞雪生物科技有限公司);ABTS(批号:S30629-250 mg,北京酷尔化学科技有限公司);熊果苷标准品(批号:PS0213-25 mg,成都普思生物科技股份有限公司);甲醇(批号:M116121-500 mL,杭州邦易化工有限公司);二甲基亚砜(批号:D103271-5 mL,杭州邦易化工有限公司);MTT(批号:KGT5251-1 g,杭州昊天生物技术有限公司);DMEM培养基(批号:C11960500BT-500 mL,厦门辉耀兴业科技有限公司);胎牛血清(批号:S9030-500 mL,北京拜尔迪生物技术有限公司);TritonX-100(批号MB2486-1 g,大连美仑生物技术有限公司);L-DOPA(批号:HY-N0304-1 g,杭州昕诚生物科技有限公司);小鼠黑色素瘤细胞(批号:SCC-211111,北京拜尔迪生物技术有限公司);胰酶(批号:P816199-50g,上海麦克林生化科技有限公司);PBS(BL302A-500 mL,广州赛国生物科技有限公司);水为超纯水;其他化学试剂均为分析纯。
1.2 仪器与设备
电子天平(型号:AL104,梅特勒-托利多仪器(上海)有限公司);旋转蒸发仪(型号:RE-52AA,上海亚荣生化仪器厂);数显鼓风干燥箱(型号:DHG-9240A,上海帅登仪器有限公司);恒温水浴锅(型号:HH-8,上海宜昌仪器纱筛厂);紫外可见分光光度计(型号:UV-1800,杭州宗灿科技有限公司);酶标仪(型号BLX-800,美国伯腾仪器有限公司);二氧化碳培养箱(型号:Thermo 3111,美国赛默飞世尔科技公司)。
1.3 温莪术药渣总姜黄素类化合物含量测定[14-16]
1.3.1 对照品溶液制备
精密称取姜黄素对照品1.0 mg,加入甲醇定容至10 mL,即得浓度为0.1 mg/mL的对照品溶液。
1.3.2 检测波长的选择[24]
将姜黄素对照品用甲醇稀释10倍后置于比色皿中,以甲醇溶液作为空白对照,在200~800 nm紫外波长下扫描对照品溶液发现其在423 nm处有一最大吸收峰(如图1),故选用该波长测定温莪术药渣总姜黄素吸光度。
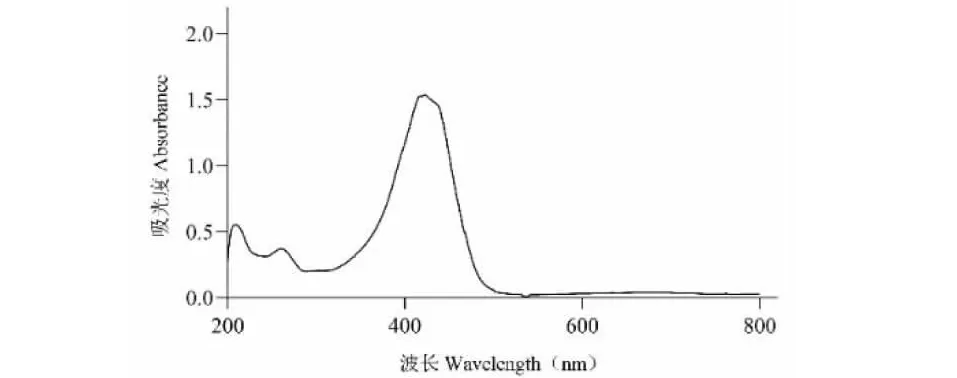
图1 姜黄素对照品紫外扫描图谱Fig.1 UV scanning spectrum of curcumin reference substance
1.3.3 方法学考察
精密吸取姜黄素对照品溶液0.1、0.3、0.5、0.7、0.9、1.1 mL。分别加入到10 mL的容量瓶中,再用甲醇定容,震荡摇匀。测定方法:以甲醇为空白对照,采用紫外可见分光光度计测量各溶液423 nm处的吸光度。以吸光度(A)对姜黄素质量(X)进行回归,得到回归方程A=164.43X+0.169(r=0.999 4),在0.010 6~0.106 mg/mL范围内线性关系良好。精密度、重复性、稳定性试验RSD分别为0.84、1.83、1.76%;加样回收率为97.76%,RSD为1.68%(n=9)。
1.3.4 样品总姜黄素含量测定
将温莪术药渣经烘干研磨后过50目筛,得到温莪术药渣粉末,精密称取1.0 g,加入20 mL的60%乙醇溶液,超声提取30 min,抽滤两次后减压回收溶剂,挥干得到的提取物干品,用甲醇复溶,并定容至100 mL的容量瓶备用,按照“2.1.3”项下测定并计算溶液中总姜黄素浓度,按式(1)计算其得率。

(1)
其中,总姜黄素得率单位为mg/mL,C为根据标准曲线计算溶液中总姜黄素的质量浓度(mg/mL);d为稀释倍数;V为定容体积(mL);M为称取样品的质量(g)。
1.4 温莪术药渣提取工艺优化
1.4.1 单因素试验
实验基础条件设置为:超声提取温度控制在20±1 ℃,液料比20 mL/g,60%乙醇浓度,超声提取30 min。因素考察设计如下:液料比(10~30 mL/g);乙醇浓度(50%~90%);超声持续时间(20~60 min)。每组各五个梯度,重复三次实验,考察三个因素对温莪术药渣总姜黄素提取得率的影响。
1.4.2 响应面法优化实验
参考文献方法[17,18]并修改,响应面实验通过Design-Expert 8.0.6软件进行模型的建立与分析,根据单因素试验结果,选择合适的三因素三水平,并以总姜黄素得率作为评价指标,共得到17个试验,每项试验重复三次。最后,按照模型拟合得出的总姜黄素得率最高的工艺条件进行验证,对比测得的实际得率与理论值的差异,验证实验的准确性。
1.5 DPPH、ABTS自由基清除率测定
参考文献方法[19]将温莪术药渣提取物和阳性对照VC溶于乙醇溶液,均配成浓度为1、2、4、8、16、32、64 μg/mL的待测溶液备用。避光环境下称取DPPH、ABTS粉末,参照文献方法[18]配成0.06 mmol/L的DPPH乙醇溶液和ABTS贮备液,将不同浓度的待测溶液依次加入到DPPH乙醇溶液和ABTS贮备液中,避光反应20 min,分别于517 nm和734 nm测定吸光度,重复三次,并按照式(2)计算清除率。
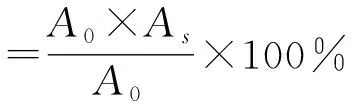
(2)
其中,A0是用空白试剂和DPPH乙醇溶液或ABTS贮备液混合后得到的溶液的吸光度,AS是用供试品溶液和DPPH乙醇溶液或ABTS贮备液混合后得到的溶液的吸光度。
1.6 B16细胞培养
细胞培养参考文献方法[20,21]并改进,将B16细胞接种于含有10%胎牛血清的DMEM培养基的培养瓶中,于37 ℃,5%CO2恒温恒湿培养箱中培养,每24 h于倒置显微镜下观察细胞生长状态,当细胞贴壁生长至近融合状态时(铺满瓶底80%~90%),弃去瓶内培养液,用PBS冲洗2次,加入1 mL预温至37 ℃的0.25%胰酶,于培养箱内进行消化反应2 min,加培养液中止反应,离心处理分离后,将细胞传代至25 cm2培养瓶中,加入含10%胎牛血清的DMEM培养基,于培养箱中继续培养,重复以上操作可培养至第10代。
1.7 实验分组
取对数生长期的B16细胞,调整细胞浓度为4×105个/mL,接种于96孔板,每孔100 μL(空白组不接种B16细胞),于培养箱培养24 h后,小心吸去各孔上清液,按如下实验分组进行给药:正常对照组(normal control,NC)与空白组均加入不含药DMEM培养基;阳性对照组(positive control,PC)加入含浓度为100 μg/mL熊果苷的DMEM培养基;实验组分别加入含浓度为50、100、200、400、800、1 600 μg/mL温莪术药渣提取物的DMEM培养基,每组设置6个复孔,培养48 h。
1.8 MTT法测定温莪术药渣提取物对B16细胞存活率的影响
按“1.7”法分组给药培养B16细胞48 h后,各孔重新加入新的DMEM培养基100 μL,随后依次加入20 μL预先配置好浓度为5 mg/mL的MTT溶液,培养4 h。随后将96孔板内上清液弃去,各孔重新加入150 μL DMSO溶液,震荡10 min,立即置酶标仪下测定其在490 nm波长下的OD值,重复三次。按式(3)计算细胞存活率

(3)
1.9 黑色素含量测定
取对数生长期的B16细胞经胰酶消化后,调整细胞浓度为4×105个/mL,接种于24孔板中培养24 h后,按照“1.7”下实验分组依次处理,每组设置3个平行实验,培养48 h后,收集各孔浓度约2×105个/mL的B16细胞,加入1 mol/L NaOH溶液400 μL,100℃孵育30 min,裂解细胞并让细胞内黑色素溶出,离心,取100 μL上清液至96孔板中,于酶标仪450 nm波长下测定OD值。按照式(4)求得黑色素含量。

(4)
其中,n为实验组细胞数量。
1.10多巴氧化法测定B16细胞酪氨酸酶活性
B16细胞酪氨酸酶活性参考文献方法[22]采用多巴氧化法测定,首先提前配制好1% TritonX-100溶液和0.1% L-DOPA溶液备用,按“1.7”法下分组给药培养B16细胞48 h后,将96孔板上清液弃去,每孔依次加入100 μL TritonX-100溶液,在-80 ℃温度下冻存1 h,而后室温下使其融化裂解,每孔依次加0.1% L-DOPA 100 μL,于37 ℃培养箱2 h,置酶标仪下测定其在490 nm处OD值。重复三次,按式(5)计算细胞酪氨酸酶活性。

(5)
1.11数据统计
实验结果运用Design Expert 8.0.6软件进行响应面设计及分析,GraphPad Prism 6.0.2软件进行相关图表的绘制,SPSS 20.0软件进行数据处理。
2 结果
2.1 单因素试验
2.1.1 乙醇浓度对提取得率的影响
实验结果如图2A所示。从图中可以看出,总姜黄素提取得率在乙醇浓度为50~80%时逐渐上升,80%时达到最高,而后有所降低,因此选用乙醇浓度70、80、90%进行后续响应面实验。
2.1.2 超声时间对提取得率的影响
实验结果如图2B所示。从图中可以看出,超声时间在20~50 min时,总姜黄素得率逐渐提升,随后有所降低,因此选取超声时间40、50、60 min进行后续响应面实验。
2.1.3 液料比对提取得率的影响
实验结果如图2C所示。从图中可以看出,当液料比为20 mL/g时,总姜黄素得率最高,而后总姜黄素得率逐渐降低,因此选择15、20、25 mL/g这三个水平进行后续的响应面实验。
2.2 响应面实验结果与分析
以总姜黄素得率作为响应值(Y),得到的响应面实验设计方案如表1和表2所示。
实验结果利用Design Expert 8.0.6软件对表2实验数据进行回归分析,软件拟合得到的响应面三维图如图3所示,获得响应面方差分析及显著性结果如表3所示。
由表3方差分析得出,响应面实验模型P< 0.01,说明实验模型具有统计学意义并且该模型的拟合度良好(失拟项P> 0.05)。因素A、B、C、AB、BC、A2、B2、C2对总姜黄素得率均具有极显著影响(P< 0.001)。以总姜黄素得率为响应值(Y),得到总姜黄素得率对各影响因素的二项多项式回归模型为:Y=6.35+0.090×A+0.091×B+0.22×C+0.090×AB-0.015×AC+0.11×BC-0.34×A2-0.20×B2-0.39×C2。各因素对温莪术药渣总姜黄素的得率影响程度依次为液料比(C)>乙醇体积分数(A)>超声时间(B)。

表1 响应面试验因素水平设计Table 1 Factors and levels of response surface analysis
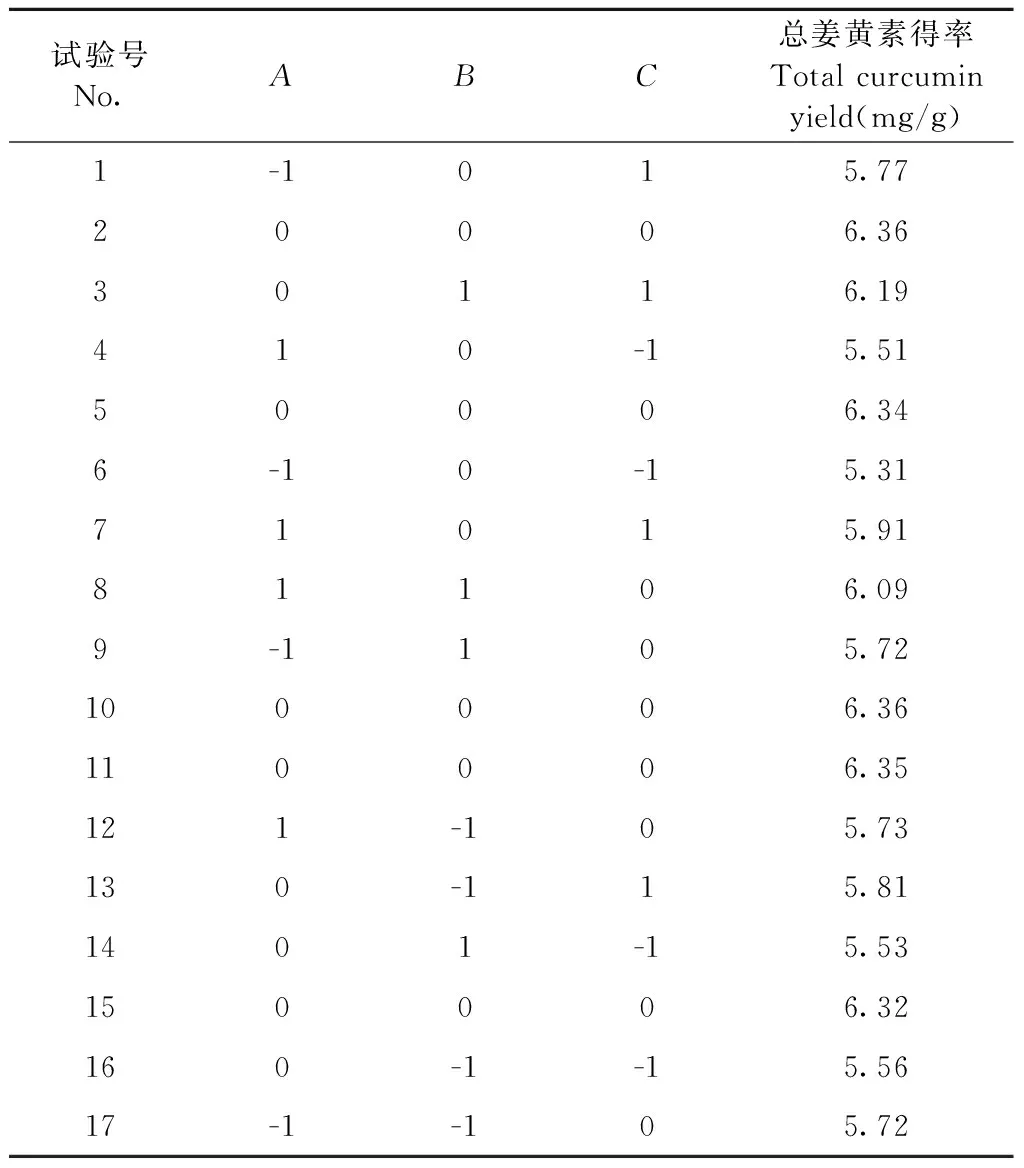
表2 试验设计与结果Table 2 Design and results of tests
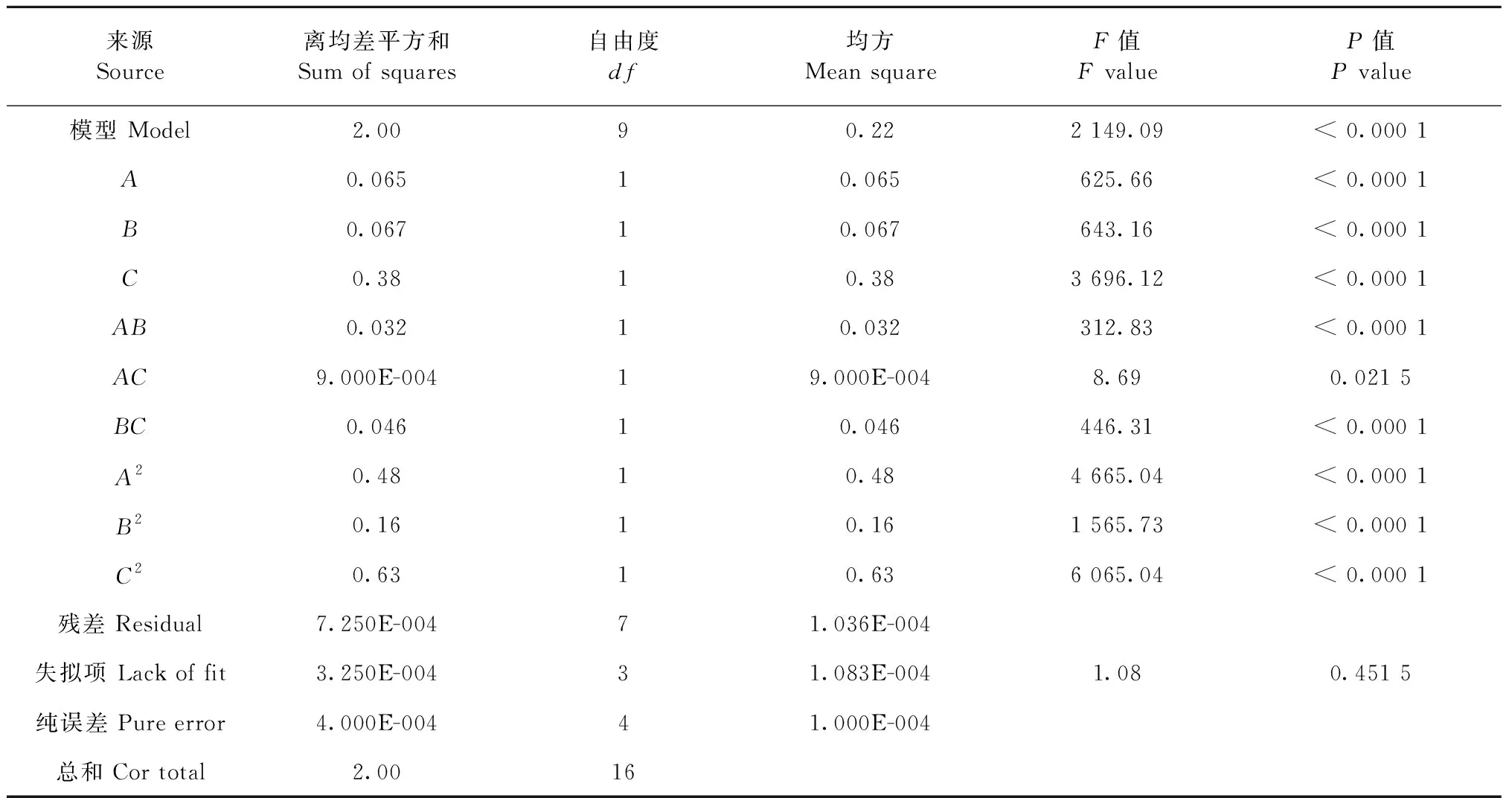
表3 响应面方差分析Table 3 The response surface analysis of variance(ANOVA)

图3 各因素响应面图Fig.3 Response surface plots for various factors
根据回归模型求解方程得出最优提取工艺为液料比21.65 mL/g,乙醇浓度81.78%,超声时间53.74 min,模型预测在该实验条件下总姜黄素得率为6.41 mg/g,为了便于实验实际操作,验证实验以液料比22 mL/g,乙醇体积分数82%,超声时间55 min为条件,并重复3次实验再次进行提取,最终测得总姜黄素得率为6.38±0.02 mg/g,与预测值6.41 mg/g接近,与未优化所得5.46 mg/g比较提升14.42%,表明工艺合理稳定,可为后续重复实验提供参考依据。
2.3 体外抗氧化活性实验
DPPH自由基清除实验结果可见图4A。温莪术药渣提取物对DPPH自由基的清除率随着浓度的增加而提高,在浓度为32 μg/mL时,清除率达到88.23%,随后趋于平缓,IC50为24.99 μg/mL。ABTS自由基清除实验结果可见图4B。由此可知,温莪术药渣提取物对ABTS自由基的清除率也是随着浓度的增加而升高,存在一定量效关系。温莪术药渣提取物对ABTS自由基的清除率在64 μg/mL处接近100%,IC50值为49.72 μg/mL。以上均说明温莪术药渣提取物具有良好的体外抗氧化作用。
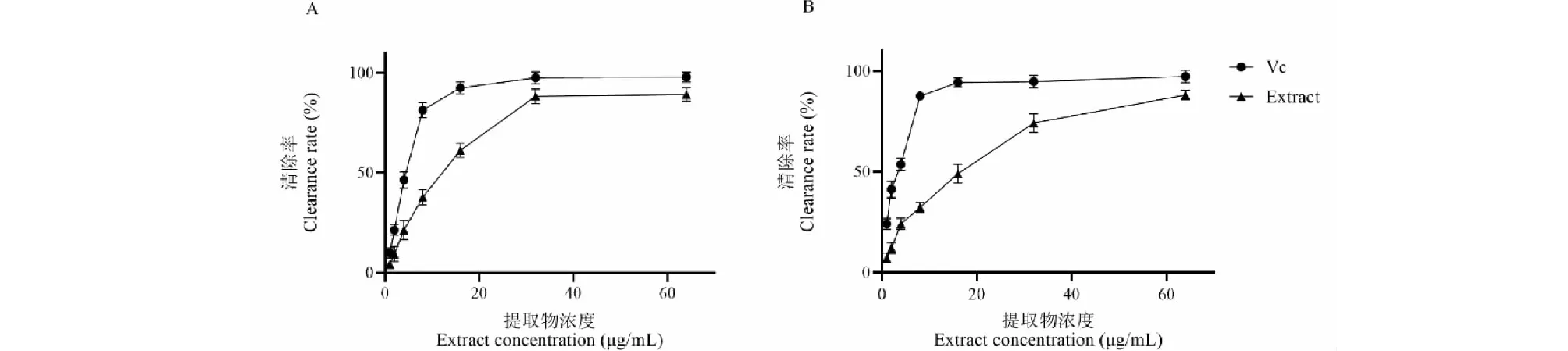
图4 不同浓度提取物对DPPH、ABTS自由基清除率Fig.4 Clearance rates of extracts with different concentrations on DPPH and ABTS free radicals
2.4 小鼠黑色素瘤B16细胞实验结果
2.4.1 不同浓度温莪术药渣提取物对B16细胞存活率的影响
MTT结果显示如图5,当温莪术药渣提取物浓度在50~800 μg/mL时,对细胞存活率的影响与正常对照组没有显著性差异,当浓度达到1 600 μg/mL时,细胞存活率显著下降至80%以下,并且与正常组差异显著(P< 0.001)。为控制B16细胞凋亡对实验的影响,因此温莪术提取物对B16细胞的安全给药浓度范围为50~800 μg/mL,选用该浓度范围进行后续实验。
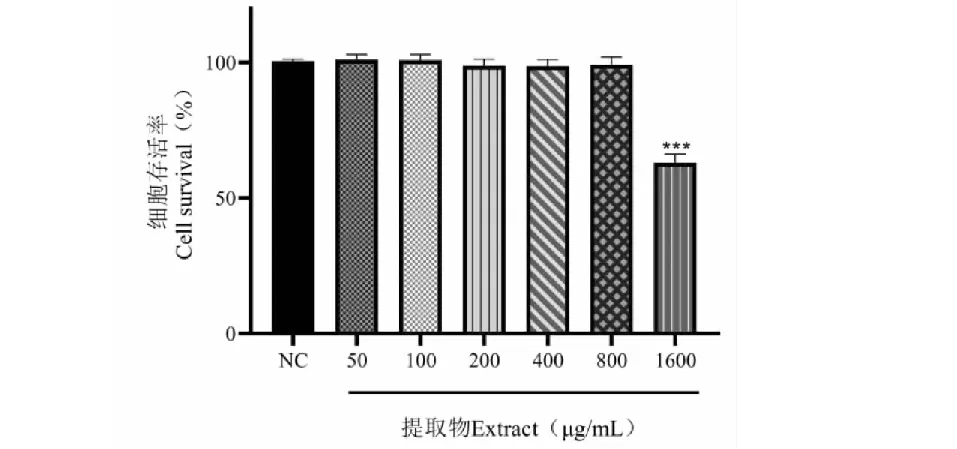
图5 不同浓度提取物对B16细胞存活率的影响Fig.5 Effects of different concentrations of extracts on survival rate of B16 cells注:与正常对照组比较,***P < 0.001。Note:Compared with normal control,***P < 0.001.
2.4.2 不同浓度温莪术药渣提取物对B16细胞黑色素合成的影响
由图6可得,不同浓度的温莪术药渣提取物对黑色素瘤B16细胞黑色素合成均具有一定的抑制作用,并且呈一定的浓度依赖性,各实验组与正常对照组相比,均具有统计学差异(P< 0.05),细胞给药处理48 h后,400、800 μg/mL温莪术药渣提取物实验组与正常对照组相比具有极显著差异(P< 0.001),两组的黑色素含量仅为正常对照组的64.94%和41.78%,其中800 μg/mL实验组抑制黑色素生成作用优于阳性对照组熊果苷,且具有统计学差异(P< 0.05)。
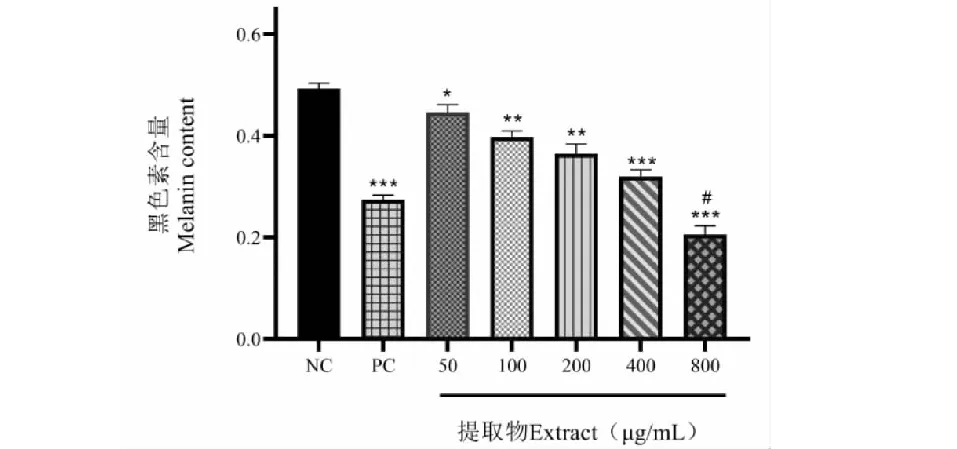
图6 不同浓度提取物对B16细胞黑色素合成的影响Fig.6 Effects of different concentrations of extracts on melanin synthesis in B16 cells注:与正常组比较,*P < 0.05,**P < 0.01,***P < 0.001。与阳性对照组比较,#P < 0.05。Note:Compared with normal control,*P < 0.05,**P < 0.01,***P < 0.001.Compared with positive control,#P < 0.05.
2.4.3 不同浓度温莪术药渣提取物对B16细胞酪氨酸酶活性的影响
由图7可知,与正常组相比,阳性对照组及实验组的酪氨酸酶活性均显著降低(P< 0.05),其中400 μg/mL的温莪术药渣提取物实验组与阳性对照组的酪氨酸酶活性分别为60.98%和61.12%,根据数据分析得出两组没有显著性差异(P> 0.05),说明温莪术药渣提取物抑制酪氨酸酶活性的作用约为熊果苷的四分之一。并且温莪术药渣提取物抑制酪氨酸酶活性的作用随着浓度升高而逐渐增强,与黑色素含量试验结果一样存在量效关系(如图8),在浓度为800 μg/mL时温莪术药渣提取物对B16细胞酪氨酸酶活性抑制率达到最大值51.87%,与阳性对照组相比,具有统计学差异(P< 0.05)。因此,推测温莪术药渣提取物可能是通过抑制B16细胞中酪氨酸酶活性或其相关激活通路,进而发挥限制黑色素B16细胞中黑色素合成的作用。

图7 不同浓度提取物对B16细胞酪氨酸酶活性的影响Fig.7 Effects of different concentrations of samples on tyrosinase activity in B16 cells注:与正常组比较,*P < 0.05,**P < 0.01,***P < 0.001。与阳性对照组比较,#P < 0.05。Note:Compared with normal control,*P < 0.05,**P < 0.01,***P < 0.001.Compared with positive control,#P < 0.05.
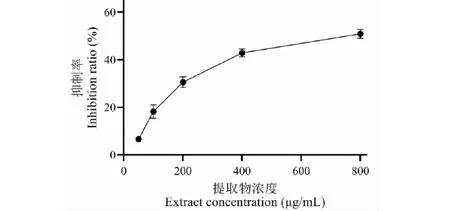
图8 提取物对B16细胞酪氨酸酶的抑制率Fig.8 Inhibition rate of the extract on B16 cell tyrosinase
3 讨论与结论
采用响应面法优化后温莪术药渣提取物的最佳提取工艺为液料比22 mL/g,82%乙醇超声提取,超声时间55 min,得到总姜黄素平均得率为6.38 mg/g。该工艺条件简单,操作方便且稳定,可为温莪术提取挥发油后剩余药渣中姜黄素类化合物的二次利用提供参考。
此外,以最佳工艺提取制备的温莪术药渣提取物具有良好的清除DPPH、ABTS自由基作用,其IC50值分别为24.99、49.72 μg/mL。细胞实验的结果显示,50~800 μg/mL各浓度温莪术药渣提取物实验组均能够有效减少黑色素瘤B16细胞黑色素的含量以及抑制酪氨酸酶活性。
姜黄素类化合物在酸性及中性环境中性质比较稳定,并且易溶于有机溶剂但是不易溶于水[23]。传统回流提取姜黄素类化合物的方法耗时、提取率低并且不利于保证姜黄素类化合物的生物活性[24],同时姜黄素类化合物含量的检测方法也较为复杂,故本实验通过改良文献方法[25]采用紫外分光光度法测定总姜黄素类化合物的方法,研究不同液料比、乙醇浓度、超声时间对其得率的影响,并通过响应面模型优化提取工艺。优化后使温莪术药渣中总姜黄素的提取率提高了14.42%。该方法稳定可行,重复性好,也为温莪术残渣中姜黄素类化合物的提取工艺优化、测定及二次利用提供了理论依据。
DPPH法及ABTS法为两大常用的体外抗氧化评价试验,广泛用于评价植物提取物的抗氧化性能[19]。本实验发现温莪术药渣提取物在抗氧化方面显示出良好的作用,并通过细胞实验进一步验证发现其对黑色素生成及其关键限速酶酪氨酸酶活性的抑制作用良好。后续可以更加深入地研究温莪术药渣提取物在细胞、分子水平上的美白机制或进行分离纯化得到更安全有效的抗氧化剂或酪氨酸酶抑制剂,为温莪术药渣的开发提供科学理论依据。
随着中药行业的迅猛发展,在生产中也导致中药渣的大量产生,秉着我国绿色可持续发展和资源再利用理念,中药渣也逐渐成为近年来研究的热点,目前中药渣已被广泛用作饲料、添加剂、燃料、吸附剂及肥料等[26,27],具有很大的开发潜力。因此,本实验也为加快各行业对中药渣资源的二次开发利用、实现中药渣可持续利用奠定基础。

