苍附导痰汤对PCOS大鼠卵巢细胞线粒体调节机制研究
李 威 陈 静 樊锐锋 匡洪影 徐邱鸿 潘紫萌
多囊卵巢综合征(polycystic ovary syndrome,PCOS)属中医 “闭经”、“不孕”范畴,对中医证候成因的研究表明,线粒体功能异常可能是“脾失运化,聚湿成痰”的生物学基础[1,2]。PCOS患者的卵巢中ROS水平异常升高、线粒体DNA拷贝数降低,提示PCOS患者卵巢细胞功能变化可能与线粒体活性的改变相关[3]。PCOS患者卵巢组织存在磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)信号通路异常,而PI3K通路及其下游的哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是细胞调节线粒体活性关键机制之一[4]。这预示着胰岛素信号通路的异常也可能影响细胞的线粒体功能。
中药“苍附导痰汤”能治疗PCOS患者生殖及代谢异常表现,而且能通过调节PI3K/mTOR信号通路降低PCOS大鼠的胰岛素抵抗指数及血清睾酮水平[5,6]。笔者推测该方剂的疗效机制很可能与其对细胞线粒体活性的调节有关。本研究应用苍附导痰汤对PCOS模型大鼠进行干预治疗,并应用慢病毒包被的mTOR基因的shRNA表达载体进行卵巢原位注射,观察关键因子表达水平的改变对中药疗效的影响,为阐明PCOS的可能病因及中药复方疗效机制提供证据支持。
材料与方法
1.实验材料:(1)实验动物:体质量为50±5g的清洁级雌性23 日龄SD 大鼠购自黑龙江中医药大学动物实验中心,实验动物许可证号[SCXK(黑)2013-001]。饲养于12h 昼夜交替环境下,自由摄取食水。实验过程中对大鼠的操作均按照黑龙江中医药大学实验动物使用与医学伦理学委员会标准执行,符合动物福利的基本原则。(2)主要试剂:实验用“苍附导痰汤”由苍术、香附、半夏、陈皮、茯苓、胆南星、枳壳、生姜、炙甘草组成,组方中药购自广州康美药业股份公司,煎煮浓缩至1.81g/ml生药;抗体P110、AKT、mTOR、Drp-1、Fis-1、Mfn-1购自英国Abcam公司,抗体β-actin购自美国Santa Cruz公司;慢病毒包被的mTOR shRNA序列及scramble序列表达载体的慢病毒购自上海基凯生物公司,效价均为1×109TU/ml,其中载体自身携带的绿色荧光蛋白(green fluorescent protein,GFP)序列与所表达的mTOR siRNA序列或scramble序列为非融合表达。大鼠mTOR shRNA序列及相对应的scramble序列参考已发表的文献[7]。TUNEL染色试剂盒及Mito-Tracker Red CMXRos购自上海碧云天公司。
2.实验方法:(1)实验动物分组及模型构建:共25只实验大鼠除对随机选出的对照组大鼠(5只)每日给予0.2ml大豆油颈背部皮下注射外,其余实验动物均给予使用大豆油配制的6.0mg/100g DHEA,0.2ml颈背部皮下连续注射21天。按照本课题组已发表的PCOS大鼠模型评估方法随机选取3只大鼠进行模型评估后,构建模型成功的大鼠随机分为模型组(n=5)、中药治疗组(n=6)及ShRNA注射组(n=6)[8]。(2)表达载体卵巢局部注射:实验大鼠经1%戊巴比妥麻醉,于背部开口暴露卵巢。使用微量进样器抽取10μl病毒原液注射入卵巢包膜中:对照组、模型组及中药治疗组注射Lenti-GFP-mTOR shRNA scramble序列表达载体,shRNA干涉组注射Lenti-GFP-mTOR shRNA表达载体。(3)中药治疗:根据实验动物药物用量的换算公式,在卵巢局部注射慢病毒包被载体后,中药治疗组及shRNA干涉组给予每次1.5ml苍附导痰汤浓缩药物、对照组及模型组大鼠使用1.5ml 0.9%NaCl注射液每天灌胃2次,连续灌胃治疗15天。(4)卵巢组织切片:实验大鼠眶静脉丛采血后断颈处死,部分卵巢进行石蜡包埋并切片, HE染色观察卵巢形态;其余卵巢组织冷冻切片后使用荧光显微镜观察GFP表达情况。(5)排卵数统计:各组雌性大鼠,进行超数排卵后获取的卵丘-卵母细胞复合体经透明质酸酶消化,统计卵细胞数量。(6)凋亡检测:按照TUNEL染色试剂盒推荐步骤对卵巢组织切片进行染色后,观察绿色荧光信号分布情况。(7)免疫荧光染色:分别使用兔抗大鼠mTOR一抗及罗丹明标记二抗对卵巢组织切片中的mTOR蛋白进行荧光标记,荧光显微镜下观察卵巢组织mTOR因子的表达情况。(8)血清激素水平检测:实验大鼠眶静脉丛取血后,静置30min后2000r/min离心10min获取血清。采用ELISA试剂盒按照推荐步骤对血清中睾酮(testosterone,T)、孕酮(progesterone,P)、雌二醇(estradiol,E2)进行检测。(9)颗粒细胞线粒体活性及线粒体融合状态检测:获取各组大鼠卵巢颗粒细胞进行体外培养。细胞贴壁后,部分细胞更换含终浓度为50nmol/L的Mito-Tracker Red CMXRos培养基,37℃孵育30min后,观察细胞内590nm红色荧光强度。其余颗粒细胞,固定后分别与兔抗大鼠TOM20一抗及FITC标记山羊抗兔二抗杂交,在激光共聚焦显微镜下观察细胞内线粒体聚集状态。(10)实时定量荧光PCR:使用Trizol法抽提卵巢组织中的总RNA,经反转录酶对mRNA进行反转录后,使用实时定量荧光PCR仪对目标基因进行扩增。采用SYBR Green荧光染料定量试剂及2-ΔΔCT法计算目标基因的相对表达水平,所检测指标的具体引物序列详见表1。(11)蛋白印迹:使用RIPA裂解液卵巢组织,经BCA法测定总蛋白浓度,按每组50μg总蛋白的标准进行SDS-PAGE凝胶电泳后,将凝胶中的蛋白转印至PVDF膜上,经脱脂奶粉封闭后采用相应1∶1000稀释后的一抗4℃孵育过夜,而后经相应1∶2000辣根过氧化物酶标记二抗室温孵育1h后,加入ECL发光液,使用凝胶成像系统进行放射自显影检测。

表1 引物序列
3.统计学方法:采用SPSS 13.0统计学软件对数据进行处理分析,满足正态分布的多组间差异采用单因素ANOVA分析中的Bonferroni或Dunnett′sT3进行校正,以P<0.05为差异有统计学意义。
结 果
1.苍附导痰汤对PCOS模型大鼠排卵功能及卵巢细胞活力的影响:模型组卵巢卵泡数较对照组增多。模型组单个视野下的平均卵泡数显著高于对照组,但黄体数目显著降低(图1A)。中药治疗组单个视野内的平均卵泡数较模型组有所下降,但差异无统计学意义。中药治疗组单个视野下的平均黄体数目较模型组显著上升。超数排卵后,模型组大鼠获卵数显著低于对照组;中药治疗组获卵数显著高于模型组,shRNA注射组的获卵数显著低于中药治疗组(图1B)。但在TUNEL染色的结果中并没有发现各组TUNEL阳性细胞核的密度的明显不同(图2A)。
图2 卵巢组织TUNEL染色结果(×200)
2.苍附导痰汤对PCOS模型大鼠激素水平及甾体激素合成酶表达水平的影响:模型组大鼠的血清T水平显著高于对照组,但P水平显著降低。中药治疗组血清T水平显著低于模型组,但P及E2的水平差异无统计学意义。shRNA注射组血清T水平较中药治疗组显著上升(图3A)。与对照组比较,HSD3β、CYP17a1及STAR的mRNA表达水平在模型组卵巢组织中显著上升;与模型组比较,HSD3β、CYP17a1及STAR基因mRNA的表达水平在中药治疗组卵巢组织中显著降低。而shRNA注射组卵巢组织CYP17a1的mRNA水平较中药治疗组显著提高(图3B)。
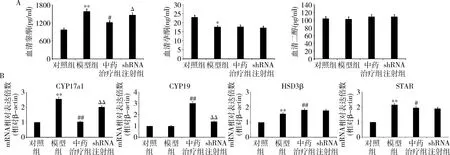
图3 大鼠血清甾体激素水平及卵巢组织甾体激素合成酶表达水平
3.苍附导痰汤对PCOS模型大鼠卵巢mTOR表达及颗粒细胞线粒体活性的影响:在各组大鼠卵巢组织的冷冻切片中都观察到了GFP,慢病毒包被的载体在卵巢组织中能够稳定表达(图4A)。模型组中mTOR因子的红色荧光的强度明显低于对照组,中药治疗组中mTOR信号强度较模型组显著提高,shRNA注射组中mTOR的红色荧光强度则较中药治疗组明显降低 (图4B)。代表线粒体活力的红色荧光在模型组大鼠的颗粒细胞中与对照组比较明显减弱。中药治疗组卵巢颗粒细胞的线粒体活性较模型组有所提高,但shRNA注射组的荧光强度较中药治疗组明显减弱(图4C)。
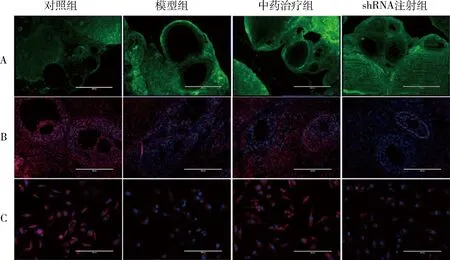
图4 鼠卵巢组织免疫荧光染色及卵巢颗粒细胞活性线粒体检测
4.苍附导痰汤对线粒体动力学平衡相关因子表达及线粒体聚集状态的影响:模型组卵巢组织中P110、AKT蛋白表达水平较对照组显著降低,mTOR及Drp-1的蛋白表达水平也随之降低;中药治疗组P110、AKT、mTOR、Drp-1蛋白表达水平较模型组均明显上升。shRNA注射组P110、AKT蛋白的表达水平与中药治疗组差异不明显,但Drp-1蛋白的表达水平明显降低(图5)。对照组大鼠颗粒细胞内线粒体呈现连续的网状分布,而模型组线粒体聚集程度增强;中药治疗组线粒体分布较模型组有趋向网状态分布的趋势,但shRNA注射组细胞内的线粒体仍表现为聚集程度增强的分布状态(图6)。
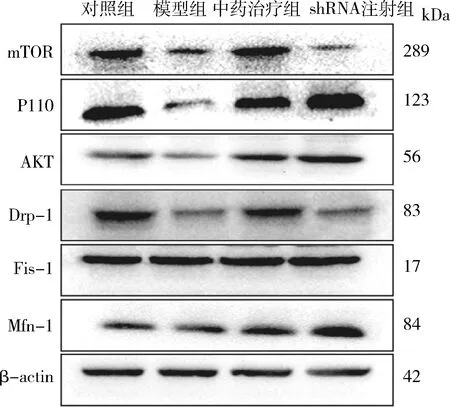
图5 卵巢组织关键因子蛋白表达
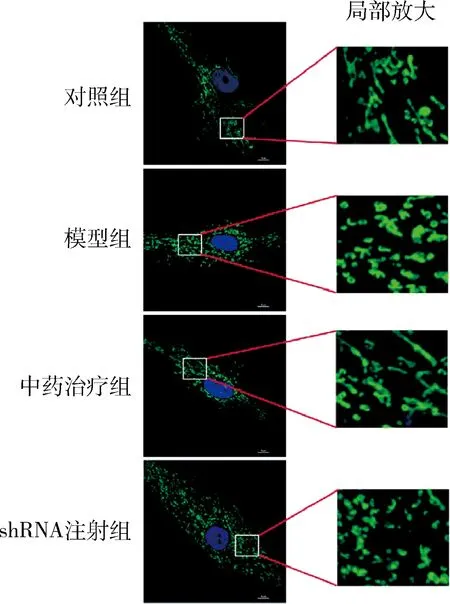
图6 卵巢颗粒细胞TOM20免疫荧光染色(×1600)
讨 论
1.苍附导痰汤对PCOS模型大鼠卵巢功能的影响依赖于mTOR的表达:肥胖、月经不调、稀发排卵与无排卵是PCOS患者临床的典型特征[8]。本研究中,PCOS模型大鼠卵巢内卵泡的密度较对照组显著增加,但超数排卵后的获卵数显著降低,说明PCOS模型大鼠卵巢可能对促性腺激素的敏感度降低。苍附导痰汤灌胃治疗虽然没有明显改变PCOS模型大鼠的卵泡密度,但显著增加了黄体密度,提示中药治疗很可能提高模型大鼠的排卵率。研究表明,苍附导痰汤对PCOS模型大鼠AKT/mTOR通路具有调节作用[6]。而本研究中,苍附导痰汤提高PCOS模型大鼠超排后排卵数的效果被mTOR基因的shRNA所抑制,说明中药调节卵巢功能的药效作用依赖于mTOR因子的表达。而mTOR的shRNA能够抑制苍附导痰汤对模型大鼠血清T水平及卵巢CYP17a1的mRNA表达的药效作用,也说明mTOR在苍附导痰汤调节卵巢雄激素分泌途径中的关键作用。
2.苍附导痰汤治疗PCOS模型大鼠表型的药效作用可能与线粒体功能的调节有关:PCOS患者不仅具有生殖功能的异常,还往往伴随有代谢功能的异常[9]。虽然PI3K、MAPK等经典的胰岛素代谢信号通路被证明与PCOS病因之间密切相关,但目前仍未找到代谢途径异常导致PCOS的直接证据[10]。线粒体即是细胞合成能量物质的场所也是参与甾体激素合成的细胞色素的主要分布场所,线粒体功能的异常很可能同时导致代谢的异常及甾体激素合成的紊乱[11]。mTOR是PI3K通路中受AKT磷酸化调控的细胞因子,并能通过提高线粒体分裂调控因子Drp-1的磷酸化促进线粒体的分裂[12]。研究表明,在PCOS患者卵巢颗粒细胞中mTOR的蛋白表达水平呈现降低的趋势[13]。本研究中PCOS模型大鼠卵巢组织中mTOR蛋白的表达水平较对照组显著下降,同时伴随着线粒体总活力的降低。苍附导痰汤治疗能够提升模型动物卵巢mTOR的表达水平及卵巢颗粒细胞中线粒体的活性,提示着在卵巢组织中,胰岛素信号通路与线粒体功能之间存在着密切的联系。而多个对胰岛素增敏剂作用机制的研究也证实,线粒体功能的改善可能是某些胰岛素增敏剂及代谢调节药物发挥药效作用的潜在机制[14,15]。
3.苍附导痰汤的药效机制可能与线粒体动力学平衡有关:在正常细胞中线粒体相互融合形成网状或管状结构来发挥正常的功能[14]。PCOS患者颗粒细胞中线粒体的分布态势也与正常人群存在着显著差异,预示着PCOS患者卵巢细胞的线粒体动力学平衡已经发生了改变[13]。线粒体分裂由细胞核编码的Drp-1因子调控,是线粒体清除受损脂膜及突变mtDNA的重要机制[16]。本研究中,PCOS模型大鼠卵巢细胞中Drp-1的表达水平降低,且颗粒细胞中线粒体的集聚状态与对照组比较,差异有统计学意义,提示模型大鼠的线粒体动力学平衡可能发生了变化。而mTOR因子的shRNA抑制苍附导痰汤提高线粒体分裂相关因子蛋白表达水平及改善颗粒细胞内线粒体的异常集聚状态的研究结果则表明,mTOR是苍附导痰汤调节PCOS模型大鼠卵巢细胞线粒体分裂机制的关键因子,胰岛素信号通路活性的变化很可能通过影响mTOR的活性进而对卵巢细胞的线粒体功能产生影响。
综上所述,苍附导痰汤对PCOS模型大鼠血清T水平异常及排卵功能异常有明确的治疗作用,其药效机制很可能与其对线粒体功能的调节有关。mTOR是苍附导痰汤发挥治疗作用的关键因子。而mTOR既是胰岛素信号通路PI3K的下游关键因子,也是调节线粒体分裂的重要因子,提示卵巢颗粒细胞内线粒体活性及功能的变化很可能是连接细胞代谢与内分泌功能变化的关键节点。而在PCOS患者体内存在的代谢综合征等异常病理表现是否会通过影响卵巢细胞线粒体功能,进而对生殖功能造成影响,还有待于开展深入研究。

