大鼠泪腺上皮细胞的原代培养和鉴定
曾 嫱 李新萍 李利民
干眼病是一种由多种因素引起的泪液分泌减少或蒸发过快导致的眼表疾病。虽然干眼病不致命,但严重影响到患者生活质量[1, 2]。由于生活方式改变,例如长期处于空调调控的干燥环境中、长期阅读书籍或使用电子产品导致的过度用眼,使干眼病发生率逐年升高,全球范围内的干眼病发生率达6%~34%[3~5]。在美国成年人群中干眼病患者约占9.3%,年龄超过50岁人群的发生率约11.3%,女性发生率高达22.8%[6]。在我国干眼病发生率为31.4%,尤其在年长女性中和高纬度地区发生率更高[7]。
泪腺细胞是泪腺中的主要功能细胞,具有分泌水、电解质和蛋白的作用,这些分泌物形成泪液膜的亲水层,保持眼睛湿润并维持眼部健康[8]。泪腺组织内炎性细胞的浸润,产生大量的炎性细胞因子,导致泪腺上皮细胞死亡,从而导致泪液分泌减少,这是引起干眼病的重要原因之一[9~11]。分离和培养泪腺上皮细胞, 是研究泪腺功能的基础, 也是研究干眼病发病机制和开发治疗药物的重要手段之一。本研究建立了从大鼠泪腺分离培养泪腺上皮细胞的方法,为干眼病的研究提供了一种稳定经济的细胞模型。
材料与方法
1.主要试剂:DMEM培养基、FBS、牛垂体提取物、重组表皮生长因子、角化细胞无血清培养基、青霉素-链霉素双抗、PBS、鼠尾胶原、防荧光淬灭剂均购自美国Life Technologies公司。Hoechst 33342和霍乱毒素(cholera toxin,CT)购自美国Sigma-Aldrich公司。胶原蛋白酶购自瑞士Roche公司。透明质酸酶购自美国Worthington公司。DNA酶购自德国EMD Millipore公司。细胞角蛋白(cytokeratin,CK, ab86734)、E-钙黏蛋白(E-cadherin, E-cad, ab76055)、波形蛋白(vimentin, Vim, ab8978)、S100(ab76729)和α-平滑肌蛋白(alpha-smooth muscle actin, α-SMA, ab5694)等一抗,以及Alexa Fluor 488 结合的羊抗鼠二抗(ab150113)、Alexa Fluor 488 结合的羊抗兔二抗(ab150077)均购自英国Abcam公司。
2.泪腺上皮细胞的分离培养:分离培养方法根据文献[12,13]改良建立。采用4周龄Sprague-Dawley大鼠(体质量150~180g),从中分离纯化泪腺上皮细胞。大鼠经麻醉处死后,手术摘除其泪腺。泪腺组织经PBS洗涤,去除残留血渍,小心剥离周边的结缔组织,剪碎,加入0.5mg/ml胶原蛋白酶、100units/ml透明质酸酶和14080units/ml DNA酶,在90mm培养皿中37℃条件下消化2h,每20min轻轻振动一次。收集细胞悬液,70μm滤器过滤去除未消化组织,在1500r/min条件下离心3min,收集下层细胞。加入DMEM/F12培养液混悬细胞,细胞悬液经培养液洗涤两次后,接种于75cm2的培养瓶中,放入CO2培养箱培养2h后,弃去已贴壁细胞(主要是纤维细胞)。小心吸取未贴壁细胞悬液(主要是腺细胞),转入胶原(5μg/cm2)预包被的培养瓶中,加入添加了10% FBS、50μg/ml BPE、5ng/ml rEGF、80ng/ml CT、1%双抗的KSFM培养基中,静置培养24h,换新鲜培养基。培养20天左右的细胞可传代培养。
3.泪腺上皮细胞的鉴定:采用细胞免疫荧光染色方法对培养的泪腺上皮细胞主要标志物进行鉴定。泪腺细胞接种于适用于免疫荧光实验的8孔腔室载玻片,培养箱里过夜培养,抽去多余培养液后,用4%多聚甲醛固定10min。然后用PBS轻轻漂洗2min,更换为0.25%Triton X-100溶液,培养15min使细胞穿孔暴露胞内蛋白。用PBS轻轻漂洗后,加入2% BSA溶液封闭1h,再加入一抗在4℃条件下湿盒中孵育过夜。一抗包括anti-CK (1∶100), anti- E-cad (1∶100), anti-Vim (1∶200), anti-S100 (1∶400) 和anti-α-SMA (1∶400)。去掉多余的抗体液,经PBS洗涤后,加入相应的Alexa Fluor 488标记的羊抗鼠二抗(1∶200)或羊抗兔二抗(1∶200)孵育1h。PBS洗去多余二抗后,加入Hoechst 33342(1∶250)染核。拆去孔室装置,用防荧光淬灭剂封闭玻片,指甲油封固。激光共聚焦显微镜(FV1000,日本Olympus公司)下观察结果。
结 果
1.细胞形态和生长观察:分离的泪腺细胞包括多种细胞,即酶消化后的上皮细胞、肌上皮细胞、间充质细胞和少量红细胞。红细胞由于具有悬浮生长的特征,可以通过更换新鲜培养基来消除。成纤维细胞沉降并在2h内黏附到培养瓶底部,因此,可利用成纤维细胞这个特性在其黏附2h后,将漂浮细胞转移到另一个胶原包被的培养瓶中以去除成纤维细胞。原代培养的泪腺上皮细胞在3天内贴附到瓶底上,并增殖形成汇合的单层细胞。泪腺上皮细胞表现出鹅卵石形态,并混有少量梭形细胞(图1)。21天后,细胞长满瓶底的80%~90%,将细胞传代,传代后的细胞多数表现出鹅卵石形态和长条形,也有极少数平铺展开的大尺寸细胞(图2中A、B)。
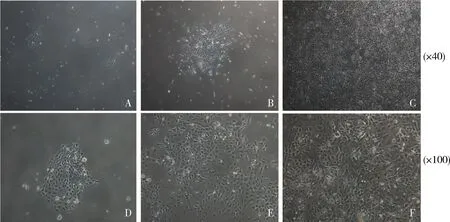
图1 原代培养大鼠泪腺细胞的形态 A、D.第7天;B、E.第14天;C、F.第21天

图2 传代大鼠泪腺细胞的形态(×100)
2.细胞免疫荧光染色鉴定:通过免疫荧光染色标记不同的细胞标志物对分离培养的细胞进行鉴定。细胞角蛋白和E-钙黏蛋白是上皮细胞标志物,波形蛋白是间充质细胞标志蛋白,而α-SMA和S100蛋白在肌上皮细胞中大量表达,是肌上皮细胞标志蛋白。分离培养的细胞高表达细胞角蛋白和E-钙黏蛋白,弱表达α-SMA和S100蛋白,基本不表达波形蛋白,表明从泪腺组织分离培养得到的是上皮细胞(腺细胞)和肌上皮细胞(导管细胞,图3)。
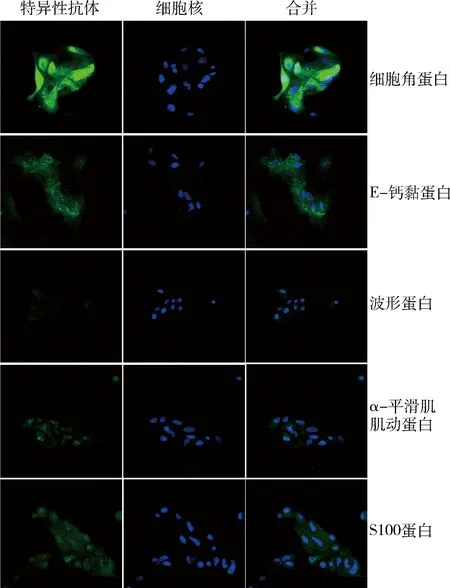
图3 原代培养大鼠泪腺细胞的鉴定(×200)
讨 论
泪腺的主要功能是分泌水、电解质和蛋白质,形成泪液膜的亲水层,保持眼睛湿润并维持眼部健康[8]。在泪腺中存在3种主要的细胞类型,包括腺泡和导管上皮细胞、肌上皮细胞和间充质细胞[13, 14]。腺泡上皮细胞在分泌水、电解质和某些蛋白质中起重要作用[15]。肌上皮细胞围绕腺泡和导管细胞,以维持腺泡完整性并刺激分泌产物从腺泡细胞中进入导管。间充质细胞起结构和支持作用,包括间充质干细胞、分化的成纤维细胞和分化的脂肪细胞[16]。腺泡上皮细胞和肌上皮细胞对泪腺功能都有重要作用。本研究采用简单经济的方法分离出泪腺上皮细胞。首先利用不同类型细胞的贴壁时间不同去除掉成纤维细胞,重复该操作可达到纯化细胞的目的。然后采用胶原蛋白Ⅰ包被培养瓶以及在培养基中补充CT以维持泪腺细胞形态和上皮表型。值得注意的是CT对维持细胞上皮形态有重要作用,已有研究发现原代培养的上皮细胞在未添加CT的培养基中呈现单层多边形形态但是传代后形态明显改变,而在添加CT的培养基中传代后多边形形态仍可维持[12, 13]。
笔者选取不同的细胞标志物对分离培养的细胞进行鉴定。CK是位于上皮细胞的中间细丝蛋白,在不同腺上皮和导管上皮中的表达模式差异较大,研究发现腺上皮细胞表达CK-5、CK-7和CK-19[17~19]。由于尚未有特异CK在大鼠泪腺上皮表达的报道,在本实验中采用了pan-CK作为检测抗体。E-钙黏蛋白是上皮细胞标志物,在人泪腺中有明显表达[20]。Vim是间充质细胞的主要细胞骨架成分,常表达于成纤维细胞、内皮细胞。α-SMA是收缩细胞比如肌细胞、肌上皮细胞的主要骨架蛋白,而S100蛋白是一种酸性钙结合蛋白,由2个亚基组成,在肌上皮细胞中大量表达,是肌上皮细胞标志蛋白[13]。对细胞鉴定结果显示,本研究分离得到的细胞高表达CK和E-cad,弱表达α-SMA和S100蛋白,基本不表达Vim,提示这些细胞表现为上皮细胞和肌上皮细胞的混合群体。上皮细胞和肌上皮细胞对维持泪腺功能都有有益的作用,基于此,对这两种细胞所占比例尚未进行分析,这也是本实验的一个不足之处。目前尚无泪腺腺泡细胞的特异性表面标志物,腺泡细胞属于上皮细胞,因此本研究采用上皮细胞标志物作为鉴定标记,但是泪腺腺泡细胞能特异性分泌lacritin和β-hexosaminidase,由于这两种物质是分泌物,在细胞中不便于检测,因此未作为鉴定标记。此外,如果是未成熟的泪腺细胞也会表达祖细胞的标志物,例如Ki-67、Pax6等[21, 22]。
综上所述,本研究成功建立了从大鼠泪腺分离培养泪腺上皮细胞的方法,为泪腺疾病,尤其是干眼病和干燥综合征的研究提供了一种稳定、经济的体外模型。

