间歇性禁食对小鼠脑缺血再灌注TLR4/NF-κB通路的作用
王欣格 刘恒方 田建荣 王成名 张 敏
脑血管病是常见的脑部疾病,复发率和病死率高。脑缺血再灌注损伤(cerebral ischemia reperfusion injury, CIRI)在脑血管病中占主要地位,其可以导致神经元变性、坏死或凋亡,并且产生炎性反应[1]。其中炎性反应在缺血再灌注损伤中起关键性作用。既往研究发现,TLR4/NF-κB信号通路是炎症形成的主要信号通路。一些内生的配体通过激活TRL4受体激活NF-κB,导致其释放促炎细胞因子[2]。而脑缺血再灌注损伤后可以使NF-κB信号通路激活,促进炎性因子的大量表达,脑组织损伤进一步加重[3]。禁食是一种新的食物摄入方式,包括饮食限制(dietary restriction,DR)、热量限制(caloric restriction,CR)、间歇性禁食(intermittent fasting,IF)[4]。近20年来,多项研究发现IF和CR可以延缓衰老,减少肿瘤及心脑血管疾病,增强生物体承受后续压力的能力[5,6]。
本研究旨在通过间歇性禁食,观察小鼠局部CIRI后神经功能缺损评分及TLR4、NF-κB的表达,从动物试验的角度探讨间歇性禁食对CIRI是否具有抗炎作用,从而为缺血性脑血管病的预防性治疗提供新的临床思路。
材料与方法
1.材料:(1)动物:健康6~7周龄雄性KM小鼠,清洁级,体质量为20~25g,喂养于郑州大学第五附属医院中心实验室SPF动物室[实验动物许可证号:SCXX(豫)2019-0002]。(2)试剂:兔抗小鼠TLR4一抗,兔抗小鼠NF-κB p65一抗(武汉三鹰有限公司);HE(苏木精-伊红)染色试剂盒(北京索莱宝科技有限公司)。(3)仪器:手术显微镜购自北京中西远大科技公司;电泳及转膜槽购自美国Bio-Rad公司;高精度电子天平购自北京生物仪器有限公司;全自动包埋机购自Leica公司;显微镜及其图像分析软件购自德国Carl Zeiss Jena公司;血糖测量仪、血糖试条(葡萄糖脱氢酶法)购自北京怡成生物电子技术股份有限公司。
2.分组:将小鼠随机分成3组,15只/组。分别为间歇性禁食组(IF组)、正常饮食组(CIRI组)和假手术组(Sham组)。IF组16:00时至次日8:00时禁食,其余时间随意进食,24h自由饮水。CIRI组及Sham组均24h随意进食。
3.小鼠体质量及血糖测量:第0天、第3天、第7天、第11天、第14天15:00时左右用称重仪器测量体质量并记录,同时检测各组随机血糖情况。
4.小鼠脑缺血再灌注模型制备:参考Longa等[7]线栓法堵塞小鼠大脑中动脉构建小鼠脑缺血再灌注模型,各组预处理完毕后,麻醉小鼠,用碘伏消毒颈部皮肤后纵行切开,暴露术野,在显微镜下分离出颈动脉,结扎近心端,在其分叉处打活结,之间再打1个单结。在外科结和活结处剪口,插入线栓后将单结固定,线栓插入1.5cm时停止,固定,打结,缝皮。1h后,将线栓拔出少许,多余部分剪掉。各组模型制备成功约24h后,进行下一步实验操作。Sham组除不插入线栓外,手术步骤相同。术后各组小鼠均在23℃条件下复苏,此时均不控制进食。
5.Longa神经功能评分:小鼠造模24h后,参考Longa等(0~4分)5分制对小鼠进行神经功能缺损评分[7]。评分标准:0分:无肢体偏瘫、活动正常者;1分:左侧前爪不能完全伸展;2分:行走时向左转圈;3分:爬走时身体向左倾倒;4分:不能行走,意识丧失。其中,0分及4分小鼠均弃用。
6.病理组织切片制备:各组随机选取6只小鼠,心脏灌流直至血液变为清澈,随后用4%多聚甲醛固定至小鼠四肢及躯干僵硬为止。取脑组织,4%多聚甲醛4℃固定24h后,依次完成脱水步骤,随后进行后续包埋等操作。
7.苏木精-伊红(HE)染色:石蜡切片按HE染色步骤经脱蜡、脱水、染色、冲洗、中性树胶封片,光镜下观察脑组织细胞形态。
8.免疫组织化学染色检测NF-κB p65及TLR-4的表达:脑组织切片经脱蜡、脱水、PBS反复冲洗等步骤后再进行抗原修复,5%BSA封闭30min,弃去,加入一抗工作液,放于4℃冰箱过夜;次日复温30min,冲洗,滴加二抗,室温孵育30min,冲洗,滴加DAB显色,中性树胶封片。显微镜下用高倍镜观察,每张切片随机选取3个高倍镜视野进行细胞阳性计数。

结 果
1.体质量及血糖:IF组、CIRI组、Sham组的体质量较分组处理前均增加。最初3天,各组小鼠的体质量无明显变化。7天后,与IF组比较,CIRI组和Sham组的体质量均有明显增长,但CIRI组与Sham组体质量变化比较,差异无统计学意义,各组的随机血糖变化比较,差异无统计学意义,详见图1。
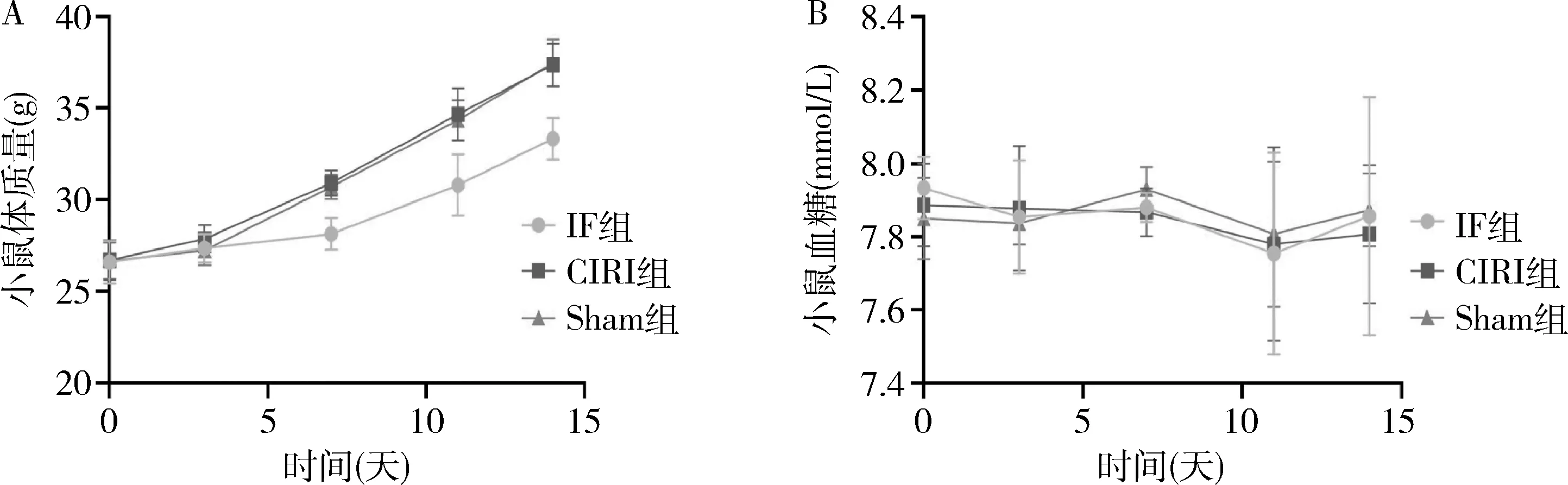
图1 小鼠体质量及血糖变化
2.神经功能评分:与Sham组比较,IF组及CIRI组神经功能评分明显改变,均有不同程度的神经功能缺损。与CIRI组比较,IF组神经功能评分明显下降,详见图2。
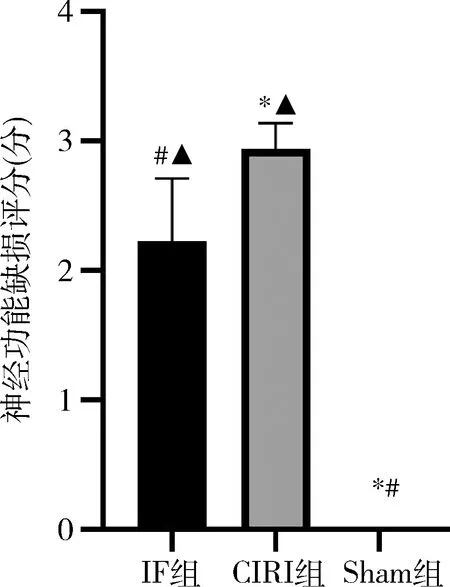
图2 小鼠神经功能评分与IF组比较,*P<0.05;与CIRI组比较,#P<0.05;与Sham组比较,▲P<0.05
3.HE染色情况:(1)IF组:缺血半暗带及海马CA1区神经元细胞深染明显减轻,细胞皱缩及细胞形态明显改善,细胞损伤程度较CIRI组明显改善。(2)CIRI组:缺血半暗带及海马CA1区神经元细胞体积缩小,细胞深染皱缩,与周围分界不清,细胞核固缩深染。(3)Sham组:缺血半暗带及海马CA1区细胞形态正常,结构完整。详见图3、图4。

图3 脑缺血半暗带HE染色图(×400)

图4 海马CA1区HE染色图(×400)
4.TLR4、NF-κB免疫组化表达情况:镜下观察,呈棕黄色颗粒物质的为阳性信号。IF组及CIRI组:脑组织TLR4及NF-κB 显著表达。Sham组:脑组织细胞TLR4及NF-κB 微弱表达。与Sham组比较,CIRI组的TLR4及NF-κB 呈强阳性表达,IF组也呈较强阳性表达。与CIRI组比较,IF组的TLR4及NF-κB的表达明显降低,差异有统计学意义,详见图5~图7。

图5 TLR4免疫组化表达情况(×400,棕黄色颗粒为阳性细胞)
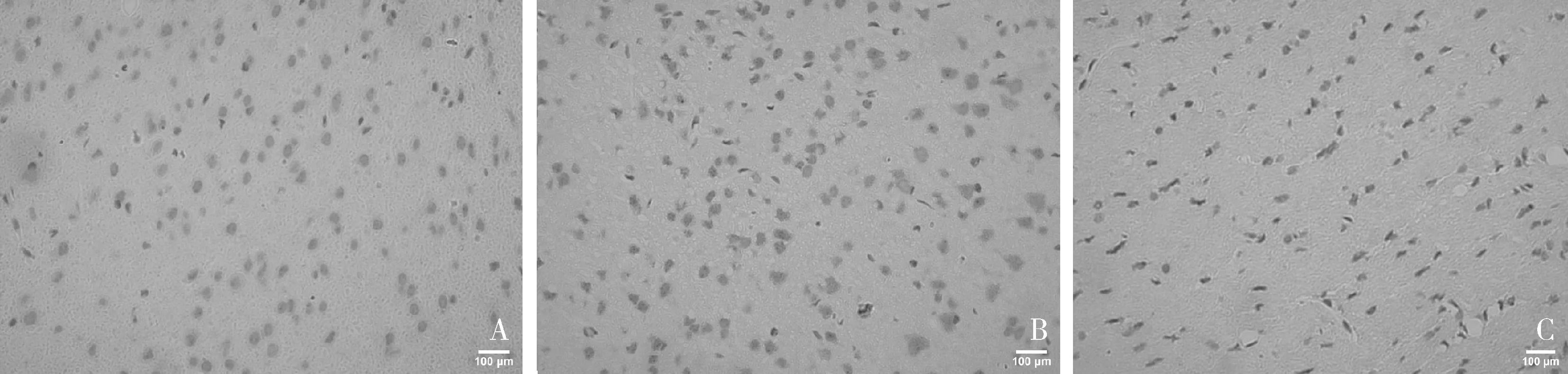
图6 NF-κB免疫组化表达情况(×400,棕黄色颗粒为阳性细胞)

图7 免疫组化结果
讨 论
随着脑血管病发生率的逐年升高,在脑血管病中占比极高的CIRI也被越来越多地研究,目前关于CIRI的发病机制,主要包括内质网应激、炎症和凋亡等,其中炎症和氧化应激是导致CIRI的主要因素[8~10]。热量限制指的是摄食种类正常,总量减少30%~40%,同时保证必须氨基酸的摄入,具有简单易施,无药物毒性不良作用等优点[11,12]。其中,IF是热量限制较为常用的方案。研究表明,CR可减少炎症和NF-κB信号表达并且对炎性反应具有重要作用[13]。
吉晔楠[14]研究发现,对小鼠进行8周的热量限制可减小心肌缺血再灌注损伤后的心肌梗死面积,使心肌缺血再灌注损伤得到明显改善,同时也发现CR对心肌缺血再灌注损伤的保护与抑制TLR4/NF-кB通路激活有关。未造成小鼠的明显损伤,还能优化小鼠的基本生理指标,本实验经过14天的间歇性禁食,各组小鼠体质量均显著增加。前3天,3组小鼠体质量变化均不明显,这可能与禁食期间摄食不足有关。7天后,各组体质量变化出现明显差异,多考虑为IF组小鼠习惯禁食方案,开始自我调节以保证能量需求。各组小鼠血糖比较差异无统计学意义,说明间歇性禁食未对小鼠血糖造成明显影响,两项研究结果相似,说明IF不会造成小鼠生理功能等的损伤。任晋军[15]研究发现,在建立肝缺血再灌注模型前对小鼠进行IF3个月,可以抑制NF-κB信号通路及肝组织TLR4的表达,对肝脏的缺血再灌注损伤有保护作用。以上研究均证实CR可能通过抑制炎性反应来减轻机体缺血再灌注损伤的程度。但是间歇性禁食在脑缺血再灌注损伤中TLR4/NF-κB通路的抑制作用研究较为罕见。
Varendi等[16]研究发现,在大鼠模型造模前,给予大鼠3天禁食或者6天无蛋白饮食,与正常饮食组比较,可以减少脑梗死面积,改善脑缺血再灌注损伤。也有研究证实,在进行大脑中动脉阻断术前进行40 周的禁食能够减少大鼠脑组织的梗死面积,降低脑卒中后的病死率[17,18]。本实验采用tMCAO模型,发现与Sham组比较,CIRI组小鼠神经功能缺损评分明显升高,表明模型组脑缺血再灌注损伤严重,提示造模成功。与CIRI组比较,IF组小鼠神经功能缺损评分明显下降,表明IF组可有效改善小鼠行为学,减轻脑缺血再灌注损伤程度。同时,HE染色显示,与CIRI组小鼠比较IF组脑组织缺血半暗带区及海马CA1区细胞深染及皱缩明显减轻,细胞形态改善,说明IF可减轻脑组织坏死程度,缓解脑组织损伤。本实验研究结果与这些实验研究结果相同,表明间歇性禁食可减轻脑缺血再灌注损伤程度。
有研究表明,预防性IF可能通过抑制NF-κB信号通路减轻炎性反应及调节免疫应答,曹参祥等实验采用TLR4功能缺陷的小鼠,制作小鼠大脑中动脉再灌注模型,并对比神经功能缺损评分及TLR4表达等情况,发现TLR4功能缺陷的小鼠CIRI程度比TLR4表达正常的小鼠明显减轻[19,20]。本实验从免疫组化结果可看出CIRI组中TLR4及NF-κB 阳性细胞呈现棕黄色颗粒,呈强阳性表达。IF组阳性细胞表达较CIRI组显著减少,提示IF与TLR4/NF-κB通路有联系,减轻了脑缺血再灌注的损伤程度,这与曹参祥等[20]、吉晔楠[14]及任晋军[15]的研究结果类似,表明IF可能通过抑制TLR4/NF-κB通路从而减轻脑缺血再灌注损伤程度,起到神经保护的作用。
综上所述,本研究证实,IF可能通过抑制TLR4、NF-κB的表达,来减轻CIRI造成的损伤,发挥神经保护作用,可为临床治疗提供新的思路。但间歇性禁食也存在患者难以坚持、依从性差等问题,后续可继续寻找替代疗法或加强患者依从性的方案,以寻求更好的治疗效果。

