N-芳基-2-叠氮基苄基胺的一锅法合成
张文生,马科友,李晓乐
(济源职业技术学院 冶金化工系,河南 济源 459000)
一、引言
N-芳基-2-叠氮基苄基胺(图1,1)是一类重要的有机合成中间体,具有类似结构的化合物可以通过环加成反应,应用于构建具有重要生理活性的3,4-二氢喹唑啉-2(1H)-硫酮类化合物(图1,2)[1-5]。例如,丁明武教授等通过邻叠氮苯甲醛、胺、三甲硅基叠氮和异腈的四组分Ugi反应制备的底物1A(图2,1A),再经过Staudinger/aza-Wittig环化后得到了一组含有四唑环的3,4-二氢喹唑啉-2(1H)-硫酮类化合物2A(图2,2A)[6]。笔者团队则报道了一种通过邻叠氮苯甲醛、氨基酸酯和N-取代丁二酰亚胺的三组分反应及随后的环加成反应,经过中间体1B构建多环的3,4-二氢喹唑啉-2(1H)-硫酮类化合物2B的方法(图2,B)[7]。
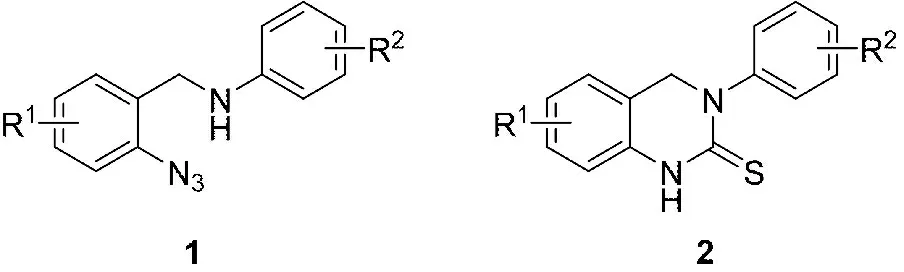
图1 N-芳基-2-叠氮基苄基胺和3,4-二氢喹唑啉-2(1H)-硫酮的骨架结构
为了进一步拓展N-芳基-2-叠氮基苄基胺中间体的应用,课题组研究了该类化合物的合成方法。以邻氟苯甲醛3为原料,六甲基邻酰三胺(HMPA)为溶剂,通过NaN3对邻氟苯甲醛的苯环上羰基邻位C-F键的亲核取代反应,首先得到中间体邻叠氮基苯甲醛A。该中间体未经分离,向反应体系中加入芳胺3和三乙酰氧基硼氢化钠(NaHB(OAc)3),一锅法发生氨化还原反应,得到了相应的目标产物1(图3)。
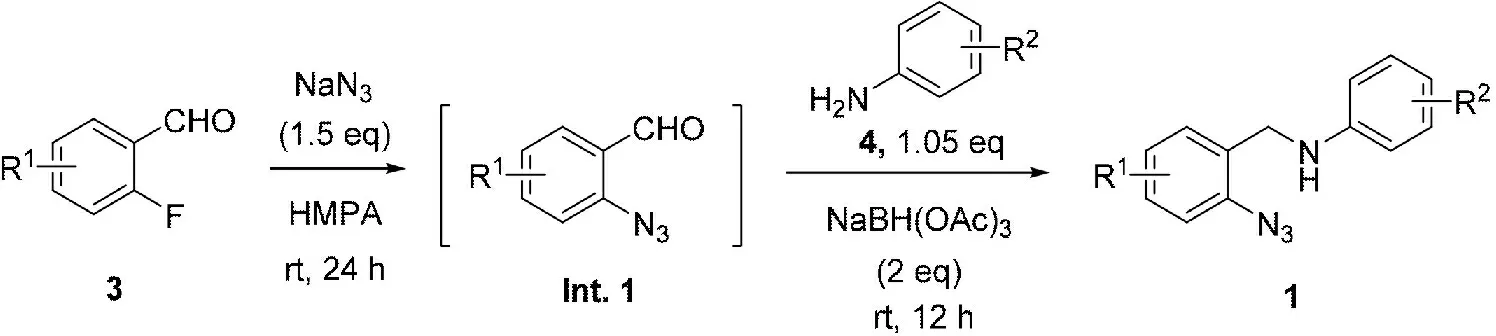
图3 N-芳基-2-叠氮基苄基胺的合成步骤
二、试验与讨论
首先选择5-氯-2-氟苯甲醛3a和2-甲基苯胺4a为底物,对反应条件进行优化研究(表1)。

表1 反应条件的优化
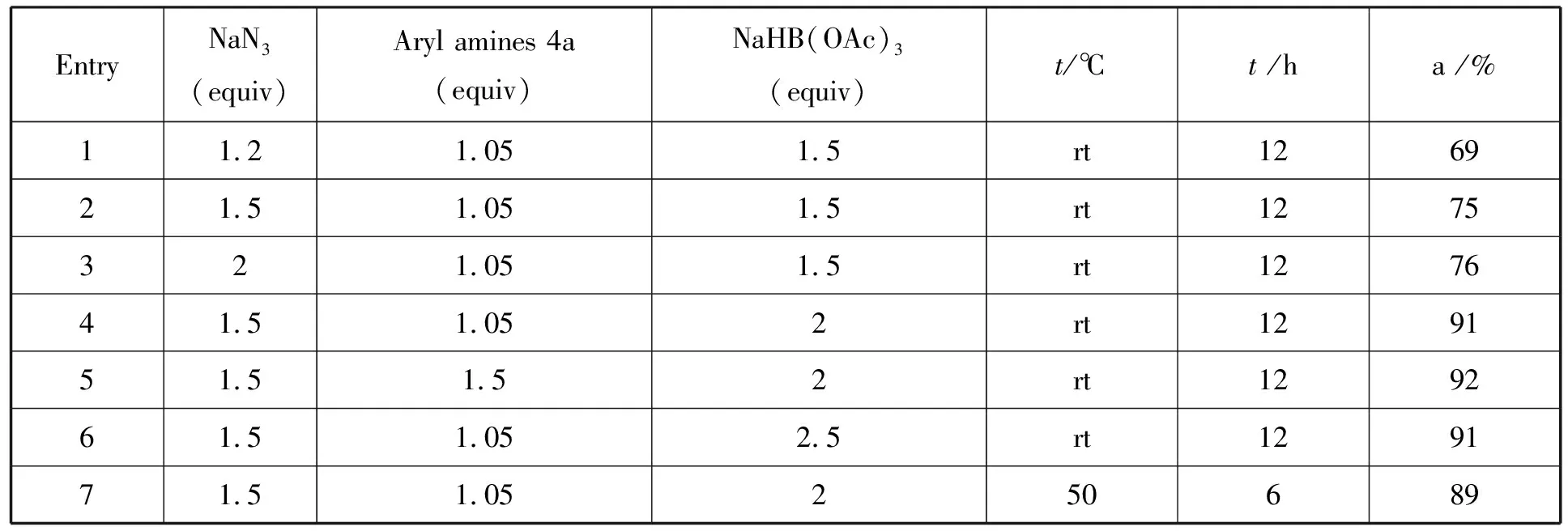
EntryNaN3(equiv)Aryl amines 4a(equiv)NaHB(OAc)3(equiv)t/℃ t /ha /%11.21.051.5rt126921.51.051.5rt1275321.051.5rt127641.51.052rt129151.51.52rt129261.51.052.5rt129171.51.05250689
向5-氯-2-氟苯甲醛3a(1 mmol)的HMPA (2 mL)溶液中,加入1.2 eq的NaN3(1.2 mmol,78 mg),在室温下进行叠氮化反应24 h,再加入1.05 eq的2-甲基苯胺4a (1.05 mmol,113 mg)和1.5 eq的NaHB(OAc)3(1.5 mmol,318 mg),室温反应12 h,此时产物1a的分离收率为69% (entry 1)。NaN3的用量增加到1.5 eq,收率提高到75% (entry 2)。但继续增加用量至2 eq,则收率几乎不变 (entry 3)。试验表明,向5-氯-2-氟苯甲醛3a (1 mmol)的HMPA (2 mL)溶液中,加入1.5 eq的NaN3(1.5 mmol,98 mg)进行叠氮化反应24 h,再向上述体系加入1.05 eq的2-甲基苯胺4a (1.05 mmol,113 mg)和2 eq的NaHB(OAc)3(2 mmol,424 mg),室温反应12 h,是最佳的反应条件,产物1a的收率可以达到91%(entry 4)。增加4a 的用量至1.5 eq,虽然产率略有提高,但残留的2-甲基苯胺不利于最终产物的分离纯化过程 (92%,entry 5)。无论是增加NaHB(OAc)3的用量至2.5 eq (entry 6),或将氨化还原反应温度升至50 ℃(entry 7),产物1a的分离收率都没有明显提高。
在优化的反应条件下,原料5-氯-2-氟苯甲醛3a、5-溴-2-氟苯甲醛3b分别和原料4-氯苯胺4b、4-溴苯胺4c反应,均以满意的收率获得相应的目标产物1b-1e (图4)。
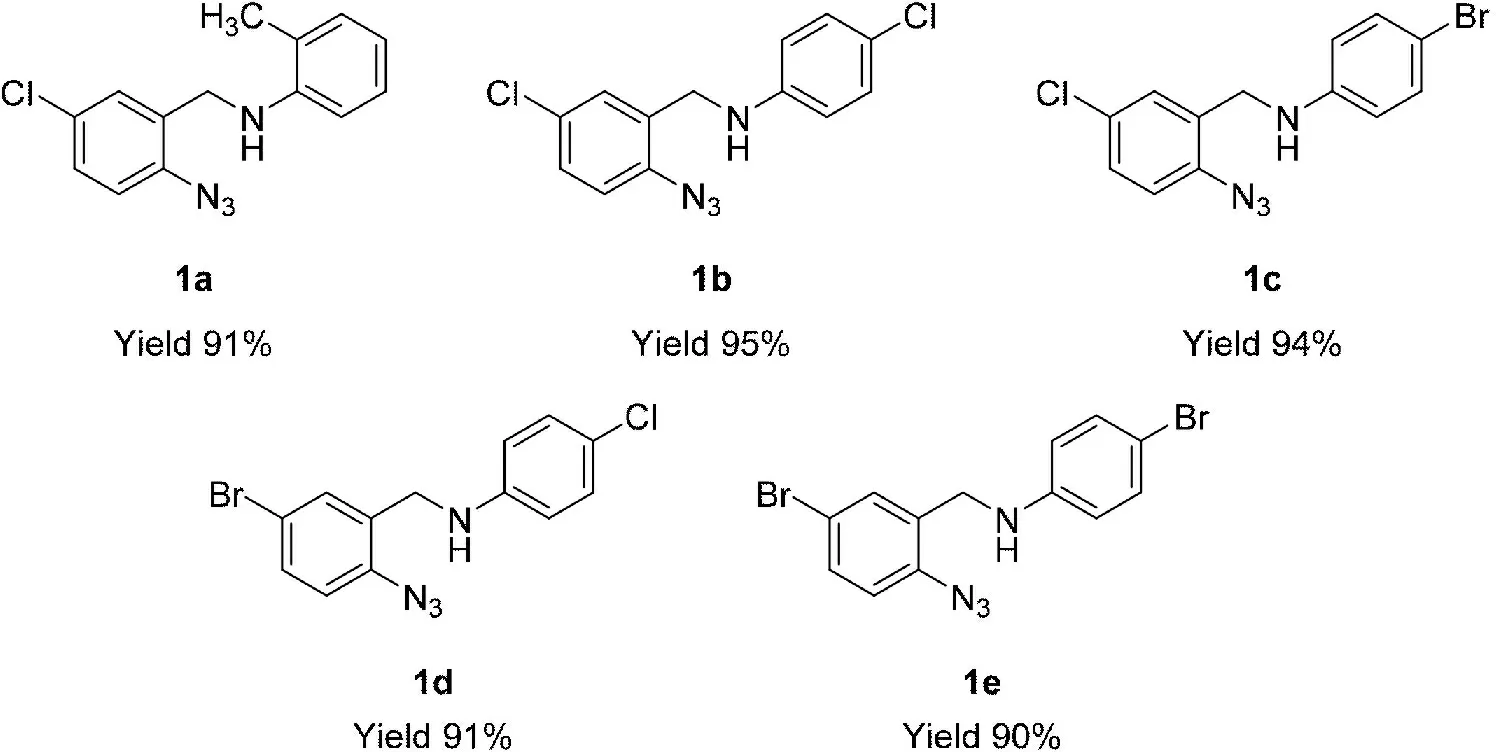
图4 N-芳基-2-叠氮基苄基胺产物的结构和收率
三、试验操作与数据
所有购买的试剂,使用之前都没有经过进一步的纯化。氢核磁共振和碳核磁共振谱由Bruker DPX-400光谱仪测定 (分别为400和100 MHz),以CDCl3为溶剂,使用TMS作为内标。
二茂铁基多取代吡咯烷4a-j的合成 (通用反应步骤)。将2-氟苯甲醛 3 (1 mmol)和叠氮化钠(1.5 mmol,98 mg)加入到 3 mL的六甲基磷酰胺 (HMPA)中。该反应混合物在室温下搅拌反应24 h。薄层硅胶板检测 (TLC展开剂:乙酸乙酯-石油醚,1∶20),原料消耗完全,有明显的中间体Int. 1生成。向反应体系内加入原料 4 (1.1 mmol),继续搅拌30 min。再加入NaHB(OAc)3,室温搅拌24 h。TLC再次检测,中间体A消耗完全,反应停止。用旋转蒸发器在减压下将反应溶剂除去。所得到的固体残渣溶解在二氯甲烷中 (15 mL),用饱和食盐水 (15 mL)和水 (2×15 mL)洗涤,无水硫酸钠上干燥,并在减压下旋干。粗品经硅胶柱色谱法(EtOAc-石油醚,1∶3.5)分离纯化,得到产品1。产品1a-1e的核磁氢谱和核磁碳谱有关数据如下:
N-(2-azido-5-chlorobenzyl)-2-methylaniline 1a。1H NMR (CDCl3,400 MHz) δ (ppm) 2.20 (3H,s),4.00 (1H,s),4.29 (2H,s),6.48 (1H,d,J = 8.4 Hz),6.47-7.34 (6H,m)。13C NMR (CDCl3,100 MHz) δ (ppm) 17.59,43.63,110.12,117.62,119.37,122.22,127.22,128.38,129.04,130.24,130.42,132.46,136.39,145.46。
N-(2-azido-5-chlorobenzyl)-4-chloroaniline 1b。1H NMR (CDCl3,400 MHz) δ (ppm) 4.21 (3H,s,-CH2-,-NH-),6.50 (1H,d,J = 8.8 Hz),7.08-7.31 (5H,m)。13C NMR (CDCl3,100 MHz) δ (ppm) 43.71,114.12 (2C),119.42,122.60,128.53,128.98,129.18 (2C),130.40,131.82,136.41,146.02。
N-(2-azido-5-chlorobenzyl)-4-bromoaniline 1c。1H NMR (CDCl3,400 MHz) δ (ppm) 4.21 (3H,s,-CH2-,-NH-),6.46 (2H,d,J = 8.8 Hz),7.09 (1H,J = 8.8 Hz),7.22-7.30 (4H,m)。13C NMR (CDCl3,100 MHz) δ (ppm) 43.66,109.65,114.61 (2C),119.43,128.54,128.96,130.40,131.75 (2C),132.04,136.41,146.44。
N-(2-azido-5-bromobenzyl)-4-chloroaniline 1d。1H NMR (CDCl3,400 MHz) δ (ppm) 4.21 (2H,s),4.30 (1H,s),6.52 (2H,d,J = 8.8 Hz),7.03-7.12 (3H,m),7.40-7.46 (2H,m)。13C NMR (CDCl3,100 MHz) δ (ppm) 43.76,114.24 (2C),118.01,119.77,122.76,129.18 (2C),131.95,132.04,137.05,145.88。
N-(2-azido-5-bromobenzyl)-4-bromoaniline 1e。1H NMR (CDCl3,400 MHz) δ (ppm) 4.21 (2H,s),4.38 (1H,s),6.48 (2H,d,J = 8.8 Hz),7.04 (1H,d,J = 8.4 Hz),7.23-45 (3H,m)。13C NMR (CDCl3,100 MHz) δ (ppm) 43.67,109.85,114.75 (2C),118.01,119.77,131.54,131.94,132.06 (3C),137.05,146.27。
代表性化合物1a的1H NMR中(图5),δ 4.00的低宽峰 (s,1H)为N-H吸收峰。δ 4.29的单峰 (s,1H)归属于胺化还原后产生的亚甲基 (-CH2-)吸收峰。13C NMR谱图中(图6),δ 43.63为亚甲基C的吸收峰。
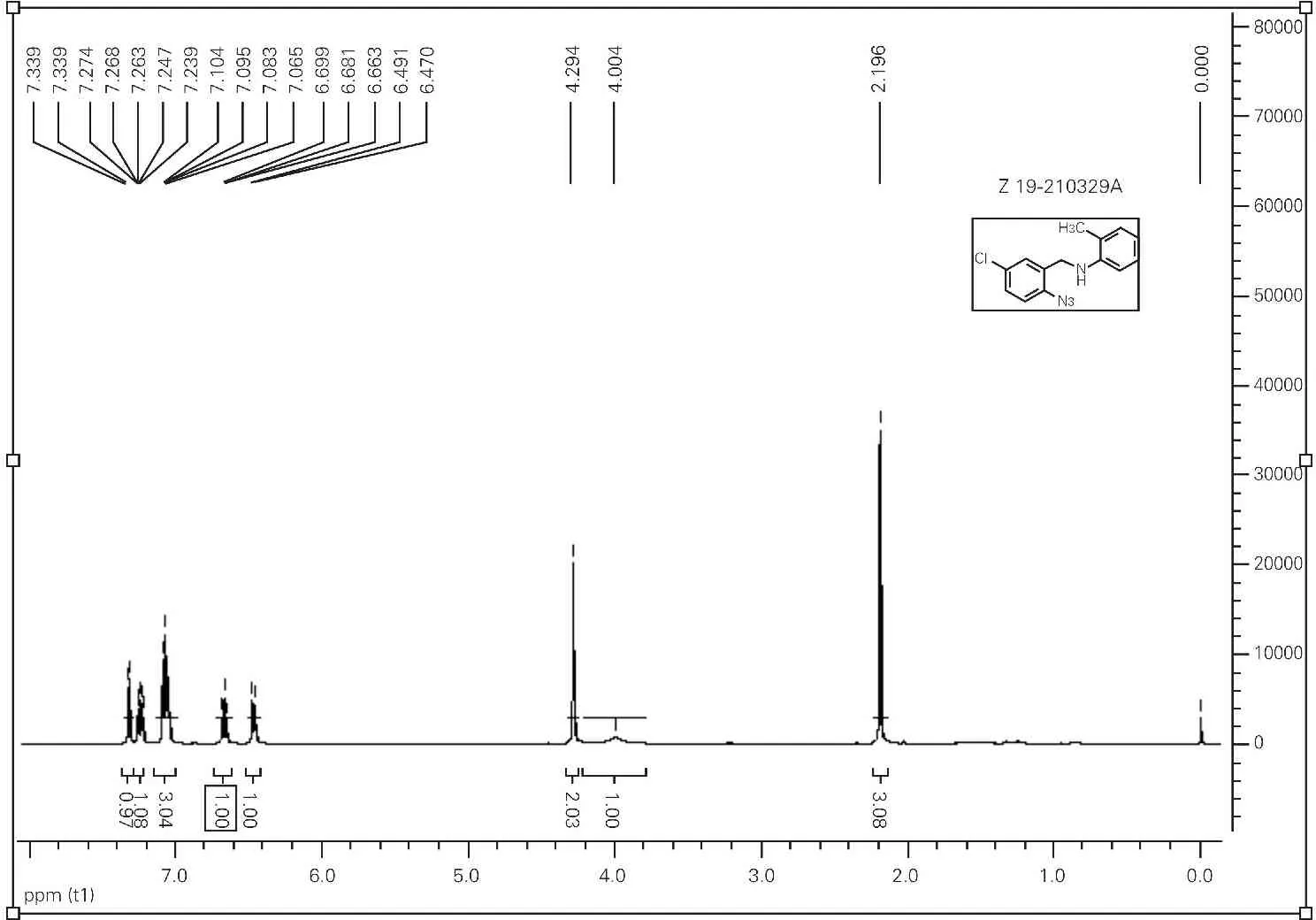
图5 代表性化合物1a的1H NMR谱图
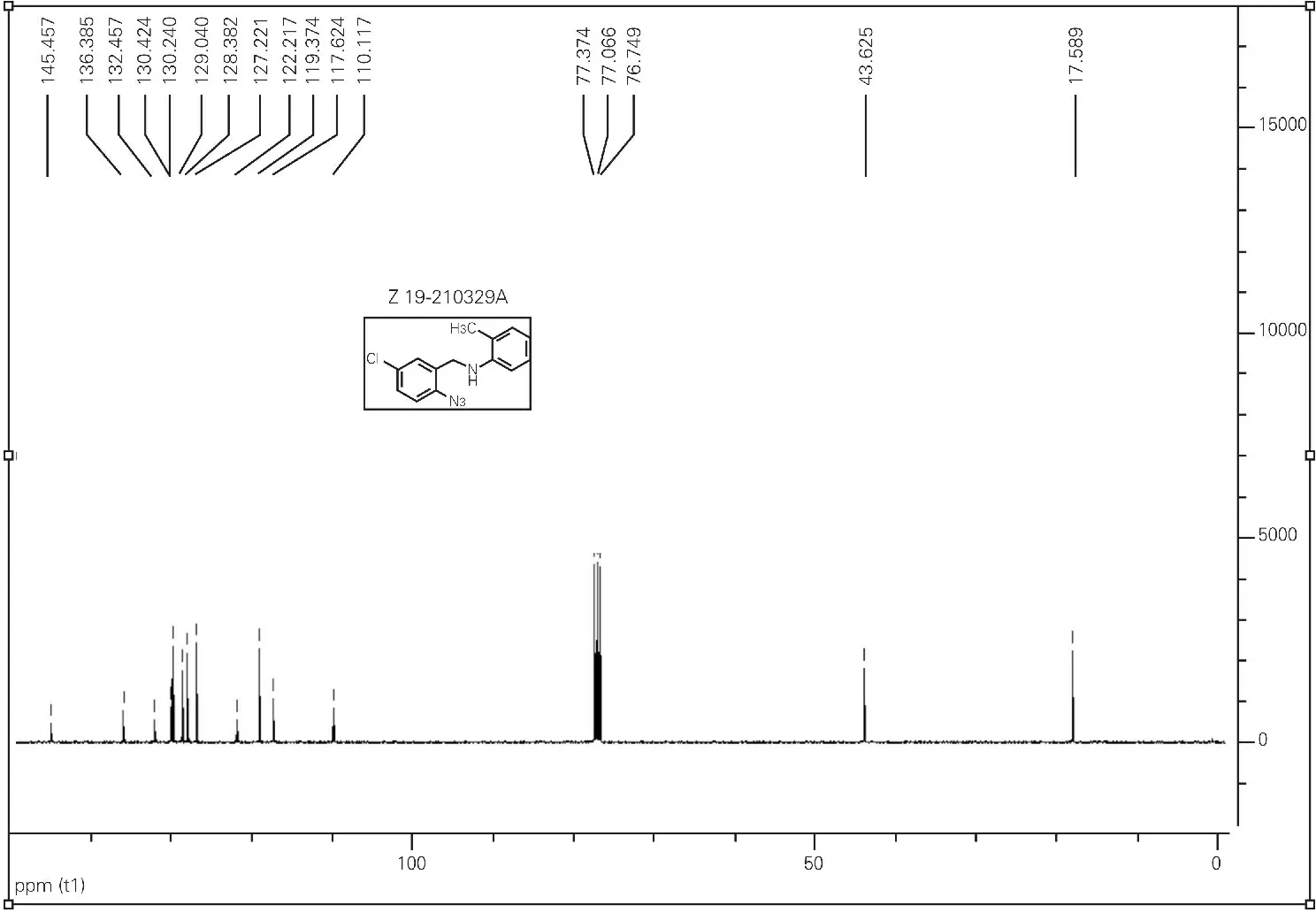
图6 代表性化合物1a的13C NMR谱图
四、结论
研究了一种通过邻氟苯甲醛的叠氮化反应和氨化还原反应“一锅法”合成N-芳基-2-叠氮基苄基胺类化合物的方法。邻氟苯甲醛叠氮化首先得到中间体邻叠氮苯甲醛。以NaHB(OAc)3为还原剂,中间体邻叠氮苯甲醛再和芳胺之间发生氨化还原反应得到相应的目标产物,最高收率可达95%。产物的结构通过1H NMR和13C NMR进行了表征。

