多系统萎缩的MRI特征:与帕金森病对比 *
(1. 广西钦州市第一人民医院, 广西 钦州 535000;2. 右江民族医学院附属医院,广西 百色 533000)
多系统萎缩(multiple system atrophy,MSA)是一种神经系统常见病、多发病;早期患者临床症状缺乏特异性,容易造成漏诊或误诊[1]。据不完全统计,MSA患者在早期被误诊为帕金森病(Parkinson’s disease,PD)的概率高达20%[2]。若能早期正确诊断MSA,近30%的患者服用左旋多巴后临床症状缓解明显[3]。因此,非常有必要对MSA及PD患者影像学表现进行鉴别诊断。磁共振成像(magnetic resonance imaging,MRI)软组织分辨率高,可以对MSA及PD患者脑实质进行成像并定量[4]。基于此,本文应用MRI技术对MSA及PD患者进行磁共振研究,并对比分析,以提高临床认识。
1 资料与方法
1.1一般资料 收集2019年5月—2021年5月本院临床确诊的MSA及PD患者各50例。本研究经过医院伦理委员会审批。病例纳入标准为:①MSA组均符合《多系统萎缩诊断标准中国专家共识》[5]中对“MSA”诊断标准。PD组均符合《帕金森病基层诊疗指南》[6]中对“PD”诊断标准;②年龄>18周岁,不限性别;③均为首次发病;④病历资料无缺失;⑤均已签署同意书。病例排除标准:①入组前接受过对症治疗者;②处于哺乳、妊娠期女性;③合并急慢性感染性疾病者;④合并狂躁症、幽闭恐惧症者;⑤中途从此研究退出者;⑥合并恶性肿瘤者;⑦合并脑卒中等疾病者;⑧合并艾滋病、梅毒等疾病者。MSA组纳入74例,PD组纳入66例,两组各随机抽取50例纳入研究;收集同期本院门诊体检的50例健康人员作为对照组。MSA组:男28例,女22例;年龄在42~79岁,平均(61.01±9.02)岁;病程在5~21个月,平均(13.71±3.52)个月;体重在43~79 kg,平均(61.60±8.33) kg。PD组:男27例,女23例;年龄在44~78岁,平均(61.11±9.64)岁;病程在5~20个月,平均(13.05±3.12)个月;体重在45~73 kg,平均(61.52±6.94) kg。对照组:男26例,女24例,年龄在47~74岁,平均(60.40±8.41)岁;体重在44~78 kg,平均(60.52±7.11) kg。3组病例在男女构成比、平均年龄、平均体重方面差异无统计学意义(P>0.05),具有可比性。
1.2扫描方法 MRI扫描设备采用3.0T Siemens Skyra 扫描仪;嘱患者平躺于检查床,头先进,常规性MRI轴位、矢状位、冠状位扫描。具体扫描参数:T1W1序列(TR 2110 ms,TE 11 ms,FOV 230×230 mm,矩阵320×320,层厚5.0 mm,间隔1.0 mm,带宽19.2 kHz,NEX 2),T2W1序列(TR 8000 ms,TE 98 ms,FOV 230×230 mm,矩阵320×320,层厚5.0 mm,间隔1.0 mm,带宽19.2 kHz,NEX 2),扩散加权成像序列(TR 4240 ms,FOV 220×220 mm,层厚5.0 mm,b=0、1000 s/mm2)。
1.3观察内容及测量方法 小脑中脚、脑桥T2W1高信号判定由两名晋升主治医师5年以上神经系统诊断医师单独进行,若意见不一致协商后决定。小脑中脚宽度、中脑面积、脑桥面积及壳核、桥脑、额叶白质ADC测量由1名晋升主治医师5年以上神经系统诊断医师进行测量,在固定部位反复测量3次,取平均值作为最后的测量结果。小脑中脚、脑桥T2W1高信号判定及面积、ADC测量均为小脑中脚、中脑、脑桥、壳核及额叶白质的中心层面,将测量3次的平均值作为最终结果。
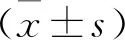
2 结果
2.1小脑中脚(MCP)、脑桥十字征(HCB) T2W1高信号征发生率对比结果 MSA组MCP、HCB T2W1高信号征发生率均高于PD组、对照组(P<0.05),见表1。
2.2小脑中脚宽度、中脑面积、脑桥面积对比结果 不同组间小脑中脚宽度差异有统计学意义,其中MSA组定量参数值均低于PD组及正常组(MSA组vs PD组,t=-5.540,P<0.001;MSA组vs 正常组,t=-5.520,P<0.001);PD组及对照组小脑中脚宽度差异无统计学意义(t=0.020,P=0.962)。不同组间

表1 MCP、HCB T2W1高信号征发生率对比
中脑面积差异有统计学意义,其中MSA组定量参数值均低于PD组及正常组(MSA组vs PD组,t=-23.340,P<0.001;MSA组vs 正常组,t=-23.901,P<0.001);PD组及对照组中脑面积差异无统计学意义(t=-0.560,P=0.819)。不同组间脑桥面积差异有统计学意义,其中MSA组定量参数值均低于PD组及正常组(MSA组vs PD组,t=-204.180,P<0.001;MSA组vs 正常组,t=-205.101,P<0.001);PD组及对照组脑桥面积差异无统计学意义(t=-0.920,P=0.870),见表2。

表2 3组小脑中脚宽度、中脑面积、脑桥面积对比结果
2.33组壳核、桥脑、额叶白质ADC值对比结果 MSA组壳核、桥脑、额叶白质ADC均高于PD组、对照组,两组比较差异有统计学意义(P<0.05),但PD组与对照组比较,差异无统计学意义(P>0.05),见表3。
表3 3组壳核、桥脑、额叶白质ADC值对比结果 (×103)
2.4MSA、PD影像学特征 MSA在MRI的特征为左侧桥臂异常高信号,ADC测值可见左侧桥臂与对侧信号相比较低,见图1A。PD在MRI的特征为存在黑质异常高信号,见图1B。
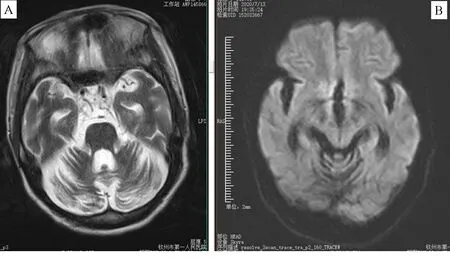
注:A为MSA的MRI图像,B为PD的MRI图像。
3 讨论
大部分MSA患者早期临床症状缺乏特异性,相关症状与PD临床表现极为相似,或者共济失调、椎体束征等症状出现时间比较晚,极易造成与PD误诊,导致患者病情进行性加重、恶化[7]。PD属于退行性神经病变,在中老年人群中的发病率较高,以黑质多巴胺能神经元进行性缺失为主要病理特征,早期PD患者症状不明显,单纯依靠病史不能对疾病作出准确的诊断,但当患者出现典型症状时,疾病已经发展到了晚期,错过了最佳治疗时机[8-9]。由于MSA与PD的治疗方案不同,故及早对两种疾病作出准确的诊断,对于改善患者预后意义重大。
本研究显示:MSA组MCP、HCB高信号征发生率均高于PD组、对照组。表明MSA患者MCP、HCB高信号征发生率均高于PD,可将其作为鉴别两种疾病的指标。分析如下:MCP、HCB高信号可以反映出脑桥核团以及脑桥核团通过小脑中脚发往小脑的横行纤维脱髓鞘、胶质细胞增生[10]。MCP、HCB高信号被认为是MSA的特征性表现[11]。由此可知,通过了解MCP、HCB是否为高信号,可作为鉴别诊断PD以及MSA的重要依据。
本研究显示,PD组小脑中脚宽度、中脑面积、脑桥面积均高于MSA组,但PD组与对照组比较无统计学差异。表明PD患者小脑中脚宽度、中脑面积、脑桥面积均高于MSA。分析如下:MRI扫描可知PD患者脑部组织变化程度比MSA患者明显,主要是由于PD患者脑桥核发出纤维变性,神经胶质增生,会增加含水量,但没有损害到小脑上角纤维[12-13]。故PD患者脑萎缩程度一般比MSA患者弱,临床可通过MRI检查对MSA与PD作出鉴别。本研究显示:MSA组壳核、桥脑、额叶白质ADC均高于PD组,但PD组与对照组比较无统计学差异,表明MSA患者壳核、桥脑、额叶白质ADC均比PD患者高,而PD患者与健康人群的差异性不大。分析如下:不论是何种类型的MSA,病变部位均与额叶白质有关,桥脑以及壳核也会出现持续性的退行性病变,进而导致ADC值增高[14-15]。但大多数PD患者在发病期间,脑桥、壳核、额叶白质并没有发生退行性病变,因此PD患者通过MRI检查所测量的ADC值与健康人群无较大差异性,所以MSA患者ADC值高于PD患者,从本研究也可知,MSA患者在发病时工作记忆、整体认知损害均比PD患者的重。
本研究存在一定不足,例如样本容量小、未展开不同分型MSA、PD研究、研究时限较短,对结果的普遍性、一般性、有效性有所影响,故仍旧需临床扩大样本容量,增加不同分型MSA、PD病例,延长研究时限,为评估MRI在MSA、PD鉴别诊断中的应用价值提供更多参考依据。
综上所述,MRI可对MSA与PD诊断与鉴别诊断有重要的应用价值,可提供客观形态学、功能学列影像学指标,为治疗方案的制定提供科学的参考依据,有较高临床应用前景。

