外泌体在肝细胞癌发生发展中的作用及潜在临床价值
罗业浩,许栋涵,吕 挺,赵铁建,汪 磊
1 广西中医药大学 壮医方药基础与应用研究重点实验室,南宁 530200;2 澳门科技大学 中医学院,澳门 999078; 3 湖北民族大学 医学部,湖北 恩施 445000;4 广西中医药大学 赛恩斯新医药学院,南宁 530200
肝细胞癌(HCC)是最常见的恶性肿瘤之一,在全球范围内,HCC是肝癌的主要类型,约占原发性肝癌的85%。死亡率居全球第三,每年死亡人数超过80万,生存期仅有3~6个月,5年生存率仅为6%[1],大多数HCC病例由于慢性肝病、肝硬化等危险因素导致,具有起病隐匿、发生发展迅速及死亡率高的特点[2]。因此,寻找有助于HCC早期诊断、治疗和预后判断的生物标志物至关重要。外泌体包含多种生物活性物质,如蛋白质、DNA、miRNA、lncRNA、mRNA、肿瘤基因和转录因子等,这些生物活性物质的水平与肿瘤侵袭力和肿瘤微环境有一定关系,可通过介导HCC的相关信号通路,加剧HCC的发生、发展[3]。外泌体有可能成为早期诊断HCC或转移的标志物,因此,充分了解外泌体对HCC进展的作用机制,对其早期诊断、治疗具有重要价值。
1 外泌体概述
1.1 外泌体的来源及包含成分 外泌体是大小在30~150 nm之间的小细胞外囊泡,是细胞外囊泡的一种亚型,通过在多囊泡体中内吞形成腔内囊泡。胞内多泡体可以与溶酶体融合,导致内容物降解,并且它们还与质膜融合,将内容物作为外泌体释放到细胞外空间,由所有细胞类型分泌并负责细胞间通讯[4]。外泌体由包括肿瘤细胞在内的各种身体组成细胞[如红细胞、血小板、淋巴细胞、巨噬细胞、脂肪组织来源的间充质干细胞(adipose tissue-derived mesenchymal stem cells,AMSC)、成纤维细胞及肿瘤细胞间质细胞等]分泌,广泛存在于人体的血液、唾液、尿液、腹水和脑脊液中。外泌体包含了蛋白质、脂质和核酸等生物大分子,如mRNA、miRNA等[5]。
1.2 外泌体的生物学功能 外泌体的功能取决于其来源的细胞类型。一般来说,外泌体可参与包括细胞通讯、免疫反应、细胞迁移、细胞分化、肿瘤侵袭和血管生成在内的多种生理和病理过程[6]。主要是由于其具有脂质双分子层的结构特征,能够有效保护其内容物的活性,方便其在细胞间穿梭以促进细胞间的通讯。外泌体可以与特定的受体结合,通过释放囊泡内容物的方式进行信息传递,携带的各种细胞因子和蛋白质在细胞与其微环境之间的细胞间通信中起关键作用,为癌细胞的生存和生长提供合适的环境[7]。
外泌体可以作为载体启动抗癌免疫反应,也可以运输癌蛋白和免疫抑制分子以破坏宿主免疫系统并有利于肿瘤的微环境,帮助癌细胞免疫逃逸[8]。研究表明,HepG2细胞的外泌体激活脂肪细胞中的几种激酶和NF-κB,并促进炎症细胞因子的分泌、肿瘤生长和迁移、血管生成和炎症浸润。一旦肿瘤病灶太大而无法获得足够的营养,肿瘤微环境就会发生坏死和炎症并诱导血管生成[9]。
2 外泌体在HCC发生、发展中的作用
外泌体参与HCC的形成和发展,包括重塑肿瘤微环境、细胞间通讯、免疫调节、细胞分化、迁移和侵袭、血管生成和耐药性等,对HCC具有双向作用(图1)。
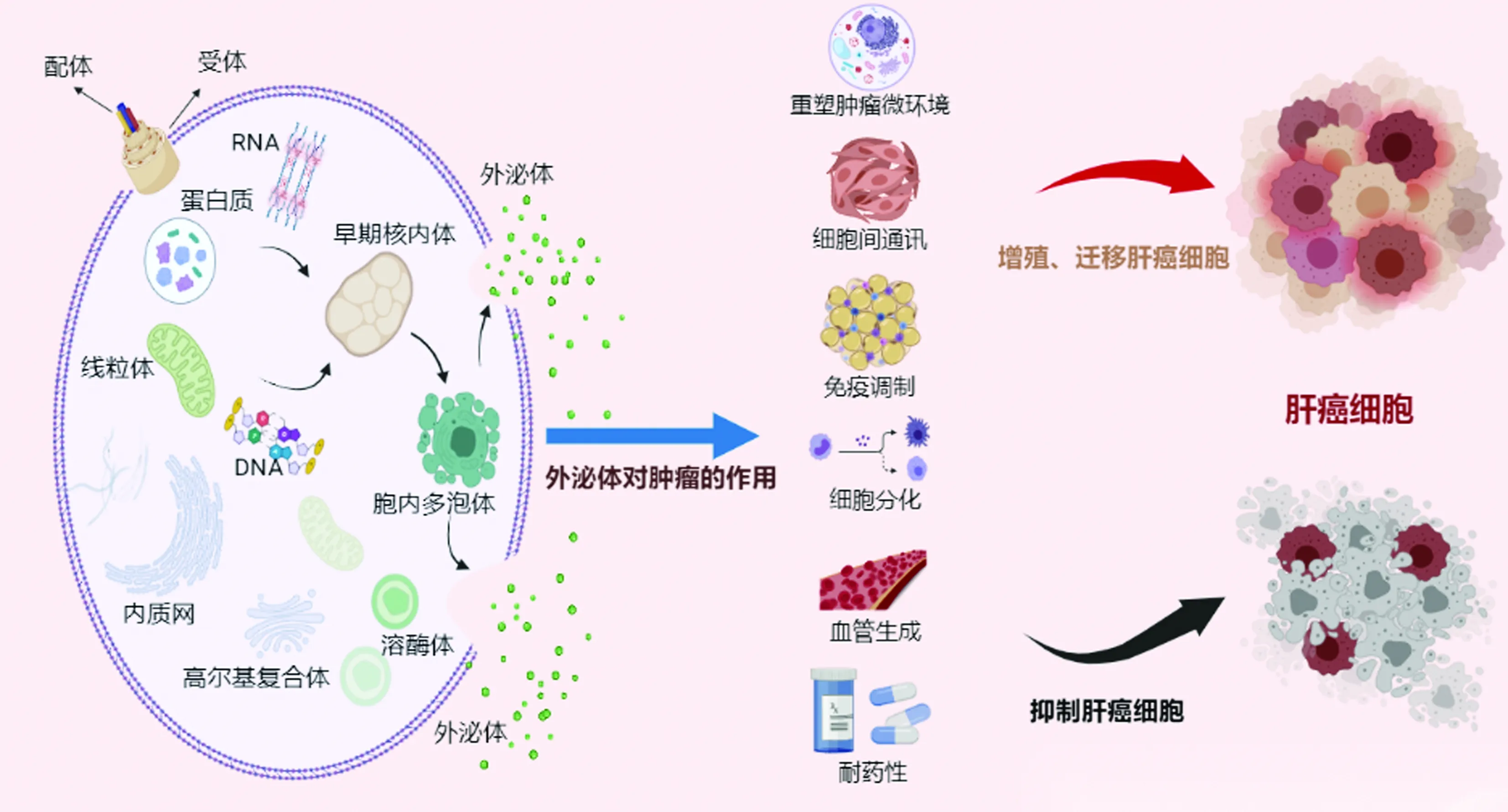
图1 外泌体的组成及参与HCC的形成和发展
2.1 外泌体通过影响微环境促进肝癌的增殖、迁移 在HCC的进展过程中,具有致癌特性的外泌体逐渐超过了抑制肿瘤的外泌体,并最终将微环境转变为致瘤性。这些外泌体促进肿瘤启动、血管生成、上皮细胞间质转化 (epithelial-mesenchymal transition,EMT)、基质重塑和免疫调节,它们协同支持肿瘤进行增殖和迁移[10]。研究表明,外泌体的分泌有可能是协调肿瘤异质性的一种机制,促进具有不同基因型细胞的协同作用,刺激表观遗传变异和支持转移克隆的生长。研究[11]显示,HCC 患者血清外泌体miRNA-665水平显著升高,与肿瘤大小、临床分期、局部侵袭和转移呈正相关。如MET原癌基因可以被肝细胞内化,然后通过激活 PI3K/AKT和MAPK信号通路以及基质金属蛋白酶 2(MMP-2)和 MMP-9 的过度表达,显著促进非运动肝细胞的迁移和侵袭[12]。含MHC-Ⅰ分子和热休克蛋白的肿瘤来源的外泌体增强了骨髓基质细胞的抗肿瘤活性。当在体外用肿瘤来源的外泌体脉冲时,骨髓基质细胞可以促进同源HCC的迁移。
HCC细胞来源的外泌体也可以改变微环境来促进癌细胞的增殖和转移。Vps4A 是外泌体释放的关键调节因子,可能在肝癌细胞中充当肿瘤抑制因子。它降低了细胞对外泌体的反应,抑制了外泌体的生物活性,并增强了外泌体致癌miRNA的释放。更重要的是,PI3K/Akt 信号通路被认为是Vps4A相关miRNA最有可能的靶通路[13]。肥大细胞在肿瘤微环境中富集,也促进肿瘤的发生和发展。肥大细胞显著增强肝癌细胞的增殖、迁移和侵袭,主要由HCV-E2刺激的肝癌细胞产生的外泌体将lncRNA FAL1传递给Huh7和HepG2细胞来发挥作用[14]。而蛋白质在HCC的发展中也起着重要作用。Vasorin (VASN)是一种Ⅰ型跨膜蛋白,已被证实可促进细胞增殖和迁移[15]。实验[16]证明,由HepG2分泌的外泌体转运的VASN有效地促进了人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)的迁移。CD90+肝癌细胞分泌的外泌体将lncH19转移到 HUVEC,导致血管生成并促进细胞间黏附,从而改变微环境促进HCC的发展。
2.2 外泌体通过靶向内皮细胞促进肝癌血管生成 肿瘤细胞可以通过释放外泌体中的内容物来调节内皮细胞的行为,进而增加血管通透性,促进血管生成,导致肿瘤转移和生长。miRNA-103 在肝癌细胞的外泌体中明显增加并可以被递送到内皮细胞,导致内皮完整性破坏以及血管通透性增加,最终促进 HCC 转移,其机制与抑制miRNA-103表达膜相关黏附分子,如VE-钙粘蛋白 (VE-Cad)、p120-连环蛋白 (p120)和封闭小带1 (ZO-1)有关[17]。HCC细胞来源的外泌体中miRNA-210、ephrin-B2、Delta-like 4 配体 (DLL4)、血管生成素-2 (ANGPT2)、circ-100338 和 VASN等6种物质被上调,并且证实与活性内皮依赖性血管生成有关。miRNA-210可以通过外泌体进入内皮细胞,然后miRNA-210直接靶向SMAD4和STAT6并下调它们的表达,从而促进内皮细胞的小管形成,最终导致肿瘤血管生成[18]。一项研究[19]发现ephrin-B2和DLL4的高表达水平是通过Notch信号通路的上调所实现的,可以使其通过外泌体进入内皮祖细胞并促进肿瘤血管生成。在HCC细胞分泌的外泌体表面检测到高水平的ANGPT2可以将其输送到内皮细胞,促进内皮细胞的血管生成。此外,肝癌细胞分泌的外泌体中检测到高水平的circ-100338,它可以被输送到内皮细胞,circ-100338不仅促进内皮细胞增殖和血管生成,还增加了血管通透性[20]。在肝癌细胞的外泌体检测出高水平VASN,它可以通过硫酸肝素蛋白聚糖 (HSPG)介导的内吞作用传递到内皮细胞中,促进内皮细胞迁移,导致血管生成而进一步促进肝癌的发生与发展[21]。
与上述上调的物质相反,部分外泌体中也有一些被下调的物质。研究[22]发现C型凝集素域家族3成员B (CLEC3B)在肝癌细胞分泌的外泌体中被检测到具有低水平并且可以被递送到内皮细胞,这可能导致AMP活化蛋白激酶(AMPK)下调信号通路,与内皮细胞中血管内皮生长因子 (vascular endothelial growth factor,VEGF)水平的增加有关,高水平的VEGF增强血管生成,最终促进肿瘤进展。另一项研究[23]表明,肝癌细胞分泌的外泌体中miRNA-200b-3p低表达,同样可以被递送到内皮细胞中,低水平的miRNA-200b-3p通过上调转变为增强内皮细胞的血管生成能力相关的基因。
2.3 外泌体调节EMT促进肝癌的转移 EMT是癌症远处转移的第一步。EMT定义为细胞失去上皮标志物(如 E-钙粘蛋白)并获得间充质细胞标志物(如 N-钙粘蛋白)的过程[24]。肿瘤细胞通过EMT过程获得移动性和侵袭性,从而发生转移。已经发现间充质干细胞(mesenchymal stem cell,MSC)衍生的外泌体在许多不同癌症类型的相邻上皮细胞中诱导EMT[25]。癌相关成纤维细胞(carcinoma-related fibroblasts,CAF)衍生的外泌体中miRNA-320a的缺失促进了EMT和HCC转移。HCC衍生的外泌体将miRNA-92-3p转运至受体细胞,从而通过PTEN/Akt 通路的调节促进EMT和低转移性HCC细胞向高转移性HCC细胞的转化[26]。含碱性成纤维细胞生长因子的外泌体通过激活AKT/GSK-3β/Snail/Twist1 信号通路诱导EMT和肝癌细胞的转移。研究[27]证实,CTHRC1 mRNA与肿瘤大小和分期、微血管侵犯和肝内转移呈正相关。CTHRC1的外泌体通过PI3K/Akt/ERK/CREB/Snail/TGFβ/MMP2信号传导抑制胶原蛋白Ⅰ并刺激HCC细胞和EMT的迁移。在HCC组织中,lncRNA-CCAL过表达与较大的肿瘤、晚期 pTNM 分期和低凋亡率相关,它通过Wnt/β-catenin通路激活诱导EMT,从而促进肝癌细胞迁移[28]。在肺转移生态位中,由高转移性HCC细胞释放的外泌体miRNA-1247-3p下调成纤维细胞中的β-1,4-半乳糖基转移酶Ⅲ的表达,激活β1-整合素-NF-κB 信号并进一步促进肝癌的肺转移[29]。
3 外泌体在HCC中潜在的临床应用价值
3.1 外泌体在HCC诊断和预后判断中的应用 由于外泌体中的RNA不受血液中降解酶的影响,而裸露的RNA会迅速降解,血清和血浆miRNA已被研究作为癌症诊断和治疗中有价值的生物标志物[30]。例如人食管鳞状细胞癌血清外泌体miRNA-21显著高于良性疾病,血清外泌体miRNA水平高于非外泌体miRNA。其次,外泌体反映了它们的起源组织,因为它们可以使用针对膜表面组织特异性蛋白的抗体进行免疫分离[31]。事实上,血清外泌体miRNA与肿瘤衍生的miRNA相关。有文献[32]指出,与慢性乙型肝炎或肝脏相关慢性疾病相比,HCC患者血清中外泌体miRNA-18a、miRNA-221、miRNA-222和miRNA-224的水平显著较高,而miRNA-101的水平较低。HCC患者的血清外泌体miRNA-1247-3p较正常人的升高,较高水平的血清外泌体miRNA-1247-3p提示HCC的肺转移预后较差。miRNA-1247-3p有望成为诊断HCC有价值的生物标志物,尤其是预测HCC肺转移方面[33]。活体肝移植后,与未复发的HCC患者相比,复发的HCC患者其miRNA-718显著降低。然而,仅有miRNA-718与临床病理因素相关。低表达miRNA-718显示出组织学分化较差、肿瘤发生率较高和肿瘤更大的相关特点[34]。不仅如此,外泌体miRNA-106b、miRNA-122和miRNA-195的水平在HCC血清中低于肝硬化。数据[35-36]表明,miRNA-10b和miRNA-21在HCC进展过程中增加,而miRNA-122、miRNA-218和miRNA-200a在外泌体中减少。ROC曲线分析显示,AFP、miRNA-10b、miRNA-21、miRNA-122和miRNA-200a组合诊断HCC,其ROC曲线下面积达0.993,可以被认为是一种优越的早期诊断HCC的方法。上述结果表明,外泌体miRNA可能成为诊断和预测HCC复发及治疗效果的新型生物标志物。
此外,外泌体miRNA-665过表达时HCC患者表现出更短的生存时间,这表明外泌体miRNA-665可作为HCC患者潜在的预后生物标志物[37]。血清外泌体miRNA-638在HCC患者中下调,其与生存期呈正相关,miRNA-638水平偏低,可预测HCC患者的总生存期较短[38]。血清中外泌体miRNA-125b水平与肿瘤增殖、分化和TNM分期显著相关,外泌体衍生的miRNA-125b水平显著高于HCC患者血清中的水平,而且miRNA-125b水平较低的HCC患者其总生存期和复发率较短[39]。外泌体miRNA-125b可以作为HCC患者的预后标志物。
外泌体CASC9和LUCAT1在HCC衍生细胞系的一个子集中上调,两者都与HCC患者术后的肿瘤大小和复发有关[40]。
3.2 外泌体在HCC治疗中的应用 早期 HCC 最常用的治疗方法主要是手术切除、肝移植和介入放射学。然而,大多数HCC患者被诊断时已是晚期,预后差。经肝动脉化疗栓塞术是多结节中期 HCC患者的一线治疗方法,但由于缺氧和代偿性血运重建,其效果欠佳。索拉非尼是晚期 HCC唯一的全身用药,但容易产生耐药性[41]。
来自HCC细胞的外泌体通过激活HGF/c-Met/Akt通路在体外增强了肝癌细胞对索拉非尼的抵抗力,并逆转了索拉非尼诱导的HCC细胞凋亡。此外,与侵袭性较低的HCC细胞来源的外泌体相比,高侵袭性HCC细胞来源的外泌体在逆转索拉非尼诱导的细胞凋亡方面具有更大的作用[42]。脂肪组织来源的AMSC 将miRNA-122包装成分泌的外泌体,然后外泌体在体外将miRNA-122递送到HCC细胞中,介导AMSC和HCC细胞之间的通讯。而且,miRNA-122修饰的AMSC衍生的外泌体通过增加细胞周期停滞和凋亡来增强HCC细胞的化学敏感性,从而促进索拉非尼对HCC细胞的敏感性[43]。miRNA-335-5p可以通过成纤维细胞释放的外泌体被HCC细胞摄取。作为HCC的肿瘤抑制因子,miRNA-335-5p抑制HCC细胞的生长、增殖、侵袭和凋亡[44]。miRNA-320a被转移到HCC细胞,然后通过抑制PBX3表达和MAPK通路激活来抑制HCC细胞增殖、迁移和转移。外泌体miRNA-9-3p在HCC中减少,并通过靶向成纤维细胞生长因子5 (fibroblast growth factor 5,HBGF-5)影响细胞增殖,HBGF-5也可能是HCC的潜在治疗靶点[45]。
越来越多的研究表明,外泌体衍生的相互作用可以调节耐受性和免疫抑制性微环境,外泌体能够在体内诱导特定的细胞毒性T淋巴细胞(cytotoxic T lymphocytes,CTL),并以T淋巴细胞依赖性方式抑制肿瘤的生长[46]。研究[47]表明,肿瘤细胞衍生的外泌体 (tumor exosomes,TEX)可以有效地将HCC抗原携带到树突细胞,导致比癌细胞裂解物更强的免疫反应。TEX脉冲树突细胞 (DC TEX)与细胞裂解物脉冲的树突细胞相比,显著抑制了异位和原位HCC小鼠的肿瘤生长。此外,在原位HCC小鼠中,DC TEX治疗通过增加IFNγ和T淋巴细胞,降低肿瘤部位的TGFβ和IL-10来改善免疫和肿瘤微环境。5-Aza-2′-脱氧胞苷 (5-Aza-CdR)是一种DNA去甲基化启动子,可提高 HLA-Ⅰ和 HLA-Ⅱ等免疫分子的表达。用5-Aza-CdR处理后的HepG2和Hep3B细胞的外泌体分泌增加[48]。抗肿瘤细胞免疫所需的HSP70、HLA-Ⅰ和NY-ESO-1蛋白在这些外泌体中均升高,这可能是通过刺激抗肿瘤特异性免疫应答导致的。这些蛋白质可能为HCC免疫疗法提供新的治疗选择[49]。癌症免疫治疗的目的是促进细胞内CTL的活性,协助淋巴器官中肿瘤特异性CTL的启动,建立有效持久的抗癌免疫。在免疫治疗中,通过保证CD4+T淋巴细胞向CD8+T淋巴细胞的信号传递和调节T淋巴细胞的代谢活动,可以优化CTL反应,从而增强抗癌免疫[50]。
4 小结与展望
在肿瘤发生发展过程中,外泌体的mRNA、miRNA、lncRNA和蛋白质等在细胞间转移可改变肿瘤微环境、新生血管生成,使HCC发生增殖、侵袭和转移。相反,外泌体同样可调节各种生理和病理过程,也可用作癌症治疗的药物载体,对于HCC的诊断、预后标志物及治疗起到重要的作用。外泌体膜的修饰可以增加外泌体对特定病变的趋化性。因此,外泌体可以直接有效地将抗肿瘤药物递送至HCC 组织并阻止HCC的进展[51]。但是,外泌体在HCC诊断和治疗中的临床应用还需要进一步研究,因为当前外泌体提炼技术尚未成熟,仍迫切需要改进有效的外泌体分离、纯化和储存技术以更好地应用于临床。在HCC中,大多数研究仍然集中于血液中的外泌体。在今后研究中,外泌体在HCC患者腹腔积液或胆汁中的检测技术将是有潜力的可开发领域。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:罗业浩负责课题设计,资料分析及撰写论文;许栋涵、吕挺参与收集数据及修改论文;赵铁建、汪磊负责拟定写作思路,指导撰写文章并最后定稿。

