TIGIT在自身免疫性肝炎免疫机制中的作用及治疗前景
韩 琳,张明月,2,孙 颖,2
1 解放军总医院第五医学中心 肝病医学部肝病科,北京 100039; 2 解放军医学院 研究生院,北京 100039
自身免疫性肝炎(autoimmune hepatitis,AIH)在欧美国家发病率较高[1],随着对其认识不断深入和自身抗体检测及肝穿刺活检广泛开展,我国AIH检出率亦呈现逐年升高的趋势。
AIH的发病机制尚未完全阐明,免疫耐受失衡在自身免疫性肝病的发生、发展过程中发挥着重要作用[2]。通过糖皮质激素抑制机体免疫功能是目前AIH治疗的主要策略,但是长期使用可引起一系列不良反应,从而限制了其在AIH治疗中的广泛应用。调节性T淋巴细胞(Treg)参与AIH的发生、发展过程[3],T淋巴细胞免疫球蛋白和免疫受体酪氨酸抑制基序(immunoreceptor tyrosine-based inhibitory motif,ITIM)结构域(T cell immunoglobulin and ITIM domain,TIGIT)是Treg发挥免疫抑制功能的重要分子,TIGIT+Treg能够选择性抑制辅助性T淋巴细胞(Th)1和Th17的促炎反应。本文旨在介绍TIGIT+Treg对AIH的免疫调控机制,为获得无糖皮质激素的治疗优化方案提供思路。
1 Treg在AIH免疫机制中的作用
目前认为AIH的发生主要是基于T淋巴细胞介导的肝细胞损伤、免疫细胞调节失衡以及免疫耐受缺失使机体对外来抗原的免疫应答缺陷3个方面。发挥促炎作用的Th17和抗炎作用的Treg在维持免疫稳态和预防自身免疫性疾病中发挥着重要作用[4],二者的失衡是AIH发病的免疫学基础之一。肝脏微环境中各种免疫细胞和非免疫细胞形成相互作用的网络,Treg分泌的免疫抑制性细胞因子能够抑制效应性细胞的增殖和功能,当Treg数量减少或功能缺陷时[4],调节性细胞因子的分泌减少,对其他细胞的抑制作用也同时减弱,引起机体免疫耐受失衡,产生针对肝脏抗原成分的异常免疫攻击,导致肝内进行性的炎症、坏死及纤维化而诱发AIH[5]。Treg的缺陷影响肝脏炎症的严重程度[4],Th17和Treg之间的失衡与AIH的免疫损伤密切相关[6]。促进Treg数量及功能的恢复有助于AIH免疫耐受的重建,这为AIH的临床治疗提供了重要线索。
2 Treg的调控
2.1 TIGIT及其功能 作为共抑制信号分子的TIGIT是免疫球蛋白超家族成员之一,在固有免疫和适应性免疫中均发挥重要的抑制作用。TIGIT主要表达于Treg,还可表达在活化性、记忆性T淋巴细胞亚群和自然杀伤(NK)细胞上[7]。程序性细胞死亡蛋白1(programmed death-1,PD-1)与TIGIT的表达模式高度一致,70%以上TIGIT阳性细胞表达PD-1,90%以上PD-1阳性细胞TIGIT阳性。TIGIT的配体CD155、CD112主要表达于单核细胞、树突状细胞和多种非造血组织[5]。TIGIT能够与共刺激分子CD226竞争性结合配体CD155或CD112,从而抑制T淋巴细胞和NK细胞活化。当TIGIT在Treg上表达时,可增强Treg抑制免疫细胞的活性。
2.2 TIGIT信号通路对Treg的调控作用 在健康人群体内78.1%的Treg可表达TIGIT,占CD4+TIGIT+T淋巴细胞总数的26.9%[8]。TIGIT+Treg比TIGIT-Treg具有更强的抑制能力,能够选择性抑制具有促炎作用的Th1和Th17的免疫反应。在Treg中,TIGIT可通过直接诱导抑制性介质的产生和间接增强Treg的抑制功能来发挥免疫抑制作用,维持抑制功能的稳定性。TIGIT主要通过3种不同途径选择性抑制Th1和Th17自身反应性T淋巴细胞应答[9]。(1)直接抑制:TIGIT与TIGIT受体(poliovirus receptor,PVR,即CD155)结合后,通过其细胞内尾部的ITIM和/或免疫球蛋白尾部酪氨酸基序发出信号,直接抑制T淋巴细胞活化和增殖。(2)间接抑制:TIGIT在效应性T淋巴细胞(T effector cell,Teff)和Treg表达后能够吸引抗原呈递细胞,并与其表面的PVR结合,结合后可诱导抗原呈递细胞分泌IL-10,进而抑制抗原呈递、减少共刺激分子表达,降低促炎细胞因子分泌,并进一步促进IL-10分泌。(3)TIGIT能够以高亲和力与PVR结合,同时破坏CD226的同型二聚化,进而抑制CD226信号传导。
3 TIGIT在自身免疫性疾病发生、发展及治疗中的作用
TIGIT+Treg参与了多种自身免疫性疾病的发病机制。在具有肾损伤表现的系统性红斑狼疮患者中,TIGIT+T淋巴细胞频率显著下降[10]。在自身免疫性肾小球肾炎患者中,TIGIT可通过增强Treg功能和促进IL-10的分泌发挥免疫抑制功能,从而减轻肾小球肾炎的自身免疫反应。在类风湿性关节炎中,疾病活动与CD4+T淋巴细胞的TIGIT表达呈负相关,患者关节液中TIGIT+CD4+T淋巴细胞频率在疾病活动期显著低于非活动期,且活动期患者关节液中CD4+T淋巴细胞上TIGIT的表达明显下调,当诱导TIGIT表达后,CD4+T淋巴细胞的增殖则显著被抑制,同时IFNγ及IL-17分泌下降,IL-10的分泌增加,从而发挥抑制外周血T淋巴细胞的作用。在小鼠狼疮模型的研究[11]中发现,重组TIGIT-Ig能够有效地预防和治疗小鼠狼疮,经TIGIT-Ig处理的狼疮小鼠,其出现蛋白尿的时间延迟,存活率显著增加。在原发性胆汁性胆管炎(primary biliary cholangitis,PBC)患者中,TIGIT+CD8+T淋巴细胞频率与肝功能指标中的TBil、DBil、TBA、GGT、ALP呈负相关,与血小板水平呈正相关,当TIGIT呈高表达时,可抑制CD226信号传导,从而降低CD226+CD8+T淋巴细胞亚群活性,缓解疾病的活动状态[12]。与TIGIT+Treg的抑制作用相反,当TIGIT在外周血滤泡辅助性T(follicular helper T,Tfh)淋巴细胞表达时,则能够辅助B淋巴细胞调控抗体的产生。Akiyama等[13]研究发现IgG4相关性疾病(IgG4 related disease,IgG4-RD)患者外周血TIGIT+Tfh细胞较TIGIT-Tfh细胞能够表达更多的IL-21,在B淋巴细胞分化和细胞毒性T淋巴细胞的活化中均发挥着重要作用,TIGIT+Tfh与IgG4-RD活动性呈正相关,但是经过糖皮质激素治疗后,外周血TIGIT+Tfh细胞频率呈现显著下降。作为共抑制信号分子,TIGIT在上述自身免疫性疾病发生、发展及治疗中的作用表明,该分子在治疗自身免疫性疾病方面具有很大的潜力,靶向TIGIT抑制异常免疫反应有望成为一个新的治疗方法。
4 TIGIT+Treg在AIH治疗中的应用前景
4.1 TIGIT单抗的肿瘤免疫治疗对AIH治疗的启示 自身免疫性疾病是肿瘤的一种镜像,它们的作用虽相反,但分子机制却相似。免疫反应是受抗原呈递细胞和Teff之间传递的免疫刺激信号及免疫抑制信号的协同作用所调节,肿瘤细胞主要利用触发Teff抑制通路的受体或配体,如TIGIT、程序性死亡配体1、PD-1、细胞毒性T淋巴细胞相关抗原4、CD155,使这种相互作用更趋于免疫抑制,而自身免疫性疾病则趋于免疫活化。在不同小鼠模型中,基因敲除或使用抗体阻断T淋巴细胞表面的TIGIT,能够增强T淋巴细胞的抗肿瘤活性[14]。TIGIT在肝癌患者CD4+T淋巴细胞和Treg上呈高表达,其表达水平与肿瘤分化程度呈负相关,与甲胎蛋白水平及疾病进展和不良预后呈正相关。在肝癌的发病过程中,PD-1+TIGIT+T淋巴细胞群的增殖速度加快,而肝癌的恶性程度与该细胞频率呈正相关。阻断TIGIT的表达能够促进T淋巴细胞受体的表达,增强T淋巴细胞活性,从而恢复免疫系统对肿瘤的抑制作用。
4.2 TIGIT有望突破AIH治疗的瓶颈问题 糖皮质激素是目前AIH治疗的一线药物,主要通过与糖皮质激素受体等结合上调Treg,抑制机体免疫功能[15],从而恢复机体失调的免疫稳态[16],缓解AIH病情,控制疾病进展。但激素治疗仍存在很多问题,部分患者因存在激素治疗禁忌证,或因激素治疗中出现严重不良反应而限制其使用[17],即使对于能够使用激素治疗的患者,仍有约13%的应答不佳而无法缓解疾病进程,而激素应答良好的患者,亦存在停药反弹的风险,甚至需要长期使用糖皮质激素治疗。研究显示,采用Treg过继性免疫疗法有助于治疗自身免疫性疾病(表1),然而Treg与Teff中某些信号通路相互冲突,单用Treg治疗不足以诱导机体免疫耐受的重建[26]。
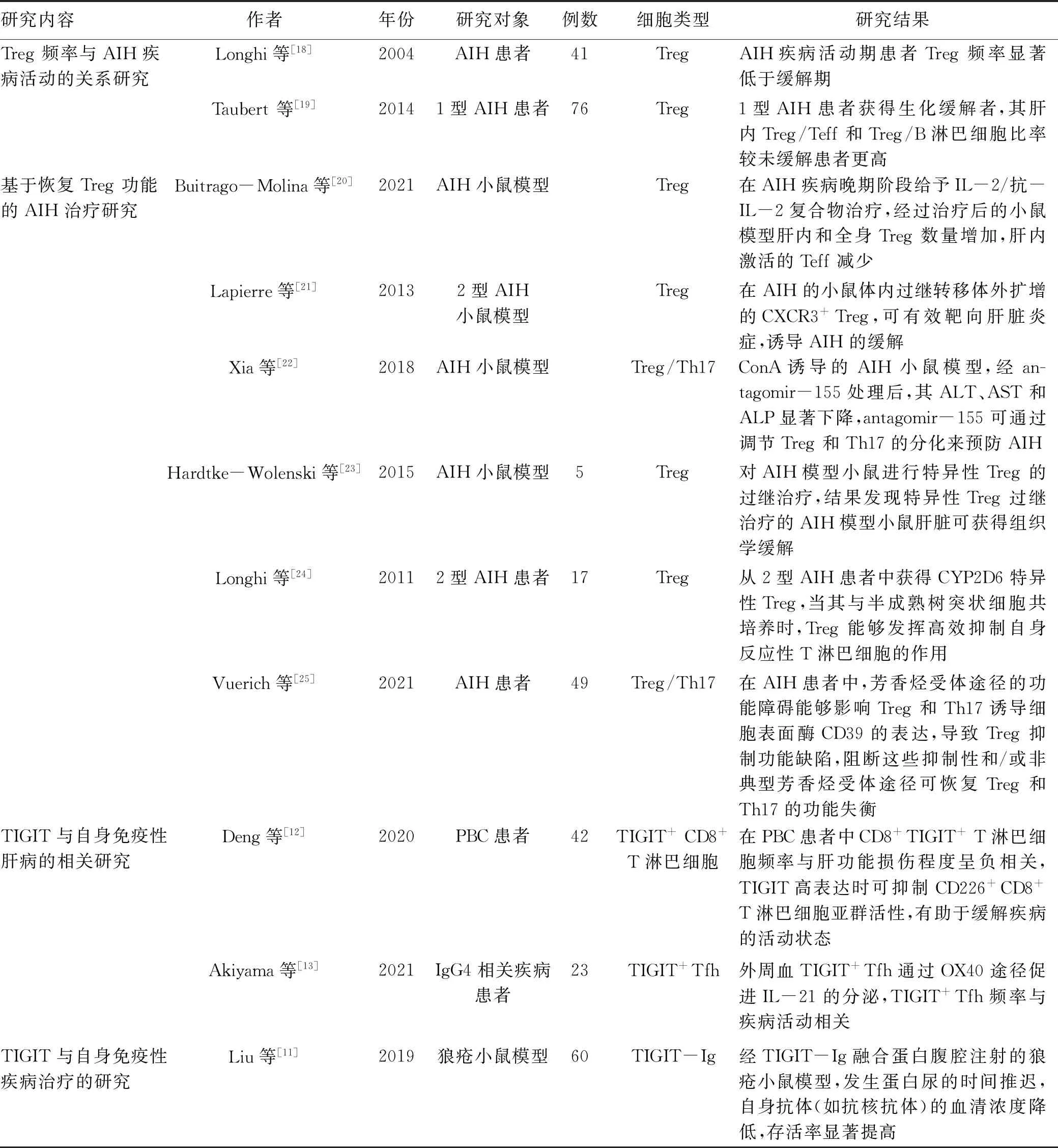
表1 Treg及TIGIT与自身免疫性肝病治疗的相关研究
TIGIT+Treg较TIGIT-Treg具有更强的免疫抑制作用,TIGIT可通过抑制Treg活化而控制自身免疫反应、纠正自身免疫Treg的缺陷[27]。调控TIGIT的表达,可诱导Treg的分化,使机体免疫耐受重建,进而使疾病获得缓解。综上所述,TIGIT可能成为一个潜在的AIH治疗候选靶点,将为AIH免疫治疗研究提供思路和方向。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:韩琳、张明月负责资料分析,撰写论文;孙颖负责拟定写作思路,指导撰写文章并最后定稿。

