多房棘球蚴分泌物抗原对脂多糖诱导小鼠骨髓来源的树突状细胞表型及功能的影响
李文登,李超群,胡 旺,徐 凯,庞明泉,乜 茹,冯浩杰,张占红,刘处处,樊海宁
青海大学附属医院 肝胆胰外科,青海省包虫病重点实验室,西宁 810000
多房棘球蚴病(alveolar echinococcosis,AE)又称泡型包虫病,是由多房棘球蚴绦虫(echinococcus multilocularis,Em)的幼虫通过感染动物传染给人类的一种人畜共患病,在世界范围内造成严重的健康问题,特别是在资源有限的地区或国家[1],目前被世界卫生组织列为被忽视的热带病[2]。AE主要侵犯肝脏,是一种慢性、破坏性的临床疾病,其生长特征是Em向邻近器官和组织进行性浸润性增殖,类似于转移性肿瘤,晚期可转移至身体的其他部位,如不及时治疗,病死率极高[2-3]。Em之所以能够长期寄生在宿主体内是其进化成一套完整的免疫调节系统,能够调节机体的免疫微环境,达到长期寄生的目的。树突状细胞(DC)是体内最强的抗原递呈细胞,在寄生虫感染的免疫应答和免疫耐受过程发挥着重要的作用。前期的研究表明[4-5]感染Em的患者体内DC的成熟度降低,抑制抗原信号的递呈,机体内的初始T淋巴细胞(naive T cell,Tn)不能分化和增殖,因此达不到清除病原体的作用,但具体是Em中哪种物质影响DC的表型和功能还不明确。本研究通过建立脂多糖(LPS)诱导的小鼠骨髓来源的树突状细胞(BMDC)的炎症模型,检测不同浓度Em的分泌物抗原(Echinococcus multilocularis secreted antigen,Em-sAg)干预BMDC后,BMDC表达的主要组织相容性抗原复合体Ⅱ(major histocompatibility complex class Ⅱ,MHC-Ⅱ)、共刺激分子CD80、CD86及IL-12p70分泌情况,初步探讨Em-sAg对LPS诱导的BMDC的表型和功能的影响,为阐明Em的长期寄生宿主体内及其致病机理提供理论依据。
1 材料与方法
1.1 实验动物 6~8周龄SPF级健康C57BL/6J雄性小鼠和BALB/C雄性小鼠分别购自北京华阜康生物科技股份有限公司[生产许可证编号:SCXK(京)2019-0008]和斯贝福(北京)生物科技有限公司[生产许可证编号:SCXK(京)2019-0010],实验过程中对动物的处置符合动物伦理学标准(实验动物使用许可证分别为110322200101999818和110324210101017771)。
1.2 主要试剂及仪器 小鼠重组粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)购自美国PeproTech公司,RPMI-1640细胞培养基购自美国Gibco公司,胎牛血清(FBS)购自美国BI公司,LPS购自美国Sigma公司。异硫氰酸荧光素 (fluorescein isothiocyanate,FITC)标记的抗 CD80 抗体(CD80-FITC)、藻红蛋白 (phycoerythrin,PE )标记的抗CD86抗体(CD86-PE)、别藻蓝蛋白(allophycocyanin,APC)标记的抗主要组织相容性复合体Ⅱ(major histocompatibility complex Ⅱ,MHC-Ⅱ)抗体(MHC-Ⅱ-APC)均购自美国Thermo公司,PerCP-Cy5.5-CD11c购自TONBO公司。IL-12p70 ELISA试剂盒购自欣博盛科技有限公司。BCA蛋白浓度测定试剂盒购自美国Thermo公司,磷酸盐缓冲液(PBS)购自塞维尔科技有限公司,青/链霉素购自索莱宝科技有限公司。超净工作台购自苏州净化设备有限公司,流式细胞仪购自BD公司,正倒置荧光显微镜购自ECHO公司。
1.3 Em-sAg的获取及其浓度测定 将本实验室保存的蒙古沙鼠(长爪沙鼠)脱臼断颈处死,浸泡于75%乙醇10 min,无菌超净台上逐层解剖皮肤、肌肉组织,分离出腹腔内AE病灶组织,用无菌PBS进行冲洗2~3次,使用80目的滤网进行过滤去除组织碎片,并用0.4% 台盼蓝染色3 min,倒置相差显微镜下观察原头节活性和数量,并以2000枚原头节/只接种于30只小鼠BALB/C小鼠。3个月后将小鼠脱臼猝死,用1 mL的注射器抽取囊泡内的液体,用0.22 μm的无菌滤头进行过滤除菌,再用BCA蛋白定量法进行浓度测定,-80 ℃保存备用。
1.4 小鼠BMDC的提取 按照文献[6]所述,将C57BL/6J小鼠颈椎脱臼法处死,无菌手术取出所有的股骨和胫骨,超净台中用1 mL注射器沿骨髓腔冲出骨髓前体细胞,并用200目尼龙网进行过滤去除组织碎片,用含有1%青链霉素、10%胎牛血清的RPMI 1640培养基进行重悬,同时加入200 U/mL重组小鼠GM-CSF,37 ℃,5% CO2培养箱培养。分别于第3天进行补液10 mL、第6天和第8天分别半量换液,第10天收集细胞,即为BMDC。用正倒置荧光显微镜观察 BMDC的形态变化。
1.5 BMDC的鉴定 用500 μL PBS重悬收集的BMDC,向流式管中加入0.625 μL PerCP-Cy5.5-CD11c抗体,同时设置不加抗体的空白组,使用BD流式细胞仪检测CD11c分子表达水平。
1.6 分组 收集培养的细胞,使用不含GM-CSF的10%FBS培养液稀释至1×106/mL,接种24孔细胞培养板中,分组如下:Control组(加入等体积RPMI1640完全培养基)、阳性对照组,即LPS组(加入浓度为1 μg/mL的LPS)、LPS+3 mg/mL Em-sAg组、LPS+1.5 mg/mL Em-sAg组、LPS+0.75 mg/mL Em-sAg组、LPS+0.375 mg/mL Em-sAg组,作用24 h后,用1 mL PBS洗2次,分别向不同干预组中的流式管中加入0.625 μL PE-CD86、FITC-CD80、APC-MHC-Ⅱ、PerCP-Cy5.5-CD11c抗体,同时设置不加抗体的空白组,用BD流式细胞仪检测CD11c、CD80、CD86、MHC-Ⅱ分子表达水平。
1.7 细胞因子的检测 收集不同浓度Em-sAg作用BMDC 24 h后的上清液,参考IL-12p70试剂盒说明书,通过酶联免疫吸附实验(ELISA)检测上清液中IL-12p70的含量,每个样本设立 3个复孔,通过波长450 nm进行检测,所有检测重复3次。

2 结果
2.1 原头节活性检测 将无菌提取的原头节用0.4% 台盼蓝进行染色3 min,计数后得出数量在95%以上,活性良好,可用于动物造模(图1)。
图1 原头节活性检测
2.2 Em-sAg的提取 无菌超净台中用1 mL的注射器抽取病灶内空泡中的液体,即为Em-sAg。
2.3 小鼠BMDC的生长形态变化特点 从C57BL/6J小鼠骨髓腔内收集的细胞即为骨髓细胞,呈现单个核细胞,均匀圆形,细胞边界光滑,均匀悬浮于培养基中(图2a),培养至第3天,细胞呈现贴壁生长,体积逐渐增大,细胞膜表面可见少量毛刺样突起(图2b),第6天时,细胞由贴壁生长转为半悬浮状态生长,体积进一步增大,表面毛刺样突起进一步增加(图2c),第8~10天时,大部分细胞表面的可见毛刺样突起,细胞由半悬浮状态转为完全悬浮状态,即为较成熟的DC(图2d、e),与相关文献[7-8]中报道的未成熟的BMDC相符。

注:a,第0天(×20);b,第3天(×20);c,第6天(×20);d,第8天(×20);e,第10天(×20)。
2.4 BMDC纯度鉴定 收集小鼠BMDC,用PerCP-Cy5.5-CD11c进行染色,并进行流式细胞术分析,其CD11c的阳性率在70%以上,且每次纯度检测都在70%以上,说明此方法培养可以得到较纯的BMDC,符合实验要求(图3)。

图3 流式细胞术鉴定BMDC的纯度
2.5 Em-sAg抑制DC表面分子的表达 DC是体内最强的抗原递呈细胞,且在体内多为未成熟状态的DC,受到外界抗原(如LPS、TNFα等)的刺激后,由未成熟状态转变为成熟状态。为研究Em-sAg对LPS诱导的BMDC成熟度及抗原提呈能力的影响。通过流式细胞术检测不同浓度Em-sAg与LPS共培养后,其表面分子MHC-Ⅱ、CD80、CD86的表达情况。多组间单因素方差分析发现,与Control组相比,LPS组表面的细胞分子CD80、CD86、MHC-Ⅱ均显著增加(P值均<0.05);与阳性对照组相比,LPS+3 mg/mL Em-sAg组、LPS+1.5 mg/mL Em-sAg组、LPS+0.75 mg/mL Em-sAg组、LPS+0.375 mg/mL Em-sAg组中BMDC的 CD80显著减少(P值均<0.05),多组间比较差异有统计学意义(F=34.870,P<0.001);LPS+3 mg/mL Em-sAg组、LPS+1.5 mg/mL Em-sAg组、LPS+0.75 mg/mL Em-sAg组、LPS+0.375 mg/mL Em-sAg组中BMDC的 CD86、MHC-Ⅱ无明显减少(P值均>0.05)(图4)。
2.6 Em-sAg抑制炎症因子IL-12p70的释放 为进一步评价不同浓度Em-sAg对LPS诱导的BMDC功能的影响,通过ELISA试剂盒检测Em-sAg联合LPS诱导DC后分泌的IL-12的水平。结果显示,不同组间的IL-12的水平差异有统计学意义(F=73.140,P<0.05)。与Control组相比,LPS组刺激后IL-12p70的表达量显著升高,差异有统计学意义(P<0.05)。与阳性对照组相比,LPS+3 mg/mL Em-sAg组、LPS+1.5 mg/mL Em-sAg组、LPS+0.75 mg/mL Em-sAg组、LPS+0.375 mg/mL Em-sAg组均可降低IL-12p70的表达量(P值均<0.05),且Em-sAg浓度越高,降低促炎症因子IL-12p70表达量越明显(图5)。
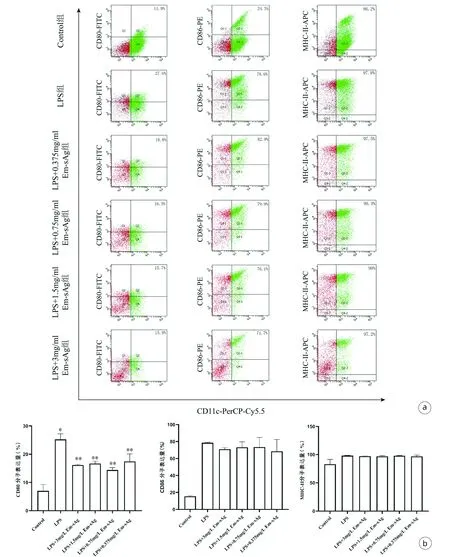
注:a,流式细胞术检测不同浓度的Em-sAg干预LPS诱导的BMDC的MHC-Ⅱ、CD80、CD86表达量;b,MHC-Ⅱ、CD80、CD86分子表达的定量分析。与Control组相比,*P<0.05;与阳性对照组相比,**P<0.05。
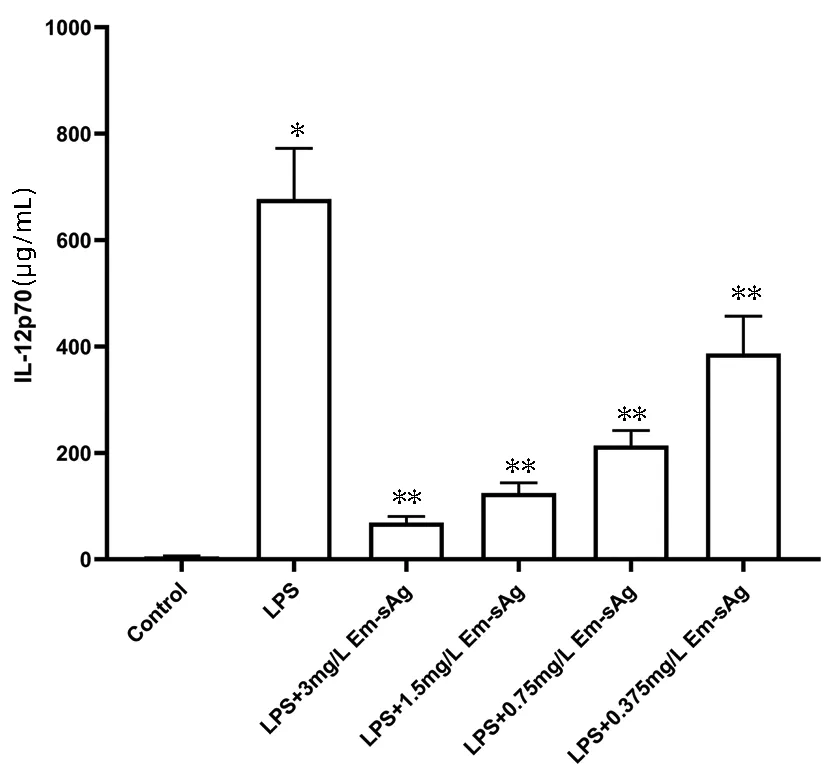
注:与Control组相比,*P<0.05;与阳性对照组相比,**P<0.05。
3 讨论
-AE是一种人畜共患寄生虫病,其中Em是该病的致病原。全球估计每年新增感染病例17 400例,危害极其严重[2,9]。Em以犬类为终宿主,以啮齿动物为中间宿主,人类多因误入被Em感染的水源或食物而感染[10]。AE具有全球性分布的特点,主要分布于北半球,超过90%的AE的分布于我国西北一带,包括青海、宁夏、新疆[11]等地,对当地的畜牧业和经济带来沉重负担[2,12-13]。AE就诊时多属于晚期,错过最佳的治疗时机,治疗方式多以外科手术和长期口服阿苯达唑治疗为主,效果不理想。现有报道[14-15]表明,免疫治疗在改善寄生虫病方面的作用越来越明显,因此研究Em的免疫感染机制可为新的治疗方式提供理论基础。
DC是连接固有免疫和适应性免疫的重要桥梁,被认为是最有效的抗原递呈细胞。当机体受到外界抗原刺激时(如病毒、细菌、微生物、寄生虫等),未成熟的DC能够吞噬、加工、分化成熟,将抗原信号呈递给Tn,诱导其活化和增殖,进而发挥机体免疫应答的效应[16]。研究[17-18]证实,细粒棘球蚴囊液和Em囊液均具有上调BMDC表面吲哚胺 2,3-双加氧酶表达的能力,继而诱导T淋巴细胞的“失能”,使机体获得免疫耐受。为进一步探索Em感染宿主免疫耐受方面的机制研究,本研究选取Em-sAg作为刺激物抗原,通过和LPS诱导的BMDC共同作用探究Em-sAg的作用。结果发现,Em-sAg可以抑制LPS诱导的BMDC的抗原递呈功能,与浓度无关,并初步探讨了共培养后上清中促炎症因子IL-12在感染过程中可能发挥的作用。
Tn的活化需要第一信号和第二信号的共同参与,即MHC-Ⅱ分子和共刺激分子(CD80、CD86),且DC的这些表面分子的表达量与细胞的抗原递呈能力成正比。研究[19-20]表明,细粒棘球蚴的抗原B可下调DC表面的 MHC-Ⅱ及CD86、CD80分子,诱导T淋巴细胞的“无能”。本研究也得出相同的结果,表明不同浓度的Em-sAg均可抑制LPS诱导的BMDC表面分子CD80的表达,进而抑制其抗原提呈能力。
现有研究[21]表明,成熟状态的DC产生的IL-12可诱导Tn分化为1型辅助T淋巴细胞,后者可分泌IFNγ、IL-2等细胞因子介导细胞免疫应答,有助于机体免疫系统对外界抗原的清除。本研究主要检测Em-sAg对LPS诱导的BMDC(LPS诱导的BMDC即为成熟状态的DC)所分泌细胞因子的变化,结果显示不同浓度的Em-sAg均可抑制BMDC所分泌的IL-12p70的表达,且Em-sAg的浓度越高,抑制分泌IL-12p70的程度就越明显。
综上所述,本研究发现Em-sAg降低LPS诱导的BMDC表面分子CD80表达,并抑制IL-12p70的分泌。这些研究结果将为阐明Em持续感染和致病机制提供科学依据,并为后续新药靶位的发现和疫苗研制提供理论和实验依据。
伦理学声明:本研究方案于2019年6月12日经由新疆医科大学第一附属医院伦理委员会审批通过,批号:20190531-03,符合实验室动物管理与使用准则。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:李文登、樊海宁、胡旺负责课题设计,修改论文;李文登、庞明泉负责撰写论文;庞明泉、徐凯、李超群、刘处处、乜茹、冯浩杰、张占红参与收集、分析数据;樊海宁、徐凯、刘处处负责指导撰写文章并最后定稿。

