多模态磁共振成像技术对腮腺Warthin瘤与多形性腺瘤的鉴别价值
孙爽,尹昳丽
(1. 扬州大学医学院,江苏 扬州 225009; 2. 苏北人民医院医学影像科,江苏 扬州 225001)
腮腺是人体最大的一对唾液腺,较其他腺体发病率高,在腮腺良性肿瘤中以Warthin瘤和多形性腺瘤居多[1]。临床研究表明,腮腺Warthin瘤和多形性腺瘤生物学行为差异较大,二者的治疗方式和临床转归不同[2]。腮腺具有重要的生理功能,且解剖结构复杂,腮腺区肿瘤术前一般不做活检或穿刺细胞检查,临床多采用影像学技术进行诊断[3]。然而,腮腺Warthin瘤和多形性腺瘤的影像学表现和生物学行为存在不同程度交叉,术前鉴别诊断具有一定的难度[4]。常规MRI是腮腺肿瘤检查的常用手段,通过识别肿瘤大小、边缘、形态、位置进行鉴别,但仍有一定的局限性[5-6]。MRI扩散加权成像(DWI)可以通过表观扩散系数(ADC)定量反映水分子布朗运动,观察水分子弥散受限情况[7]。MRI动态对比增强(DCE)能够体现细胞代谢层面的微观结果,显示病变血管结构[8]。采用多模态MRI技术能够多角度、多维度显示肿瘤信息,实现优势互补,提高诊断准确性[9-10]。本研究回顾性分析经病理学证实的腮腺Warthin瘤和多形性腺瘤患者的资料,探究多模态MRI技术对两者的鉴别诊断价值。
1 资料与方法
1.1 临床资料
收集2017年10月至2021年5月苏北人民医院收治的经病理学证实的腮腺Warthin瘤62例(66个病灶)和多形性腺瘤47例(49个病灶)患者的资料,其中,腮腺Warthin瘤患者男50例,女12例,年龄20~79岁,平均(54.38±9.60)岁;多形性腺瘤患者男21例,女26例,年龄21~82岁,平均(55.92±9.87)岁。本研究获得医院伦理委员会批准。
纳入标准:所有患者均经组织病理学检查确诊;均行MRI检查;均有至少1个可测量病灶;入组前均未接受任何治疗;资料完整;年龄20~82岁;患者及家属均签署知情同意书。
排除标准:合并其他肿瘤患者;心、肝、肾严重功能障碍患者;哺乳期或妊娠期女性;体内金属植入物等MRI检查禁忌证患者;MRI图像伪影患者。
1.2 方法
所有患者入院后均采用德国Siemens公司生产的3.0 T MRI仪进行检查,头颈联合线圈,采取头先进仰卧位,患者检查前均禁食6~8 h,并且接受均匀呼吸和屏气训练。常规MRI平扫序列包括横轴面SE T1WI,STIR T2WI和冠状面STIR T2WI;DWI序列采用单次激发SE EPI序列:TE为82 ms,TR为6 800 ms,视野为220 mm×213 mm,扩散敏感系数(b值)取0 s/mm2、1 000 s/mm2,间距为0.4 mm,层厚为4 mm;DCE-MRI序列采用三维容积内插快速扰相梯度回波序列:TE为1.5 ms,TR为3.82 ms,翻转角为15°,视野为280 mm×236 mm,间距为0.4 mm,层厚为4 mm,在动态增强扫描采集到第4个时相时通过高压注射器静脉团注对比剂Gd-DTPA,剂量0.2 mmol/kg,注射流率2 mL/s,注射完毕后静脉团注15 mL生理盐水。连续采集32个期相的动态增强扫描图像。
采用常规MRI扫描病灶部位、大小、数量、形态、边界,测量ADC。在Siemens Syngo工作站使用Tissue 4D软件包对DCE-MRI数据进行分析,绘制病灶的时间-信号强度曲线(TIC),获得Warthin瘤及多形性腺瘤病灶速率常数(Kep)、对比剂浓度曲线下初始面积(iAUC)、容量转移常数(Ktrans)、血管外细胞外间隙容积比(Ve),所有参数均测量3次,取平均值。
1.3 统计学分析
2 结果
2.1 腮腺Warthin瘤与多形性腺瘤患者临床特征比较
腮腺Warthin瘤与多形性腺瘤病灶发生部位、形状、边界比较,差异均无统计学意义(P>0.05);两组患者男女比例差异有统计学意义(P<0.001);腮腺Warthin瘤患者病灶囊变数明显少于多形性腺瘤患者(P<0.001)。见表1。腮腺Warthin瘤病灶最大截面积为(4.24±0.71)cm2,多形性腺瘤病灶最大截面积为(4.15±0.68)cm2,两组差异无统计学意义(t=0.684,P>0.05)。腮腺多形性腺瘤典型病例影像见图1,腮腺Warthin瘤典型病例影像见图2。
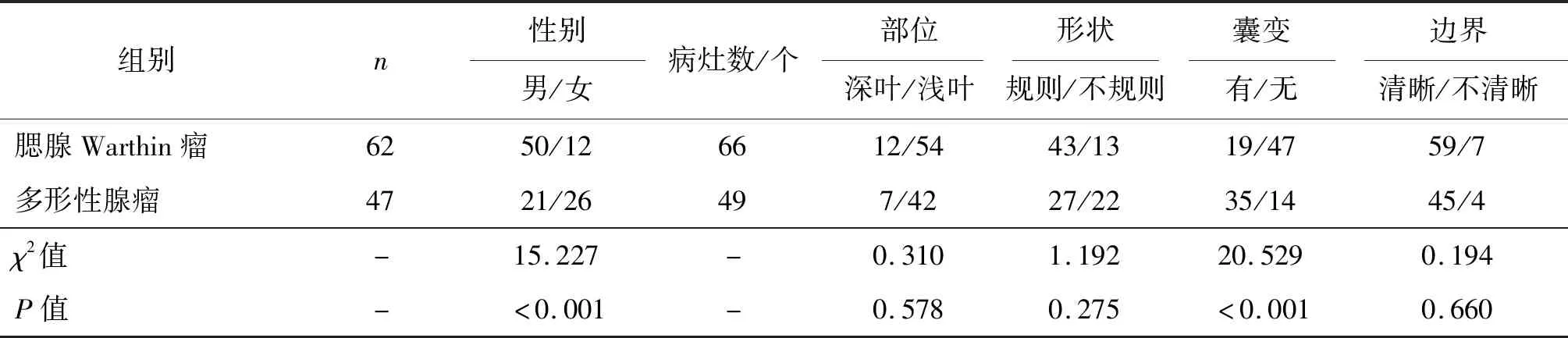
表1 腮腺Warthin瘤与多形性腺瘤患者临床特征比较 例
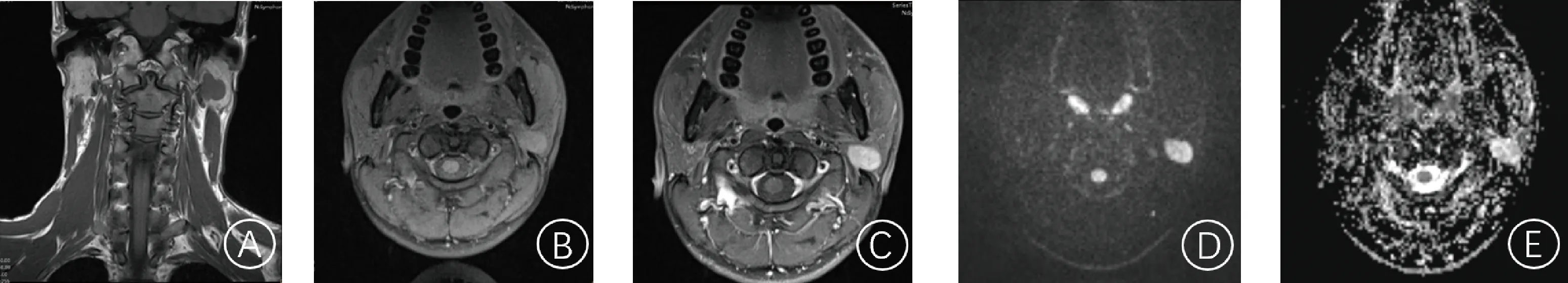
A:MRI冠状位示左侧腮腺一浅分叶状T1WI低信号结节;B、C:病灶T1WI增强扫描呈渐进性强化; D、E:病灶DWI高信号,ADC稍高信号
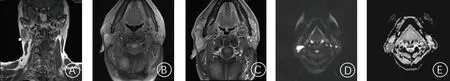
A:MRI冠状位示右侧腮腺一类圆形T1WI低信号结节;B、C:病灶T1WI增强扫描早期强化,呈“快进快出”表现; D、E:病灶DWI高信号,ADC稍低信号
2.2 腮腺Warthin瘤与多形性腺瘤病灶ADC值比较
腮腺Warthin瘤66个病灶测量所得的ADC值为(0.68±0.13)×10-3mm2/s,多形性腺瘤49个病灶的ADC值为(1.74±0.25)×10-3mm2/s。腮腺Warthin瘤ADC值明显低于多形性腺瘤(t=29.516,P<0.001)。
2.3 腮腺Warthin瘤与多形性腺瘤DCE-MRI参数比较
腮腺Warthin瘤与多形性腺瘤Kep、iAUC值比较,差异均无统计学意义(P>0.05);腮腺Warthin瘤Ktrans值明显高于多形性腺瘤(P<0.001),Ve值明显低于多形性腺瘤(P<0.001)。见表2。

表2 腮腺Warthin瘤与多形性腺瘤患者DCE-MRI参数比较
2.4 ADC值和DCE-MRI参数在腮腺Warthin瘤与多形性腺瘤中的鉴别价值
ROC曲线分析显示,ADC、Ktrans、Ve的最佳截断点分别为1.00 ×10-3mm2/s,0.19 min-1,0.42,灵敏度分别为81.82%,83.33%,84.85%,特异度分别为73.47%,77.55%,69.39%,曲线下面积(AUC)分别为0.814,0.741,0.760;ADC、Ktrans、Ve联合诊断的特异度、AUC分别为95.92%和0.866,见表3和图3。
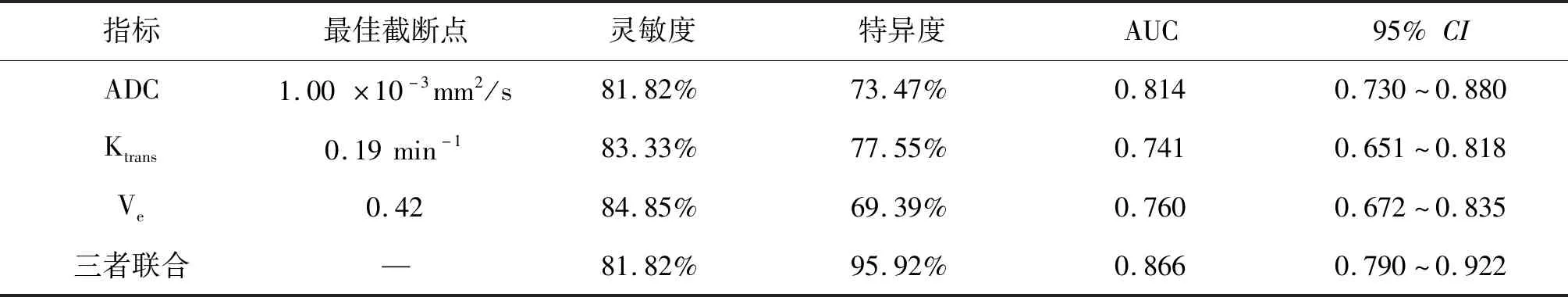
表3 ADC值和DCE-MRI参数在腮腺Warthin瘤与多形性腺瘤中的鉴别价值
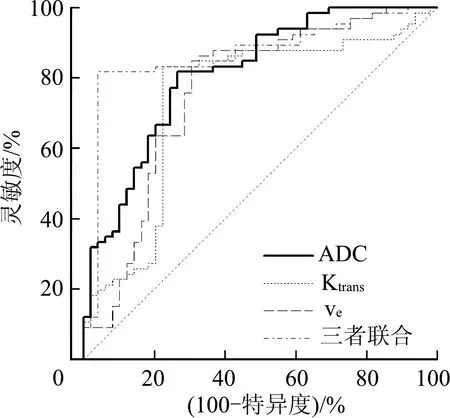
图3 ADC值和DCE-MRI参数鉴别腮腺Warthin瘤与多形性腺瘤的ROC曲线
3 讨论
Warthin瘤与多形性腺瘤是两种常见的腮腺肿瘤,由于腮腺肿瘤病理类型多样化的特点,患者病灶术前诊断具有一定的困难。尽管腮腺Warthin瘤与多形性腺瘤部分临床表现具有差异性,但仅凭临床资料仍无法准确判定肿瘤病变性质,仍需通过影像学检查进一步确诊。MRI用于头颈部软组织分辨率较高,能够多参数、多序列成像提供肿瘤软组织特征。近年来,DWI和DCE技术逐渐应用于腮腺肿瘤的筛查中,其通过定量评估肿瘤成分,提高肿瘤鉴别准确性[11-12]。本研究采用多模态MRI技术鉴别腮腺Warthin瘤与多形性腺瘤,以期为临床诊断提供参考。
本研究结果显示,腮腺Warthin瘤与多形性腺瘤病灶最大截面积、部位、形状、边界比较均无明显差异,说明腮腺Warthin瘤与多形性腺瘤临床特征基本相似。腮腺Warthin瘤患者病灶囊变数明显少于多形性腺瘤患者。有研究报道,多形性腺瘤各年龄段均可发生,多位于腮腺浅叶,形态多规则,边界清楚,有潜在的恶变倾向。腮腺Warthin瘤发病人群、临床表现与多形性腺瘤具有一定的相似性,其特点为男性多见,好发于腮腺浅叶后下极,可多发,累及双侧腮腺,发生恶变的风险较低[13]。因此,仅根据常规MRI平扫不足以鉴别两种肿瘤。本研究中腮腺Warthin瘤病灶的ADC值明显低于多形性腺瘤。多形性腺瘤组成包括上皮结构和黏液样或软骨样间质,肿瘤细胞的核浆较小,黏液或软骨样间质较为丰富、疏松,且肿瘤多伴有囊变,水分子扩散受限不明显,故ADC值较高[14]。Warthin瘤组成包括上皮细胞、滤泡样淋巴组织和蛋白囊腔,水分子扩散明显受限,故ADC值较低[15]。本研究结果显示,腮腺Warthin瘤病灶Ktrans值明显高于多形性腺瘤,Ve值明显低于多形性腺瘤。DCE-MRI定量分析采用对比剂在血管与组织间隙之间的交换过程进行分析,采用假定的药代动力学模型计算血流动力学参数,进而反映组织血管分布和血流灌注,其中,Ktrans值增高说明肿瘤内新生血管丰富,血管壁通透性高,而Ve值低说明肿瘤内细胞分布密集,细胞外间隙较少[16]。因此,Ktrans值和Ve值能够一定程度上反映腮腺Warthin瘤与多形性腺瘤生理信息,有助于临床鉴别诊断。本研究ROC曲线分析显示,ADC、Ktrans、Ve的最佳截断点分别为1.00 ×10-3mm2/s,0.19 min-1,0.42,三者联合诊断的特异度、AUC分别为95.92%和0.866。联合诊断时,能够充分利用各参数优势评估腮腺Warthin瘤与多形性腺瘤病理变化的差异性,结合病灶形态学特点、信号特征、灌注参数进行综合分析,可进一步提高影像诊断的准确性[17]。
综上,多模态MRI技术用于腮腺Warthin瘤与多形性腺瘤患者鉴别诊断具有较高的临床应用价值,能为临床治疗方案的制定提供重要参考依据。然而,本研究病例选取有限,研究结果可能存在一定偏倚,仍需扩大样本,进一步证实多模态MRI技术鉴别腮腺Warthin瘤与多形性腺瘤的价值。

