罗平晾晒烟的化学成分研究
魏 敏,程 林,祁艳艳,王 芳,陈柯瑾,崔艺璇,李干鹏
(云南民族大学 民族医药学院 民族药资源化学国家民委-教育部重点实验室,云南 昆明 650500)
烟草(NicotianatabacumL.)为茄科(Solanaceae)烟草属(Nicotiana)植物,我国南北各省区广为栽培.作烟草工业的原料;全株也可作农药杀虫剂;亦可药用,作麻醉、发汗、镇静和催吐剂[1].
烟草是卷烟生产的主要原料,按其调制方法不同可分为烤烟、晾晒烟、熏烟几大类.云南地方晾晒烟是烟草在云南独特的地理、气候条件下经过多年的栽培形成的云南特有变种,包括(罗平八大河烟、师宗五洛河烟、会泽乐业烟、蒙自新安所烟、富源大河烟、大姚赵户冲烟、云龙天登烟、宾川白塔烟、巍山南门烟、南涧乐居烟、腾冲绮罗生烟)等[2].晾晒烟作为协调卷烟吃味品质所不可缺少的原料,而相关次生代谢产物及其用途方面的研究报道很少.2013年,冷红琼等[3]从晾晒烟叶90%甲醇提取物中分离得到2个新的单体化合物,同属于苯丙素类,对这2个化合物进行5种人源肿瘤细胞株(NB4、A549、SHSY5Y、PC3和MCF7)的细胞毒性测试,发现化合物Nicotpanoids A对SHSY5Y细胞有明显生长抑制作用,IC50值为 1.5 μmol/L;化合物Nicotpanoids B对SHSY5Y和MCF7细胞具有很好的抑制作用,IC50值分别为2.2和 2.0 μmol/L.2015年,吴玉萍等[4]从晾晒烟叶70%甲醇提取物中分离纯化得到的化合物4,7-dimenthoxy-6-8-[(E)-3-hydroxy-2-methylprop-1-enyl]flavone,且对A549和SHSY5Y肿瘤细胞具有很好的抑制作用,IC50值分别为1.6和 2.8 μmol/L.
为了对云南地方晾晒烟罗平晾晒进行化学成分研究,文中利用多种现代分离手段,对罗平晾晒烟95%乙醇物展开研究,得到单体化合物12个(见图1),并对它们进行体外抗肿瘤活性初步筛选,发现化合物10和12对HeLa细胞增殖具有抑制作用,抑制率分别为20.38%和15.05%.
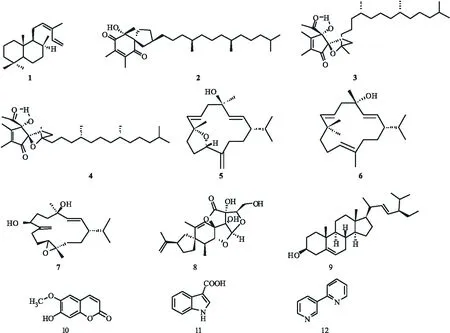
图1 化合物1~12的化学结构
1 实验部分
1.1 材料与仪器
DRX-600型核磁共振仪(Bruker,瑞士);安捷伦1260半制备液相(安捷伦,美国);AR224CN型电子分析天平(奥豪斯仪器有限公司,美国);OSD-210自动旋转蒸发仪(上海泉杰,中国).
柱色谱硅胶(100~400目,青岛科谱分离材料有限公司);GF254硅胶板(50 mm×100 mm,青岛科谱分离材料有限公司);Sephadex LH-20凝胶(美国GE公司);色谱级甲醇(美国Acros公司);纯净水(娃哈哈);其余化学试剂均为分析级(天津市风船化学试剂科技有限公司);硫酸乙醇显色剂-5%硫酸乙醇溶液(实验室自制).
1.2 植物材料
晾晒烟叶(Nicotiana tabacum)于2019年8月采自云南省曲靖市罗平县,经云南中医药大学杨礼攀副教授鉴定,植物标本号为:NT201908,现保存在云南民族大学民族药资源化学国家民委-教育部重点实验室的标本室.
1.3 提取与分离
晾晒烟 20 kg 乙醇(95%)回流提取3次,每次用 200 L 乙醇提取 5 h,合并3次提取液减压浓缩得浸膏 3.3 kg.用硅胶柱色谱对样品进行粗划段,取100~200目硅胶 3.3 kg 拌样,采用干法装柱和干法上样.分别用石油醚、乙酸乙酯、乙酸乙酯-甲醇(V/V,5∶1)、甲醇各 20 L 进行洗脱划段,得石油醚段(LA,291 g)、乙酸乙酯段(LB,671 g)、乙酸乙酯∶甲醇段(LC,738 g)、和甲醇段(LD,1 044 g 糖)4个部分.
LA(291 g)过MCI反相柱色谱进行除色素和粗分离,采用80%甲醇、90%甲醇、95%甲醇和纯甲醇作为流动相,通过TLC(薄层色谱法)检测分析,合并后共分为4个部分(编号LA1(80 g)、LA2(62 g)、LA3(81 g)和LA4(35 g).
LA1取 40 g 采用硅胶正相柱色谱进行分离,洗脱剂为石油醚-乙酸乙酯(体积比,40∶1~1∶1)系统.经TLC检测分析,合并后分为6个部分(编号:LA3a-LA3f).LA3b(10 g),通过凝胶柱色谱进行分离,流动相为石油醚-二氯甲烷-甲醇(体积比,5∶5∶1),通过TLC检测分析,再通过硅胶柱色谱,以石油醚-丙酮(体积比,40∶1~1∶1)作为流动相,分离得到化合物1(10.0 mg),LA3d(4 g)通过凝胶柱色谱进行分离,流动相为石油醚-二氯甲烷-甲醇(体积比,5∶5∶1),再通过硅胶柱色谱分离,采用石油醚-乙酸乙酯(体积比,30∶1~10∶1)作为流动相进行洗脱,通过TLC检测分析,合并后分为5个部分(编号:LA3d1-LA3d5),LA3d2-LA3d3通过PTLC(制备薄层色谱法)进行分离得到化合物2(15.0 mg)、化合物3(10.0 mg)、化合物4(11.0 mg).LA3f(3 g)经凝胶柱色谱进行除杂,通过硅胶柱色谱分离,流动相为石油醚-丙酮(体积比,10∶1),结合重结晶方法得到化合物9(0.3 g).
LB(671 g)通过反相柱色谱MCI进行初分离,采用30%甲醇、60%甲醇、90%甲醇、纯甲醇和丙酮作为流动相进行洗脱分离,通过TLC和HPLC检测分析,合并后分为7个部分(编号LB1-LB7:LB1(220 g)、LB2(28 g)、LB3(51 g)、LB4(33 g)、LB5(182 g)、LB6(8 g)、LB7(150 g).
LB1取 90 g,通过硅胶柱色谱分离,以二氯甲烷-丙酮(体积比,100∶0~2∶1)作为流动相进行洗脱,通过TLC检测分析,共分为5个部分(编号:LB1a-LB1e),LB1a(7 g)通过反相柱色谱C18进行分离,用甲醇-水(10%~100%)作为流动相进行洗脱,通过HPLC检测分析,合并后分为6个组分(编号:LB1a1-LB1a6),LB1a1(0.4 g)通过凝胶柱色谱分离,流动相为甲醇进行洗脱,再通过PTLC分离得到化合物11(7.8 g)、化合物8(2.0 mg),LB1a2(0.25 g)通过硅胶柱色谱,流动相用石油醚-丙酮(体积比,40∶1~5∶1)进行洗脱,通过PTLC分离得到化合物5(25.0 mg)化合物6(15.0 mg)、化合物7(4.4 mg).LB1a3(1 g)通过凝胶柱色谱分离,再用HPLC进行分离,流动相为甲醇-水(体积比,45∶55),流速为3 mL/min,分离得到化合物10(15.0 mg)、化合物12(7.0 mg).
1.4 对HeLa肿瘤细胞抑制活性实验
人宫颈癌细胞株(HeLa细胞)培养于含10%胎牛血清、50 U/mL 青霉素和 50 μg/mL 链霉素的 RPMI-1640细胞培养基中,置于 37 ℃、5% CO2培养箱中,生长至80%融合度时,0.25%胰酶消化传代,培养至对数生长期.每孔5×104个细胞培养于96孔板中,24 h 后弃培养液,加入含12个样品浓度为 50 μmol/L 的培养基,以不含药孔为对照,以 50 μmol/L 的顺铂作为阳性药,置培养箱内孵育 24 h,用培养基洗2次,每孔加入 200 μL 新鲜培养基及 10 μL CCK-8试剂,孵育 4 h,应用酶标仪检测 450 nm 波长吸光度.细胞增殖试验将2×104个细胞/孔培养于96孔板中,加入含化合物浓度 50 μmol/L 的培养基,以不含药孔为对照,以顺铂为阳性药,培养24、48、72 h,如上操作加入CCK-8,测定吸光度值,计算抑制率,计算公式如下.
抑制率计算公式:[(对照组OD值-空白组OD值)-(药物组OD值-空白组OD值)]/(对照组OD值-空白组OD值).
2 实验结果
2.1 结构鉴定
化合物1白色油状物,易溶于氯仿,分子式C20H34.1H NMR(400 MHz,CDCl3)δH: 6.88(1H dd,J=18.2,10.8 Hz,H-14), 5.50(1H, t,J=7.6 Hz,H-12), 5.19(1H,d,J=17.4 Hz,H-15b),5.10(1H,d,J=10.8 Hz,H-15a),1.79(3H,s,H-16),1.18(3H,d,J=1.3 Hz,H-17),0.87(3H,s,H-20),0.83(3H,s,H-19),0.79(3H,s, H-18).13C NMR(100 MHz,CDCl3)δC:134.0(C-12), 133.8(C-14), 131.0(C-13), 113.9(C-15), 74.4(C-8), 62.4(C-9), 56.3(C-5), 44.2(C-7), 42.0(C-3), 40.3(C-1), 39.1(C-10), 33.6(C-18), 33.4(C-4), 24.6(C-17), 23.3(C-11), 21.7(C-19), 20.4(C-6), 20.0(C-16), 18.7(C-2), 15.6(C-20).经与文献[5]相比较,基本一致,故鉴定为Cis-abienol.
化合物2黄色油状物,易溶于氯仿,分子式C30H52O3.1H NMR(400 MHz, CDCl3)δH: 2.06(3H, s, H-6a), 2.05(3H, s, H-5a), 2.01(1H, m, H-7b), 1.92(1H, m, H-8b).1.69(1H, m, H-7a), 1.66(1H, m, H-10b), 1.58(1H, m, H-8a).1.56(1H, m, H-10a), 1.36(3H, s, H-3a).1.32(3H, s, H-9a), 0.86(3H, d,J=6.5 Hz, H-22), 0.85(3H, d,J=6.5 Hz, H-21a), 0.83(3H, d,J=6.5 Hz, H-13a), 0.82(3H, d,J=6.5 Hz, H-17a).13C NMR(100 MHz, CDCl3)δC: 201.8(C-4), 199.0(C-1), 147.1(C-6), 142.1(C-5), 93.5(C-2), 87.2(C-9), 81.4(C-3), 41.5(C-10), 39.5(C-20), 37.7(C-12), 37.6(C-14), 37.5(C-16), 37.4(C-18), 36.6(C-8), 32.9(C-13), 32.9(C-17), 32.2(C-7), 28.1(C-21), 25.9(C-9a), 24.9(C-15), 24.6(C-19), 24.4(C-3a), 22.9(C-22), 22.8(C-21a), 22.5(C-11), 19.9(C-13a), 19.9(C-17a), 13.5(C-6a), 13.2(C-5a).经与文献[6]相比较,基本一致,故鉴定为(-)-α-tocospirone.
化合物3白色油状物,易溶于氯仿,分子式C29H50O4.1H NMR(400 MHz, CDCl3)δH: 4.68(1H, s, OH), 2.36(1H, dt,J=12.2,5.8 Hz, Hβ-7), 2.01(3H, s, H-3a), 1.87(1H, dt,J=12.2,5.8 Hz, Hα-7), 1.84(3H, s, H-6a), 1.81(3H, s, H-5a), 1.73-1.79(2H, m, H-8), 1.30(3H, s, H-9a), 0.85(6H, d,J=6.5 Hz, H-21a, H-22), 0.83(3H, d,J=7.1 Hz, H-13a), 0.82(3H, d,J=6.5 Hz, H-17a).13C NMR(100 MHz,CDCl3)δC: 207.1(C-3), 205.3(C-1), 163.3(C-5), 139.6(C-6), 92.7(C-2), 89.6(C-4), 87.4(C-9), 42.2(C-10), 39.5(C-20), 37.6(C-12), 37.6(C-16), 37.6(C-14), 37.5(C-18), 37.0(C-8), 33.5(C-7), 33.0(C-13), 32.9(C-17), 28.1(C-21), 25.6(C-9a), 25.0(C-3a), 25.0(C-15), 24.6(C-19), 22.9(C-21a), 22.8(C-22), 22.5(C-11), 19.9(C-13a), 19.8(C-17a), 11.9(C-5a), 8.9(C-6a).经与文献[7]相比较,基本一致,故鉴定为α-tocospiros B.
化合物4黄色油状物,易溶于氯仿,分子式C29H50O4.1H NMR(400 MHz,CDCl3)δH:4.72(1H, s, OH), 2.43(1H, dt,J=12.4,7.1 Hz, Hβ-7), 2.01(3H, s, H-3a), 1.89(1H, dt,J= 11.4,7.0 Hz,Hα-8), 1.83(3H, s, H-6a), 1.81(3H, s, H-5a), 1.78(1H, dt,J=12.4,7.1 Hz, Hα-7), 1.69(1H, dt,J=11.4,7.0 Hz, Hβ-8), 1.60(2H, dd,J=8.9,6.9 Hz, Hβ-10), 1.04(3H, s, H-9a), 0.85(6H, d,J=6.8 Hz, H-21a, H-22), 0.84(3H, d,J=7.1 Hz, H-13a), 0.82(3H, d,J=2.4 Hz, H-17a).13C NMR(100 MHz,CDCl3)δC: 207.2(C-3), 205.1(C-1), 163.2(C-5), 139.4(C-6), 92.3(C-2), 89.2(C-4), 87.2(C-9), 41.6(C-10), 39.5(C-20), 37.7(C-12), 37.6(C-16), 37.6(C-14), 37.4(C-18), 36.3(C-8), 33.0(C-13), 32.9(C-7), 32.9(C-17), 28.1(C-21), 25.6(C-9a), 25.0(C-15), 24.9(C-3a), 24.6(C-19), 22.9(C-21a), 22.8(C-22), 22.6(C-11), 19.9(C-17a), 19.8(C-13a), 11.9(C-5a), 8.8(C-6a).经与文献[7]相比较,基本一致,故鉴定为α-tocospiros A.
化合物5白色油状物,易溶于氯仿,分子式C20H32O2.1H NMR(400 MHz, CDCl3)δH: 5.48(1H, d,J=16.6 Hz, H-7), 5.39(1H, d,J=15.7 Hz, H-3),(1H, dt,J=16.6,6.4 Hz, H-6), 5.09(1H, d,J=15.7 Hz, H-2), 4.98(1H, br d,J=1.5 Hz, Ha-20), 4.85(1H, br t,J=1.6 Hz, Hb-20), 1.35(3H, s, H-16), 1.29(3H, s, H-19), 0.87(3H, d,J=6.8 Hz, H-16), 0.83(3H, d,J=6.7 Hz, H-17).13C NMR(100 MHz,CDCl3)δC:150.1(C-12), 140.4(C-7), 138.1(C-3), 131.8(C-2), 121.2(C-6), 113.2(C-20), 85.8(C-11), 83.2(C-8), 73.8(C-4), 50.6(C-1), 46.5(C-5), 35.8(C-13), 33.6(C-9), 32.1(C-15), 31.7(C-10), 28.7(C-19), 27.0(C-14), 24.7(C-18), 20.8(C-16), 19.9(C-17).经与文献[8]相比较,基本一致,故鉴定为(1S,2E,4-R,6E,8R,11S)-8,11-epoxy-2,6,12(20)-cembratrien-4ol.
化合物6白色油状物,易溶于氯仿,分子式C20H34O2.1H NMR(400 MHz,CDCl3)δH: 5.63(1H, d,J=13.8 Hz, H-7),5.55(1H, ddd,J=13.8,6.9,2.7 Hz, H-6), 5.43(1H, d,J=15.7 Hz, H-3), 5.29(1H, br t,J=5.9 Hz, H-11), 5.27(1H, dd,J=15.7,8.6 Hz, H-2), 2.46(1H, dd,J= 12.8,2.7 Hz, Hb-5), 2.25(1H, dd,J=12.8, 6.8 Hz, Ha-5), 1.47(3H, br s, H-20), 1.32(3H, s, H-19), 1.27(3H, s, H-18), 0.81(3H, d,J=6.7 Hz, H-17), 0.78(3H, d,J=6.8 Hz, H-16).13C NMR(100 MHz,CDCl3)δC: 141.0(C-7), 138.8(C-3), 132.3(C-12), 127.3(C-2), 126.9(C-11), 121.8(C-6), 73.5(C-4), 73.4(C-8), 48.1(C-5), 47.4(C-1), 42.2(C-9), 37.4(C-13), 33.0(C-15), 30.1(C-18), 29.5(C-19), 27.9(C-14), 22.3(C-10), 20.8(C-16), 19.7(C-17), 14.4(C-20).经与文献[8]相比较,基本一致,故鉴定为(1S,2E,4R,6E,8S,11E)-2,6,11-cembratrien-4,8-diols.
化合物7白色油状物,易溶于氯仿,分子式C20H34O3.1H NMR(400 MHz, CDCl3)δH: 5.63(1H, d,J=15.8 Hz, H-3), 5.28(1H, dd,J=15.8,8.2 Hz, H-2), 4.98(1H, s, H-19a), 5.63(1H, d,J=15.8 Hz, H-3), 5.01(1H,s, H-19b), 4.09(1H, dd,J=8.8,5.1 Hz, H-7), 2.53(1H, dd,J=12.6,5.0 Hz, H-11), 1.38(3H, s, H-18), 1.25(3H, s, H-20), 0.89(3H, s, H-17),0.83(3H, s, H-16).13C NMR(100 MHz,CDCl3)δC:149.2(C-8), 138.0(C-3), 133.1(C-2), 113.5(C-19),78.1(C-7), 72.6(C-4), 64.3(C-11), 62.1(C-12), 48.1(C-1), 41.1(C-5), 34.1(C-13), 31.2(C-15), 30.7(C-6), 30.3(C-14), 28.7(C-18), 25.9(C-9), 25.6(C-10), 21.3(C-16), 20.5(C-17), 16.6(C-20).经与文献[9]相比较,基本一致,故鉴定为(1S,2E,4R,7S)-11,12-epoxy-2,8(19)-cembradiene-4,7-diol.
化合物8白色油状物,易溶于甲醇,分子式C21H28O7.1H NMR(400 MHz, CD4O)δH: 5.37(1H, s, H-16), 5.21(1H, s, H-3), 4.72(1H, br s, Ha-12), 4.67(1H, br s, Hb-12), 4.24(1H, d,J=4.8 Hz, H-1), 3.99(1H, dd,J=7.1,2.6 Hz, H-20), 2.50(1H, m, H-7), 2.30(1H, dd,J=13.6,7.3 Hz, H-6), 2.09(3H, dq,7.0, 4.9, H-10), 1.86(3H, s, H-14), 1.73(3H, s, H-13), 0.98(3H, d,J=7.1 Hz, H-15).13C NMR(100 MHz, CD4O)δC: 177.1(C-19), 149.1(C-11), 149.1(C-4), 117.1(C-3), 112.2(C-10), 109.0(C-12), 92.5(C-17), 90.4(C-2), 89.5(C-1), 87.3(C-20), 79.5(C-18), 61.9(C-21), 49.3(C-4), 47.8(C-7), 42.1(C-6), 41.3(C-10), 36.0(C-9), 33.1(C-8), 21.3(C-13), 21.1(C-14), 14.3(C-15).经与文献[10]相比较,基本一致,故鉴定为NicotabinA.
化合物9白色粉末,易溶于氯仿,分子式C29H48O.1H NMR(400 MHz,CDCl3)δH: 5.35(1H, m, H-6), 5.15(1H, dd,J=15.2,8.6 Hz, H-22), 5.01(1H, dd,J=15.2, 8.7 Hz, H-23), 3.51(1H, m, H-3), 1.02(3H, d, H-21), 1.01(3H, s, H-18), 0.84(3H, d, overlap, H-26), 0.82(3H, t, overlap, H-21), 0.79(3H, d, overlap, H-27), 0.70(3H, s, H-18).13C NMR(100 MHz, CDCl3)δC: 140.9(C-5), 138.5(C-22), 129.5(C-23), 121.8(C-6), 72.0(C-3), 57.0(C-14), 56.1(C-17), 51.4(C-24), 50.3(C-9), 42.6(C-4), 42.4(C-13), 40.6(C-20), 39.9(C-12), 37.4(C-1), 36.7(C-10), 32.1(C-8), 32.1(C-7), 32.0(C-25), 31.8(C-2), 29.1(C-16), 25.6(C-28), 24.6(C-15), 21.5(C-21), 21.3(C-26), 21.3(C-11)19.5(C-19), 19.1(C-27), 12.4(C-18), 12.3(C-29).经与文献[11]相比较,基本一致,故鉴定为Stigmasterol.
化合物10黄色粉末,易溶于氯仿,分子式C10H8O4.1H NMR(400 MHz, C5D5N)δH: 7.72(1H, d,J=9.3 Hz, H-4), 7.14(1H, s, H-5), 7.07(1H, s, H-8), 6.33(1H, d,J=9.4 Hz, H-4), 3.79(3H, s, H-6-OCH3).13C NMR(100 MHz, C5D5N)δC: 161.8(C-2), 153.4(C-7), 151.4(C-6), 146.6(C-9), 144.5(C-4), 112.7(C-3), 111.4(C-10), 109.8(C-5), 104.5(C-8), 56.6(C-6-OCH3).经与文献[12]相比较,基本一致,故鉴定为Scopolin.
化合物11黄色粉末,易溶于氯仿,分子式C9H7O2.1H NMR(400 MHz,C5D5N)δH:8.90(1H, d,J=8.0 Hz, H-2), 8.55(1H, br s, H-5), 7.67(1H, m, H-8), 7.44(1H, m, H-6),7.38(1H, m, H-7).13C NMR(100 MHz,C5D5N)δC: 168.4(C-10), 138.4(C-9), 133.4(C-2), 128.2(C-4), 123.3(C-7), 122.6(C-6), 122.2(C-5), 113.2(C-8), 110.4(C-3).经与文献[13]相比较,基本一致,故鉴定为Indole-3-carboxylic acid.
化合物12黄色粉末,易溶于氯仿,分子式C10H8N2.1H NMR(400 MHz,CDCl3)δH: 9.18(1H, s,J=2.3 Hz, H-2), 8.68(1H, d,J=7.6 Hz, H-6), 8.68(1H, d,J=8.4 Hz, H-6′), 8.32(1H, d,J=6.8 Hz, H-4), 7.78(1H, dd,J=7.6,6.8 Hz, H-5), 7.75(1H, dd,J=7.0, 6.9 Hz, H-4′), 7.41(1H, d,J=8.0 Hz, H-3′), 7.29(1H, dd,J=8.4, 6.9 Hz, H-5′).13C NMR(100 MHz, CDCl3)δC: 154.9(C-2), 150.2(C-2′), 149.9(C-6′), 148.2(C-6), 137.2(C-4), 135.1(C-3′), 134.6(C-4′), 123.8(C-5′), 123.0(C-5), 120.8(C-3).经与文献[14]相比较,基本一致,故鉴定为α,β-dipyridyl.
2.2 化合物的细胞毒活性研究
运用cck-8试剂进行HeLa肿瘤细胞抑制活性,抗烟草花叶病毒活性初步筛选,通过3次平行试验的筛选,12个化合物的浓度为 50 μmol/L,发现化合物10和12对HeLa细胞增殖具有抑制作用,抑制率分别为20.38%和15.05%.其他化合物均未表现出抑制作用.
3 结语
次生代谢产物也是植物防御外界环境刺激过程的重要手段,植株为了阻止病毒的增殖及其进一步传播,植物会合成相应的植保素防御病毒入侵[15],烟草植物也不例外,烟草花叶病毒作为烟草主要的入侵病原体,同时也刺激烟草产生植保素进行防御,植保素通常具有有效的药理活性,值得深入研究.云南的地方晾晒烟资源丰富,从中选定高抗病毒植株品种罗平晾晒烟,通过植物化学的方法分离、纯化,得到12个化合物,并对它们进行体外抗HeLa肿瘤活性初步筛选,发现化合物10和12浓度为 50 μmol/L 时对HeLa细胞增殖具有抑制作用,抑制率分别为20.38%和15.05%,其抗肿瘤作用机制有待进一步研究.本实验首次对罗平晾晒烟进行化学成分研究,也为罗平晾晒烟内源性抗烟草花叶病毒筛选提供了单体化合物.

