(-)-N-芳硫基樟脑内磺酰胺的合成及其与β-酮酯的反应
姜 亮, 陈甫雪
(北京理工大学 化学与化工学院,北京 102488)
有机含硫化合物不仅广泛存在于天然产物、生物活性分子和药物分子中,而且作为配体、手性辅基、有机催化剂、试剂和合成中间体被应用于有机合成领域[1-3]。因此,不对称合成有机硫化物过去十几年吸引众多合成化学工作者的关注。其中,不对称亲电硫化反应是最直接、最有效合成手性硫化合物的策略之一。
Scheme 1

Scheme 2
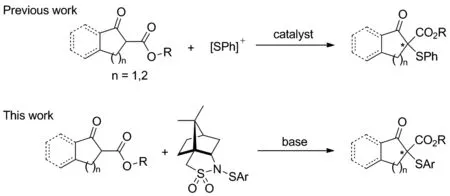
迄今为止,醛[4]、氧化吲哚[5]、β-酮酯[6]、氮杂内酯[7]与亲电性巯基试剂的不对称芳硫化反应,已经被相关研究者报道。2005年,Jørgensen[8]报道了第一例金鸡纳碱衍生物催化反应,实现了高对映选择性β-酮酯的不对称芳硫化取代反应。随后,Togni等[9]报道了有机金属络合物催化β-酮酯的不对称芳硫化反应。最近,Luo课题组[10]以脯氨酸衍生的手性仲胺为有机小分子催化剂,实现了非环状β-酮酯的不对称芳硫化反应。在新型阳离子硫试剂领域,本课题组[11-13]和Shen课题组[14-15]报道亲电性“N—S”试剂的合成及应用。
为深入研究该类反应中手性诱导机制,并期望籍此设计高效不对称催化剂体系[16],本以(1S)-(-)-2,10-樟脑内磺酰胺为手性骨架,合成一系列芳硫基试剂1a~1c,并将其应用于β-酮酯的不对称芳硫化反应(Scheme 1~2)。
1 实验部分
1.1 仪器与试剂
XT4A型显微熔点仪;KRUSS P8000型数字旋光仪;Brucker Avance 400 MHz型核磁共振谱仪(CDCl3为溶剂,TMS为内标);IRAffinity-1s型红外光谱仪(KBr压片);Agilent Q-TOF 6520型高分辨质谱仪;LC-20A型高效液相色谱仪。
β-酮酯底物参考文献方法[17]合成;其余试剂购于Acros, Alfa, Aladdin, Inno Chem,分析纯或化学纯。
1.2 合成
(1) (1S)-(-)-N-芳硫基樟脑内磺酰胺试剂(1a~1c)的合成通法
氩气氛围下,于0 ℃将溶有磺酰氯(10 mmol, 1.0 equiv)的二氯甲烷(2 mL)溶液滴加到装有对甲基苯硫酚、对甲氧基苯硫酚或对溴苯硫酚(10 mmol, 1.0 equiv)、二氯甲烷(10 mL)和三乙胺(1.5 mmol, 0.15 equiv)的Schlenk反应瓶中,滴毕,搅拌反应15 min。移除冰浴,恢复至室温,搅拌1 h;再次将反应液冷却至0 ℃备用。另取一个100 mL Schlenk反应瓶并用氩气置换3次,依次向反应瓶中加入(1S)-(-)-樟脑内磺酰胺(10 mmol, 1.0 equiv)、二氯甲烷(10 mL)和三乙胺(13 mmol, 1.3 equiv),冷却至0 ℃;将第一个反应瓶中的混合物缓慢滴加到装有(1S)-(-)-樟脑内磺酰胺的反应液中,滴毕,自然升温至室温,搅拌反应过夜。加水稀释,用乙酸乙酯(3×20 mL)萃取,合并有机相,用无水硫酸钠干燥,旋蒸浓缩,残余物经硅胶柱层析[洗脱剂:V(石油醚):V(乙酸乙酯)=20:1]纯化得白色固体1a~1c。


(2)β-酮酯的不对称芳硫化反应
于25 mL的Schlenk反应管中,依次加入底物β-酮酯(0.1 mmol, 1.0 equiv)、甲苯(1 mL)、 (1S)-(-)-N-芳硫基樟脑内磺酰胺(1a~c, 0.12 mmol, 1.2 equiv)和碳酸钾(0.1 mmol, 1.0 equiv)反应48 h,薄层色谱(TLC)监测。反应结束后,经层析柱分离,用洗脱剂V(石油醚):V(乙酸乙酯)=20:1纯化,获得目标产物3a~3l。



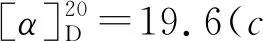
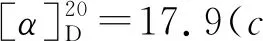
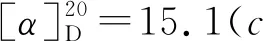
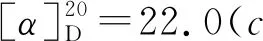


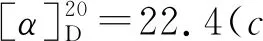

表1 (1S)-(-)-N-芳硫基基樟脑内磺酰胺与β-酮酯反应的手性诱导效率a

1-氧-2-对甲苯硫基-2,3-二氢-1H-茚-2-羧酸乙酯(3j):黄色油状物30.0 mg,收率92%, 0%ee;1H NMR(400 MHz, CDCl3, 298K)δ: 7.76(d,J=7.7 Hz, 1H), 7.56(td,J=7.4 Hz, 1.2 Hz, 1H), 7.39~7.32(m, 4H), 7.05(d,J=7.8 Hz, 2H), 4.23(q,J=7.1 Hz, 2H), 3.86(Jab=17.7 Hz, 1H), 3.30(Jab=17.7 Hz, 1H), 2.29(s, 3H), 2.21(s, 3H), 1.25(t,J=7.1 Hz,3H);13C NMR(100 MHz, CDCl3)δ: 196.9, 168.9, 151.0, 140.0, 136.4, 135.4, 134.4, 129.6, 128.0, 126.5, 126.0, 125.2, 63.8, 62.6, 39.3, 21.3, 14.1; IR(KBr)ν: 2982, 1714, 1261, 750 cm-1; HR-MS(ESI-TOF)m/z: calcd for C19H19O3S{[M+H]+}327.1049, found 327.1051; HPLC(Chiralcel AD-H, hexane/i-PrOH=95∶5, 流速1 mL/min), 保留时间: 11.939 min(major), 13.006 min(minor)。

Scheme 3
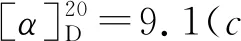
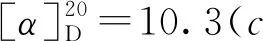
2 结果与讨论
2.1 手性诱导效果的影响因素
添加剂、碱、溶剂、温度、试剂结构等因素对β-酮酯的不对称α-芳硫化反应的手性诱导效率的影响结果见表1。
如表1所示,无任何添加剂(Entry 1),Lewis酸如Zn(OTf)2、 Me3SiOTf(Entries 2~3)、有机碱(DMAP,对二甲基氨基吡啶,Entry 8)、手性碱(qunidine, Entry 9)等,均不能促进反应或对反应促进作用很弱。无机碱(K2CO3、 Cs2CO3、 K3PO4、 Li2CO3)能促进该反应,以31%~68%收率和16%~39%ee的对映选择性获得目标化合物3a(Entries 4~7)。无机碱的碱性强弱与反应的速率有关,但和产物的对映选择性并无明显关联,碳酸钾表现出最好的对映选择性为39%ee(Entry 4)。添加剂的用量显著影响产物的收率,但对目标产物的对映选择性无明显影响(Entries 4, 10, 11)。
随后,以碳酸钾为碱,考察了溶剂对反应的影响。极性溶剂有利于加快反应速度,目标产物的收率高(Entries 12~13),但质子型溶剂可能会促进手性试剂解离而导致产物的对映选择性显著下降(Entry 14)。甲苯为最合适的溶剂,产物的收率为91%、对映选择性为40%ee(Entry 15)。降低温度仅影响反应速率,对产物的对映选择性无明显影响(Entry 15 vs 16)。最后,研究了不同取代基的手性芳硫基试剂对对映选择性的影响(Entries 15, 17~18), (1S)-(-)-N-对甲基苯硫基樟脑内磺酰胺表现出最佳收率91%,对映选择性为40%ee。
反应最优条件为:(1S)-(-)-N-对甲基苯硫基樟脑内磺酰胺为试剂、碳酸钾为催化剂、甲苯为溶剂、室温反应。
2.2 底物结构的影响
将筛选的最优条件应用到环状β-酮酯类底物2a~2l来探究手性试剂的适用性,考察底物结构对手性诱导效果的影响,结果见Scheme 3。
如Scheme 3所示,六元环底物酯基位阻增加时,目标产物的对映选择性从40%ee降低到29%ee(3a~3c)。底物芳环含有吸电子基团时,产物的收率降低至44%~85%(3d~3f);底物引入供电子基团时,产物产率在90%~95%(3g~3i)。芳环取代基的电子效应显著影响反应收率,含有给电子基团的反应活化能低,收率高;但对产物的对映选择性影响较小。五元环类底物的反应收率高,但乙酯产物的ee值为0,不过酯基位阻增加为金刚烷基时,产物的对映选择性提高至24%ee(3j~3l)。这可能是五元环β-酮酯烯醇化活性中间体比六元环底物具有更大的环张力,反应活性高,产物的收率高。综上所述,该试剂对底物适用范围较好,产率高,但对映选择性一般。产物3b的绝对构型是通过对比文献报道该化合物的旋光度符号而确定为R构型[18],其它产物的构型根据相似反应机理推导确定。
首次以61%~72%收率合成手性亲电性阳离子(-)-N-芳硫基磺酰胺类试剂(1a~1c),并将其应用于β-酮酯的不对称α-芳硫化反应,获得优异的产率和中等的对映选择性。以K2CO3为碱,在甲苯溶剂中搅拌反应,底物适应范围较好,五元环、六元环β-酮酯的不对称α-芳硫化反应的收率高达97%,但对映选择性最高仅40%ee。本研究为深入认识“N-S”阳离子试剂的手性诱导机制提供了数据,也为后续设计合成该类手性试剂、以及不对称催化反应提供了有益线索。

