虾源副溶血性弧菌PirB蛋白单克隆抗体的制备及鉴定
邢广旭,孙雪峰,钱祁昇,张运尚,闫茂仓
(1.河南省农业科学院动物免疫学重点实验室,河南郑州 450002;2.浙江省海洋水产养殖研究所,浙江温州 325005)
副溶血性弧菌(Vibrioparahaemolyticus,VP)为弧菌属革兰氏阴性兼性厌氧,广泛分布于海洋、河口及海湾,是天然和人工养殖动物的病害源之一,其致病菌株感染可导致多种动物发病,不仅影响动物的生长发育,还会威胁人类健康。副溶血性弧菌作为水产品疫源性的主要污染源,一直以来被严格监测[1-2]。在养殖的鱼类[3]、贝类[4-5]、甲壳类[6-7]中均有副溶血性弧菌感染致病的报道。虾源副溶血性弧菌是一种严重危害养虾业的重要致病菌,可导致虾苗早期发病,一般感染放养后7 d~30 d的虾苗,主要引起虾肝胰腺等组织损坏,造成肝功能紊乱及消化系统障碍[8],临床表现为病虾体色发白、虾壳变软、肝胰腺颜色暗淡苍白或糜烂发红等[9-11];基于该病引起的组织病理学特征将其定义为急性肝胰腺坏死综合症,亦称为“急性肝胰腺坏死病”、“偷死综合征”或“早期死亡综合征”。由虾源副溶血性弧菌引发的急性肝胰腺坏死病是一种全球性的对虾传染性疾病,造成了对虾养殖产业巨大损失。特异性副溶血性弧菌致病性存在相关质体pVA1,该质体带有杀昆虫毒素(photorhabdus insect-related,Pir)PirA和 PirB,且该毒素与杆菌属相关副溶血性弧菌携带的毒素蛋白PirA和PirB,且该毒素与杆菌属相关副溶血性弧菌携带的毒素蛋白PirA和PirB均是引起急性肝胰腺坏死综合症的关键,其毒性基因pirA和pirB多见于质粒[12]。本研究采用单克隆抗体技术,利用杆状病毒表达系统表达重组PirB蛋白并制备单克隆抗体,以期为虾源副溶血性弧菌引发疾病的临床诊断提供重要的生物材料。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级Balb/c小鼠,雌性,6周龄~8周龄,购自济南朋悦实验动物繁殖有限公司。
1.1.2 主要试剂 载体pET-28a、大肠埃希氏菌感受态细胞BL21(DE3)、异丙基-β-D-硫代半乳糖苷(IPTG)、HRP-羊抗鼠IgG抗体、DMEM培养基、1640培养基,北京索莱宝生物科技有限公司产品;TaqDNA聚合酶、BamHⅠ和XhoⅠ限制性内切酶、T4 DNA连接酶、DNA Maker、切胶回收试剂盒、质粒提取试剂,Sigma公司产品;AEC酶底物试剂盒,北京中杉金桥生物技术有限公司产品;胎牛血清,Ginco公司产品;SP2/0骨髓瘤细胞,河南省农业科学院动物免疫学重点实验室保存。
1.1.3 主要仪器 移液抢,德国Eppendorf公司产品;PCR扩增仪,德国Thermo Fisher公司产品;电泳仪,北京六一生物科技有限公司产品;凝胶成像仪和全自动洗板机美国Bio-Rad公司产品;高速台式离心机 ,德国Eppendorf公司产品;全自动多功能酶标仪,德国BMG公司产品;恒温培养箱,日本三洋公司产品;超声波细胞破碎仪,美国Sonics公司产品。
1.2 方法
1.2.1 PirB重组蛋白表达载体的构建 根据虾源副溶血性弧菌PirB基因序列(GenBank:CAQ85805.1)设计引物,同时在引物上下游分别插入BamHⅠ和XholⅠ酶切位点,构建重组质粒,目的片段长度为1 314 bp,引物为:上游引物:5′-GGATCCATGACCAACGAATACGTGGT-3′,下游引物:5′-CTCGAGTTTTTCGGTGCCGAATTCGT-3′。以重组质粒为模板,通过PCR反应扩增PirB基因。反应体系 :2× PCRTaqMaster Mix 12.5 μL,上、下游引物(10 μmol/L)各 1 μL,模板1 μL,共25 μL体系。反应条件:95℃ 3 min;95℃ 35 s,56℃ 30 s,72℃,80 s,共30个循环;最后72℃ 10 min。用15 g/L的琼脂糖凝胶电泳进行鉴定,将扩增产物进行切胶回收。将重组质粒转化加入大肠埃希氏菌感受态细胞BL21(DE3)中,加入到含氨苄青霉素(Amp,终浓度为100 μg/mL)的LB培养基进行转化,待培养至对数期时进行双酶切鉴定。
1.2.2 PirB重组质粒在大肠埃希菌中的诱导及表达 取适量的LB液体培养基,按照1∶100加入转化后含有PirB重组表达载质粒的菌液和Amp(终浓度为100 μg/mL),37℃、180 r/min复苏培养2 h~4 h;离心去上清,重悬菌体,增菌培养;加入异丙基-β-D-硫代半乳糖苷(IPTG,终浓度为1 mmol/L),30℃诱导表达8 h;收集诱导过的菌液6 000 r/min离心,离心10 min,去上清,使用磷酸盐缓冲盐溶液(PBS,pH8.0)洗涤沉淀2次;沉淀加入20 mL的PBS缓冲液,在冰上超声破碎,工作5 s,停止10 s,共工作20 min;随后13 000 r/min、4℃离心15 min,用0.45 μm的滤器过滤,收集上清液进行SDS-PAGE。
1.2.3 重组PirB蛋白的纯化和鉴定 取细菌裂解上清液进行镍柱纯化,分别用不同浓度的咪唑溶液(浓度分别为10、20、100、200、300、500 mmol/L)对目的蛋白进行洗脱,洗脱液进行SDS-PAGE,确定最佳的咪唑洗脱浓度。
用Western blot对纯化后的PirB蛋白进行鉴定,将纯化后的PirB蛋白与5×Loading buffer按照4∶1的体积混匀后,100℃加热10 min,离心,取上清点样,每个样品终点样量为30 μg,装好电泳系统,200 V电压,溴酚蓝刚跑出分离胶时停止电泳;卸下胶板,进行转膜,使用PBST洗涤;加入虾源副溶血性弧菌阳性血清,37℃孵育1 h后用PBST洗涤,加入HPR-羊抗鼠IgG抗体,37℃孵育1 h;用PBST洗涤后,加入显色液静置5 min后放入凝胶成像系统观察结果。
1.2.4 小鼠免疫 小鼠免疫以重组蛋白PirB作为免疫原,随机选取6周龄~8周龄Balb/c小鼠为设置免疫组和对照组,免疫组注射免疫原(约含重组蛋白75 μg),对照组注射等体积PBS。首次免疫将重组蛋白与弗氏完全佐剂等量混匀,乳化后在小鼠颈背部皮下多点注射。间隔21 d,进行第2次免疫;间隔21 d后,进行第3次免疫。第2次免疫和第3次免疫的具体操作方法和剂量同首次免疫。
1.2.5 杂交瘤细胞株的融合和筛选 参考经典PEG融合法[13],将免疫后小鼠的脾细胞与SP2/0细胞按5∶1比例制备杂交瘤细胞,然后采用间接ELISA方法确定产生抗体的杂交瘤细胞株。初步筛选出阳性杂交瘤细胞,再选择强阳性细胞采用有限稀释法重复亚克隆3次,使克隆化细胞板的阳性率达到100%,进行间接免疫荧光检测。
1.2.6 单克隆抗体制备和抗体效价的检测 取适量PBS溶液重悬离心后的阳性杂交瘤细胞,腹腔注射至致敏小鼠体内,1周后待小鼠腹部肿胀隆起,无菌采集腹水,8 000 r/min离心20 min后取上清留上清,用PBS稀释上清,放置于PBS缓冲液中透析,3 000 r/min离心,将上清加入饱和硫酸铵溶液中进行纯化。纯化后的抗体采用间接ELISA法检测效价,以免疫小鼠血清为阳性对照,以SP2/0细胞腹腔注射制备的腹水为阴性对照和空白对照,结果判定以P/N>2.1时腹水的最大稀释倍数即腹水效价。
1.2.7 单克隆抗体特异性分析 以PirB蛋白作为抗原,抗PirB单克隆抗体作为一抗,HRP-羊抗鼠作为二抗,抗原包被液为空白对照,免疫前小鼠血清为阴性对照;以白斑综合征病毒(White spot syndrome virus,WSSV)、黄头病病毒(Yellow head disease,YHV)和偷死野田村病毒(Covert mortality nodavirus,CMNV),分别作为特异性分析的病原,采用间接ELISA法检测对单克隆抗体进行特异性分析。
2 结果
2.1 PirB重组蛋白表达载体鉴定结果
以虾源副溶血性弧菌PirB重组质粒为模板,加入引物与酶后进行PCR扩增得到PirB基因片段,经15 g/L琼脂糖凝胶电泳检测(图1),在1 300 bp出现目的条带,表明本研究成功构建PirB重组质粒。
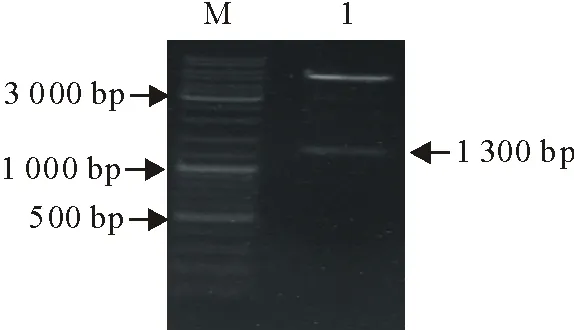
M.DNA标准DL 10 000;1.重组载体M.DNA Maker DL 10 000;1.Recombinat plasmid图1 PirB重组蛋白鉴定结果Fig.1 Identification results of PirB recombinant protein
2.2 PirB重组质粒在大肠埃希菌中的诱导及表达
将PCR产物与载体连接后转化入感受态细胞进行表达(图2),结果表明,30℃诱导表达8 h表达量多,为最适条件。
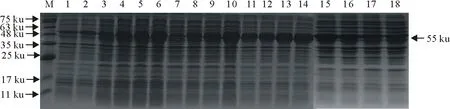
M.蛋白分子质量标准;1.未诱导;2.诱导;3~6.16℃诱导2、4、6、8 h;7~10.25℃诱导2、4、6、8 h;11~14.30℃诱导2、4、6、8 h;15~18.37℃诱导2、4、6、8 hM.Protein molecular weight Marke;1.No induction;2.Induction;3-6.16℃induction 2,4,6,8 h;7-10.25℃induction 2,4,6,8 h;11-14.30℃induction 2,4,6,8 h;15-18.37℃ induction 2,4,6,8 h图2 PirB蛋白诱导表达条件摸索Fig.2 Exploring the expression conditions of PirB protein
2.3 PirB蛋白的纯化和鉴定
取超声破碎后的菌液上清和沉淀进行电泳分析,结果发现PirB蛋白主要存在于细菌裂解液上清中。取细菌裂解上清液进行镍柱纯化,分别用不同浓度的咪唑溶液(浓度分别为10、20、100、200、300、500 mmol/L)对目的蛋白进行洗脱,浓度为100 mmol/L咪唑可将目的蛋白进行有效洗脱(图3)。对纯化后的PirB蛋白进行Western blot鉴定,在55 ku位置出现目的条带(图4)。
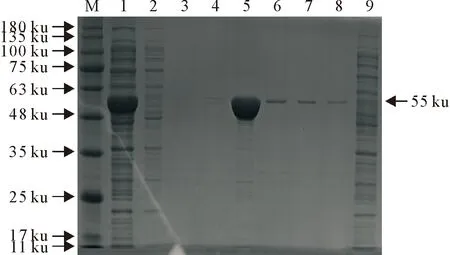
M.蛋白分子质量标准;1.上清液;2.沉淀;3~8.10 mmol/L~500 mmol/L咪唑洗脱;9.空载M.Protein molecular weight Marke;1.Supernatant;2.Precipitate;3-8.Elutions with different concentrations of imidazole;9.Empty vector图3 PirB蛋白纯化条件摸索Fig.3 Exploring the purification conditions of PirB protein
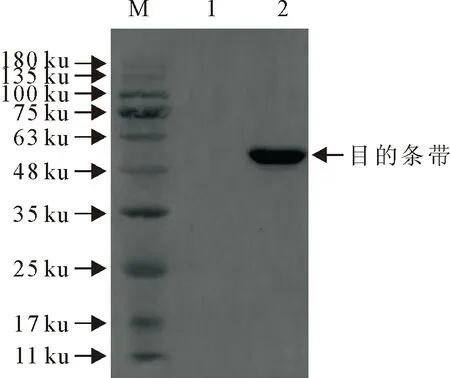
M.蛋白分子质量标准;1.空载;2.PirB蛋白M.Protein molecular weight Marke;1.Empty vector;2.PirB protein图4 PirB蛋白纯化鉴定结果Fig.4 Identification results of PirB protein purification
2.4 PirB蛋白免疫动物血清ELISA效价测定
采用1.2.4所述免疫方法免疫Balb/c小鼠,三免后用酶标仪测定450 nm处的吸光度值(OD)。以 OD阳性/OD阴性>2.1的最高稀释倍数作为该血清的效价。小鼠血清的ELISA效价见表1,血清稀释倍数达到1∶51 200时,P/N为2.4,达到细胞融合试验的小鼠抗体水平,可用于下一步试验。
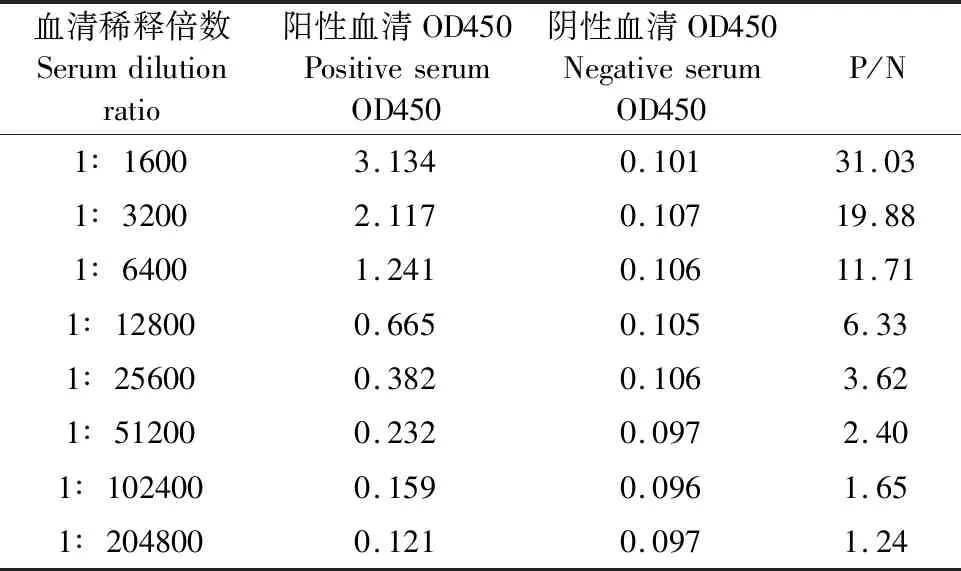
表1 间接ELISA测定单克隆抗体效价结果Table 1 Determination of monoclonal antibody titters by indirect ELISA
将筛选出的阳性杂交瘤细胞注射入小鼠腹腔,收集腹水进行间接ELISA检测,结果见表2,已筛选出7株杂交瘤细胞效价较高,分别命名为3E4、33C8、36B3、42D11、43F2、55G5、81C9,其中36B3效价最高,达到1∶2.56×106。

表2 间接ELISA检测腹水PirB效价结果Table 2 Detection of PirB titer in ascites by indirect ELISA
2.5 单克隆抗体的特异性试验
将白斑综合征病毒(WSSV)、黄头病病毒(YHV)、偷死野田村病毒(CMNV)与虾源副溶血性弧菌病原包被酶标板,用单克隆抗体进行间接ELISA检测,统计单克隆抗体的特异性反应率,结果如表3所示,表明制备的单克隆抗体具有良好的特异性,可以用于虾源副溶血性弧菌的检测。
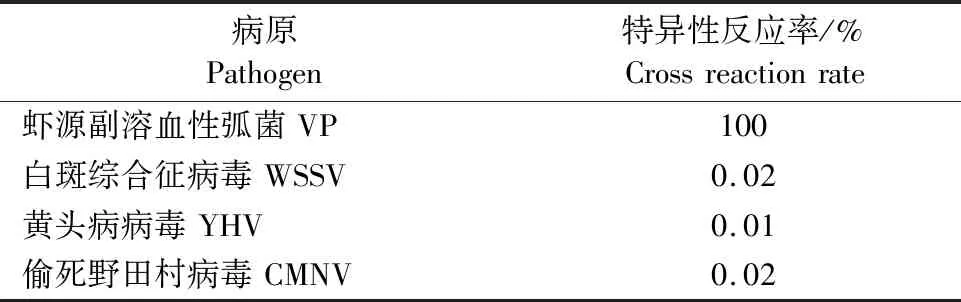
表3 单克隆抗体的特异性Table 3 Specificity of monoclonal antibody
3 讨论
虾源副溶血性弧菌是近年来全球性对虾急性肝胰腺坏死病暴发的主要病原,一直被受关注,对其污染状况、致病性、耐药性以及定量风险评估[14-17]等进行一系列的研究,认为控制养殖过程中的副溶血性弧菌对养殖成功率至关重要。实际生产中发现,虾被副溶血性弧菌感染后引起的病虾体色发白、虾壳变软、肝胰腺颜色暗淡苍白或糜烂发红等病症,与环境应激、微孢子虫[18-19]、白斑综合征病毒[20]等引起的症状十分相似,临床上观察到的主要症状无法从根本上对病因进行准确判断,必须通过实验室检测分析。因此,及时、快速、准确的发现虾源副溶血性弧菌,对于防控这种致病菌是非常有必要的。
虾源副溶血性弧菌的检测和鉴定主要采用细菌生化鉴定、血清学分型、基质辅助激光解析电离飞行时间质谱(MALDI-TOF-MS)鉴定和PCR方法[21]。PCR方法主要有TaqMan-MGB探针荧光定量PCR法、双重PCR法[22]、套式PCR法[23]等。PCR检测所用的引物为AP1-AP4[23]、TUMSAT-Vp3、VpPirA-284和VpPirB-392中的一种,该方法具有较好的准确性和灵敏性。但是该方法存在人员水平和仪器设备要求高、扩增产物和核酸提取中标本间的交叉污染问题,以及标本或核酸纯化过程中出现的扩增反应抑制物、扩增仪孔间温度的差异以及核酸提取中的随机误差等缺点,使得该方法在临床应用和疾病筛查方面存在诸多不便。
单克隆抗体技术具有特异性强、灵敏度高、交叉反应少的特点,被广泛应用于各种病原的免疫学检测,尤其适合样品大批量快速筛查。本研究采用单克隆抗体技术,利用PirB基因序列通过PCR扩增后构建重组质粒,然后利用杆状病毒表达系统对PirB蛋白进行表达,纯化后用于免疫小鼠制备脾细胞。通过间接ELISA进行筛选,确保筛选到分泌与毒素蛋白PirB具有特异性反应抗体的杂交瘤细胞并用于制备腹水,获得特异性较强的单克隆抗体,为虾源副溶血性弧菌的监测与防控提供了技术支持以及进一步研究PirB的功能奠定了一定的基础,对于虾源副溶血性弧菌引发的疫病的防控以及养虾业的发展具有一定的意义。

