猪戊型肝炎病毒4型感染新西兰大白兔肝脏和脑组织中IL-4与IL-5的表达
杨莎莎,王 源,张以芳,郑晓林,彭海芬,吴俊达,王国君,李文贵
(云南农业大学动物医学院,云南昆明 650201)
戊型肝炎(Hepatitis E,HE)是由戊型肝炎病毒(Hepatitis E virus,HEV)引起的粪-口途径传播疾病,是全球主要的病毒性肝炎之一。目前已发现HEV的7种基因型,具有扩大宿主范围和跨种感染的潜力,有大量研究表明,基因3和4型会引起人畜共患性感染[1],猪的3型和4型HEV病毒株会经粪-口途径传给人类[2],在世界范围内引起戊型肝炎的散发。
体液免疫和细胞免疫在机体抗病毒感染中均发挥着重要的作用,目前,关于HEV感染后的细胞免疫应答的研究相对较少。为更好地了解在 HEV感染中的细胞免疫应答机制,本研究以新西兰大白兔为动物模型,采用腹腔注射方式感染猪源HEV[3],对感染不同时期的兔子肝脏、脑组织内的白细胞介素4(interleukin 4,IL-4)和白细胞介素5(interleukin 5,IL-5)的表达进行研究,为进一步深入探讨HEV的感染机制,制定相应的防控措施提供新的研究思路和科学依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 3月龄~4月龄的雄性新西兰大白兔共15只,HEV抗体检测为阴性。
1.1.2 HEV阳性样品 采自昆明周边猪场的2月龄~3月龄仔猪新鲜粪便,检测为HEV RNA阳性的样品,用5 mL离心管盛放并保存于-80℃超低温冰箱。
1.1.3 主要试剂 RNA提取试剂(TRIzol)、DNA Marker DL 1 000 、DNA纯化回收试剂盒、质粒小量提取试剂盒(离心柱型)、两步法反转录试剂盒、Trans HIFI PCR MIX,北京全式金生物技术有限公司产品;Prime Script RT®reagents kit(反转录试剂)、SYBR®Prime ExTaqT Ⅱ(荧光染料),TaKaRa公司产品;猪戊型肝炎病毒IgG抗体试剂盒,北京万泰生物药业股份有限公司产品;多聚甲醛、HE染液等为国产试剂。
1.1.4 主要仪器设备 PCR扩增仪,美国Bio-Rad公司产品;电泳仪和水平板电泳槽,北京六一生物科技有限公司产品;凝胶成像系统,美国UVP公司产品;石蜡切片机,美国Thermo Fisher公司产品;生物组织包埋机,浙江省科迪仪器设备有限公司产品;生物倒置显微镜,OLYMPUS公司产品;荧光定量PCR仪,美国ABI公司产品;核酸定量仪,上海嘉鹏科技有限公司产品;高速冷冻离心机,德国SiGma公司产品。
1.2 方法
1.2.1 病毒悬液的制备 将冻存于-80℃冰箱的HEV阳性粪便样品用生理盐水4℃过夜浸毒,4℃下3 000 r/min离心30 min,经0.22 μm滤器过滤后加入1%双抗,备用。
1.2.2 攻毒及采样 新西兰大白兔随机分为2组,攻毒组10只,对照组5只,用北京万泰药业有限公司HEV ELISA试剂盒检测血清中HEV抗体和反转录套式PCR(RT-nPCR)检测HEV核酸,结果全为阴性。单独隔离饲养。
试验组每只新西兰大白兔经腹腔注射10 mL猪HEV阳性样品悬液,对照组每只注射等量的生理盐水,攻毒后从第3天(3 dpi)开始固定时间采集实验动物的粪便样品,用高压灭菌的5 mL离心管盛放并保存于-80℃冰箱保存,分别于7、14、21、28、35 dpi处死攻毒组2只、对照组1只,分别采取心、肝、脾、肺、肾、肠、脑样本,一部分用高压灭菌的5 mL离心管盛放并保存于-80℃备用,一部分用40 mL/L多聚甲醛溶液固定用于组织病理学检查。
1.2.3 组织病理学观察 取固定的组织材料制作切片,利用苏木素-伊红(HE)染色,用显微镜对染色完成的切片进行观察。
1.2.4 感染的确认及相关炎症细胞因子的检测
1.2.4.1 引物设计与合成 根据GenBank中各基因序列,参考文献选择引物并由北京擎科生物科技有限公司昆明分公司合成(表1)。

表1 试验中用到的引物Table 1 Primers used in this study
1.2.4.2 兔子粪便及组织总RNA 的提取 使用RNA提取试剂(TRIzol)提取总RNA。
1.2.4.3 cDNA的合成及RT-nPCR扩增目的片段 利用全式金两步法反转录试剂盒合成cDNA。第1轮PCR反应体系为2×TransTaqTm HiFi PCR SuperMix II 10 μL,HEV-1 和HEV-4(25 μmol/L)各0.5 μL,cDNA 2 μL,加入RNase free water将总体积调至20 μL。循环参数为:94℃ 2 min;94℃ 30 s、56℃ 30 s、72℃ 30 s,35个循环;最后72℃延伸7 min。取第1轮PCR产物(稀释50倍)1 μL作为模板,HEV-2和HEV-3(25 μmol/L)各0.5 μL,其他成分与第1轮相同,用RNase free water将总体积调至20 μL。反应条件将内循环改为25个循环,其他与第1轮相同。
1.2.4.4 PCR产物检测 配制15 g/L琼脂糖凝胶,加入终浓度为0.5 μg/mL的溴化乙锭(EB)。取5 μL PCR产物与Loading buffer混合后加入点样孔,以1×TAE为电泳缓冲液,120 V电泳30 min后,凝胶成像系统下观测结果,出现137 bp条带的样品则为阳性。
1.2.4.5 cDNA的合成及实时荧光定量PCR 利用核酸蛋白仪测定核酸的质量和纯度,配制反转录体系:5×PrimeScript buffer 2 μL,PrimeScript RT Enzyme MixⅠ 0.5 μL,Random 6 mers(100 μmol/L)0.5 μL,Oligo dT Primer(50 μmol/L)0.5 μL,总RNA 500 ng,用RNase free water 补足10 μL。置PCR仪中37℃ 15 min,85℃ 30 s灭活反转录酶,冷却后-20℃保存备用。
Real-time PCR反应体系:SYBR®Prime ExTaqTM12.5 μL,Mx1F (10 μmol/L)0.5 μL,Mx1R (10 μmol/L)0.5 μL,cDNA1 μL ,RNase free water 10.5 μL,总体积25 μL。反应程序:95℃ 30 s;95℃ 30 s,60℃ 5 s,共35个循环。
2 结果
2.1 感染确认
2.1.1 粪便RT-nPCR结果 将HEV-4经腹腔接种新西兰大白兔,在攻毒第3天开始可以在粪便中检测到HEV。在感染的第3、5、7、14、28天均可以检测到病毒,但部分兔感染初期在粪便检测不到病毒,说明新西兰大白兔有间歇性排毒现象(图1)。

M.DNA标准DL 1 000;1.阴性对照;2~6.5个样品检测结果M.DNA Marker DL 1 000;1.Negative control;2-6.5 Sample test results图1 粪便中HEV PCR产物电泳结果(3 dpi)Fig.1 Electrophoresis results of HEV PCR products in feces(3 dpi)
2.2 组织病理学观察
2.2.1 肝脏 对照组兔肝脏在试验期内未见明显病变,肝脏结构清晰,肝细胞排列整齐。感染后第7天试验组兔肝脏出现肝小叶间淋巴细胞浸润、肝细胞颗粒变性;接种第14天肝脏中出现局灶性淋巴细胞浸润、肝细胞索排列紊乱、肝窦淤血;肝细胞变性、坏死,枯否细胞增多(图2)。

A.中央静脉淋巴细胞浸润(HE 200×);B.肝细胞变性,中央静脉淤血(HE,200×);C.肝窦淤血(HE 200×);D.中央静脉大量细胞渗出 (HE 400×)A.Central vein lymphocyte infiltration(HE 200×);B.Hepatocyte degeneration,central venous congestion;(HE 200×);C.Hepatic sinus congestion(HE 200×);D.Central venous massive red blood cell exudation(HE 400×)图2 肝脏组织学病变(14 dpi)Fig.2 Liver histopathological lesions(14 dpi)
2.2.2 脑 对照组兔脑未见明显病变。试验组兔脑膜血管扩张,淤血并伴有脑膜出血;脑膜的分子层内小胶质细胞増生;血管周围淋巴细胞浸润,形成管套袖现象;脑室周围组织发生液化性坏死,形成空泡样疏松结构,伴有炎性细胞浸润;神经细胞坏死,小胶质细胞浸润吞噬神经细胞(图3)。
2.3 IL-4和IL-5 Real-time PCR检测结果
2.3.1 肝脏中各细胞因子检测结果 Real-time PCR检测不同感染时期兔肝脏中IL-4和IL-5基因表达水平,结果显示,IL-4在第7天mRNA转录水平比对照组高;从第14天开始转录水平降低,直至第35天恢复与对照组一致。IL-5在第7天mRNA转录水平比对照组高;第14天转录水平逐渐下降,但依然高于对照组,直至第35天降低至对照组数值附近(表1、图4)。
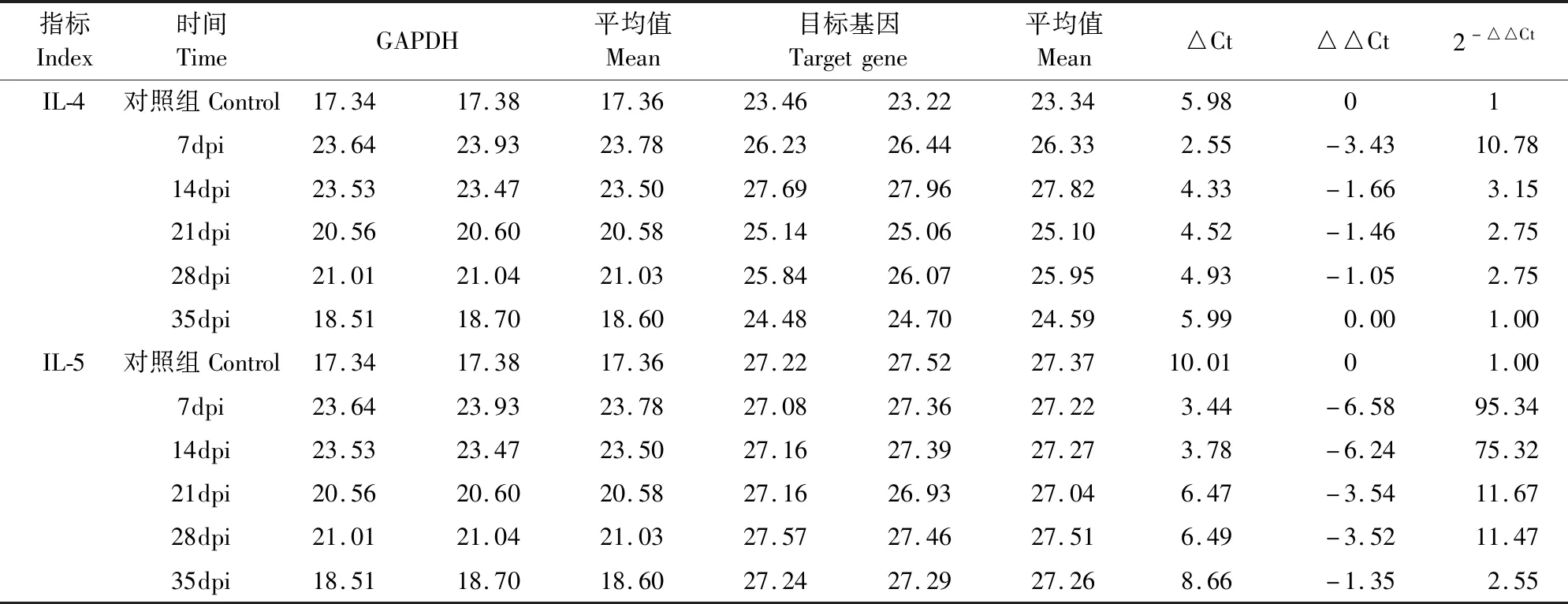
表1 肝脏中IL-4和IL-5 mRNA检测结果Table 1 Detection results of IL-4 and IL-5 mRNA in liver

A.空泡样(HE 200×);B.胶质细胞浸润 (HE 400×);C.管套袖现象 (HE 400×);D.脑膜出血 (HE 400×)A.Vacuolar-like(HE 200×);B.Glial cell infiltration(HE 400×);C.Vascular cuff(HE 400×);D.Meningeal hemorrhage;(HE 400×)图3 脑组织病理学病变Fig.3 Brain histopathological lesions
2.3.2 脑组织各细胞因子检测结果 Real-time PCR检测不同感染时期兔脑中IL-4和IL-5基因表达水平,检测结果显示,脑中IL-4的转录水平在感染初期就明显降低,第28天达到最低值,只有对照组的10%左右,第35天转录水平恢复至正常水平。IL-5在感染初期下调,第14天上调,在第35天恢复至正常水平(表2、图4)。
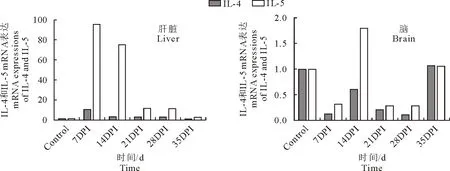
图4 肝脏及脑中IL-4和IL-5 mRNA表达Fig.4 The expressions of IL-4 and IL-5 mRNA in liver and brain

表2 脑中IL-4和IL-5 mRNA检测结果Table 2 Detection results of IL-4 and IL-5 mRNA in brain
3 讨论
目前,对HE的致病机理和免疫机制的认识尚浅。有研究表明T细胞和自然杀伤(NK)细胞在介导HEV感染免疫应答中起关键作用,所分泌的细胞因子IL-4参与了免疫应答。IL-4的生物作用包括刺激活化B细胞和T细胞增殖、CD4+T细胞分化成Ⅱ型辅助T细胞(Th2),它也在调节体液免疫和适应性免疫中起关键作用。有研究表明,IL-4与肝脏的炎症及纤维化形成有关系[6]。IL-5主要由活化的Th2细胞分泌产生,自然杀伤细胞、肥大细胞、B细胞均可产生,IL-5在免疫系统及维持机体生理平衡上发挥着重要作用,它的分泌或基因表达异常往往导致或促进疾病的发生。然而,目前在HEV感染导致的机体损伤中的IL-5 mRNA表达水平状况了解甚少。
IL-4和IL-5属于Th2类细胞因子,T细胞介导的免疫反应与多种肝病的发病机制有关[7]。T细胞在肝脏中的免疫作用是通过多种细胞因子的释放来介导的,这些细胞因子通过多种信号级联的激活来靶向肝细胞和免疫细胞。在本次研究中发现HEV人工感染新西兰大白兔后,Real-time PCR检测到感染初期肝脏中IL-4表达水平明显上升,高于对照组。这与张剑英的研究结果一致[8]。IL-4水平的升高可以抑制Th1细胞因子的产生,促进 Th2细胞因子的表达,从而减轻肝细胞损伤,对机体的免疫功能和炎症过程具有重要的调节活性。在各种肝损伤模型中已证明IL-4有保护性和有害性,注射IL-4可减轻肝脏缺血/再灌注损伤[9]。在本试验中,感染第7天肝脏中的IL-4表达水平最高,表明在感染早期HEV进入肝脏可引发IL-4表达增加,从而减轻肝细胞的损伤。相反,有研究表明IL-4在Con A诱导的肝炎中扮演着重要角色,其通过增强肝细胞和窦状内皮细胞中趋化因子的表达,并诱导IL-5表达,从而促进炎性细胞的募集进入肝脏并导致肝炎[7]。对于同一器官而言,感染后兔的肝脏中IL-4表达增加的同时IL-5的表达也升高,在感染第14天时两者表达量同时下降但都远高于对照组,在第35天又基本恢复与对照组一致,因此说明 IL-4和IL-5等细胞因子在HEV诱发的肝炎发展中发挥作用是合理的。
IL-5主要是由Th2细胞产生,能特异作用于嗜酸粒细胞凋亡的细胞因子。通过RT-PCR方法检测急、慢性肝损伤患者PBMCs中IL-5 mRNA表达水平,结果显示均高于健康者[10]。本研究中在感染第7天检测到高表达水平的IL-5 mRNA,中期稍微降低但远高于对照组,后期恢复一致。结合组织病理学观察结果,接种第14天肝脏中出现局灶性淋巴细胞浸润、肝细胞索排列紊乱、肝窦淤血;肝细胞变性、坏死,枯否细胞增多等病理损伤。这些病理变化与张闽峰等对戊型肝炎病人观察到的肝细胞变性、灶性坏死、枯否细胞增生等特征相似[11]。结果提示IL-5促进肝脏的炎性损害,导致严重的肝细胞损伤,在肝损伤中扮演着重要角色。
HEV能在肝脏以外的其他器官复制增殖。本研究前期试验表明,除肝外,病毒可存在于不同的组织器官中,感染后第7天在兔的肝脏、脑、小肠、心脏、肾、脾和肺中均可检测到 HEV,组织病理学观察结果显示,感染能造成脑、心脏、肾脏等组织不同程度的病理损伤,同时,检测感染兔子脑组织的IL-4和IL-5两种细胞因子的表达水平,发现相较于对照组也有变化,有研究表明,多种细胞因子如白细胞介素和肿瘤坏死因子等介导炎症反应,参与继发性脑损伤的病理生理过程[12],但病毒感染继发脑组织损害是一个多重因素共同参与的复杂的病理生理过程,新西兰大白兔感染HEV-4后脑内IL-4和IL-5的表达水平变化原因以及在介导脑组织损伤中发挥的作用还有待进一步研究。

