反向支付之反垄断规制中的相关市场界定
文/杨锋 朱雪忠
一、引言
相关市场是指在具体案件中,竞争关系或者垄断行为所发生的市场,是反垄断中的一个基础性问题。相关市场的界定是分析市场行为是否构成垄断的基础,在反垄断案件中具有决定性作用。1法律出版社法规中心:《反垄断法注释本》,法律出版社2017年版,第11页。反向支付(reverse payment或pay-for-delay)发生在药品领域,是指拥有药品专利权的原研药企与仿制药企签订和解协议,原研药企向仿制药企支付现金费用或其他形式的价值转移,以换取对方不销售其低价仿制药品的行为。反向支付最早出现在美国,1984年美国出台的《药品价格竞争与专利期补偿法案》(Hatch-Waxman法案)催生了这种现象。虽然欧盟没有类似Hatch-Waxman法案的法律制度,但是由于反向支付给原研药企和仿制药企都带来了巨大的商业利益,双方受巨大的经济利益驱动,均有很强的反向支付意愿,2孙瑜晨:《医药专利反向支付协议的反垄断规制研究——基于美国近十年学术文献的分析》,载《情报杂志》2018年第10期,第112-119+61页。因此反向支付行为在欧盟亦时有发生。
国内针对反向支付问题的现有研究集中于对美国和欧盟司法经验介绍上,尤其关注反向支付和解协议的反垄断审查规则3李胜利,臧阿月:《药品专利反向支付协议的反垄断规制》,载《西南石油大学学报(社会科学版)》2020年第5期,第51-61页。、4孙瑜晨:《专利反向支付协议反垄断规制探论:美国的经验及启示》,载《科技进步与对策》2019年第24期,第128-135页。、5陈兵:《美国药品领域反向支付的反垄断司法经验解读与启示——以反垄断审查规则为线索》,载《上海财经大学学报》2018年第5期,第123-138页。违法性认定标准6焦海洋:《比较视角下药品专利反向支付和解协议违法性的认定研究》,载《科技与法律(中英文)》2021年第5期,第111-120页。、7蔡国柱:《我国应对药品专利反向支付协议的反垄断研究》,载《法制与社会》2020年第33期,第45-46+136页。等问题。国外研究主要聚焦在美国和欧盟的监管框架及两种语境下相关判例的比较研究8Colangelo M. Reverse Payment Patent Settlements in the Pharmaceutical Sector Under EU and US Competition Laws: A Comparative Analysis. World Competition, 2017, 40(3):471-503.、9Maier-Rigaud, Frank, Blalock, Nathan and Oliver Gannon.Reverse payments: an EU and US perspective, in EU Law of Competition and Trade in the Pharmaceutical Sector, eds. Pablo Figueroa and Alejandro Guerrero, Edward Elgar, p.35-108.反向支付除现金支付外的其他呈现形式10Feldman R, Misra P. The Fatal Attraction of Pay-for-Delay. UC Hastings Research Paper No. 313、11Adamson S W. Pharmaceutical Patent Wars, Reverse-Payment Settlements, and Their Anticompetitive Effects for Consumers.Social Science Electronic Publishing, 2017.等问题。国内外研究中针对反向支付反垄断规制中具体的相关市场界定问题讨论有限,要么只在研究中有所提及,并未作为重点主题展开论述;12陶冠东:《反向支付的反垄断法适用》,载《竞争政策研究》2017年第3期,第80-89页。要么讨论制药行业背景下的市场界定,对反向支付司法实践中的市场界定问题的研究仍存在空白。13Siotis G, Ornaghi C, Moura M. Market Definition and Competition Policy Enforcement in the Pharmaceutical Industry.Working Papers ECARES, 2020.反向支付行为是否造成反竞争损害,即被告是否具有足够的市场力量或支配地位,相关市场的界定对于解答这一事实问题十分关键。有鉴于此,通过对美欧反向支付典型判例的研究,深入探讨反垄断司法实践中相关市场界定的争议所在,识别出相关市场界定的关键要素,对中国今后在反向支付反垄断规制中应当秉持的相关市场界定立场的选择具有重要意义。
二、美欧反向支付反垄断规制中相关市场界定的判例分析
反向支付反垄断规制有两种模式:一是公共实施模式,即反垄断执法机构依职权对垄断行为进行调查,或者各地方政府对制药企业发起反垄断诉讼,例如美国各州政府或者美国联邦贸易委员会(Federal Trade Commission,简称FTC)、欧盟委员会(European Commission,简称EC)、英国竞争与市场管理局(Competition and Markets Authority,简称CMA)等反垄断执法机构就制药企业之间的反向支付行为提起诉讼;二是私人实施模式,主要涉及相当比例的美国案例,即药品的直接购买者、间接购买者、其他制药公司等对制药公司之间的反向支付行为提起反垄断诉讼。无论何种实施模式,即不管原告是公共机构还是私人实体,原告对相关市场的界定都负有举证责任,适用“谁主张,谁举证”的基本原则。相关市场的界定规则是在判例法基础上发展起来的,14郑鹏程:《反垄断相关市场界定基本法律问题研究》,中国政法大学出版社2018年版,第6页。因此,有必要对美国和欧盟反向支付反垄断判例进行深入分析,探究美欧司法实践中相关市场界定的思路和方法。
(一)…美欧判例揭示司法实践对相关市场的界定尚未达成共识
在美国,根据《谢尔曼法》第1条,原告必须证明被告已行使或可能已行使其市场力量来减少或消除相关市场的竞争;根据《谢尔曼法》第2条,原告必须证明被告的行为增强了市场力量,提高价格或排除竞争。市场力量的直接证据包括超竞争价格或产量减少等证据,间接证据可以通过定义市场和确定被告在该市场的份额来间接证明。2013年6月17日,美国联邦最高法院对Actavis案作出判决,裁定反向支付和解协议不能豁免于反垄断审查,各级法院适用反垄断法以合理原则进行反垄断分析。15刘立春:《从FTC v. Actavis案看美国“反向支付和解协议的反垄断法律适用”的争议》,载《电子知识产权》2019年第9期,第64-73页。美国联邦最高法院在Actavis案中指出,反向支付的证据本身足以显示市场力量,即反向大额价值转移的证据本身就是品牌药市场力量的证明。然而,尽管法院承认市场力量和可观的反向支付存在关联逻辑,但是在一些情形下,特别是当被告就所讨论的反向支付金额既大又不合理提出异议时,证明市场力量不一定足够。这时法院会遵循传统分析框架,通过两种类型的证据来证明市场力量,即市场力量的“直接证据”或“间接证据”。间接证据包括被告在明确定义的相关市场中占有支配地位的证据。因此,在通过间接证据确定市场支配力之前,必须先界定相关市场。相关市场既包括相关地域市场又包括相关产品市场,但在反向支付案件中,原被告双方对相关地域市场一般没有异议,争论的重点关注相关产品市场。
在欧盟,药品反向支付反垄断规制适用欧盟运行条约(Treaty on the Functioning of the European Union,简称“TFEU”)第101条和第102条。其中,根据该条约第102条,滥用市场支配地位的案件必须界定相关市场。相关市场的定义是一个事实问题,原告有责任提供足够的证据以合理的事实进行相关市场的界定。
表1整理了自2015年以来,美国和欧盟涉及药品反向支付相关市场界定的典型判例。从这些判例来看,美国和欧盟在司法实践中对相关市场的界定尚未达成统一的认识和标准。
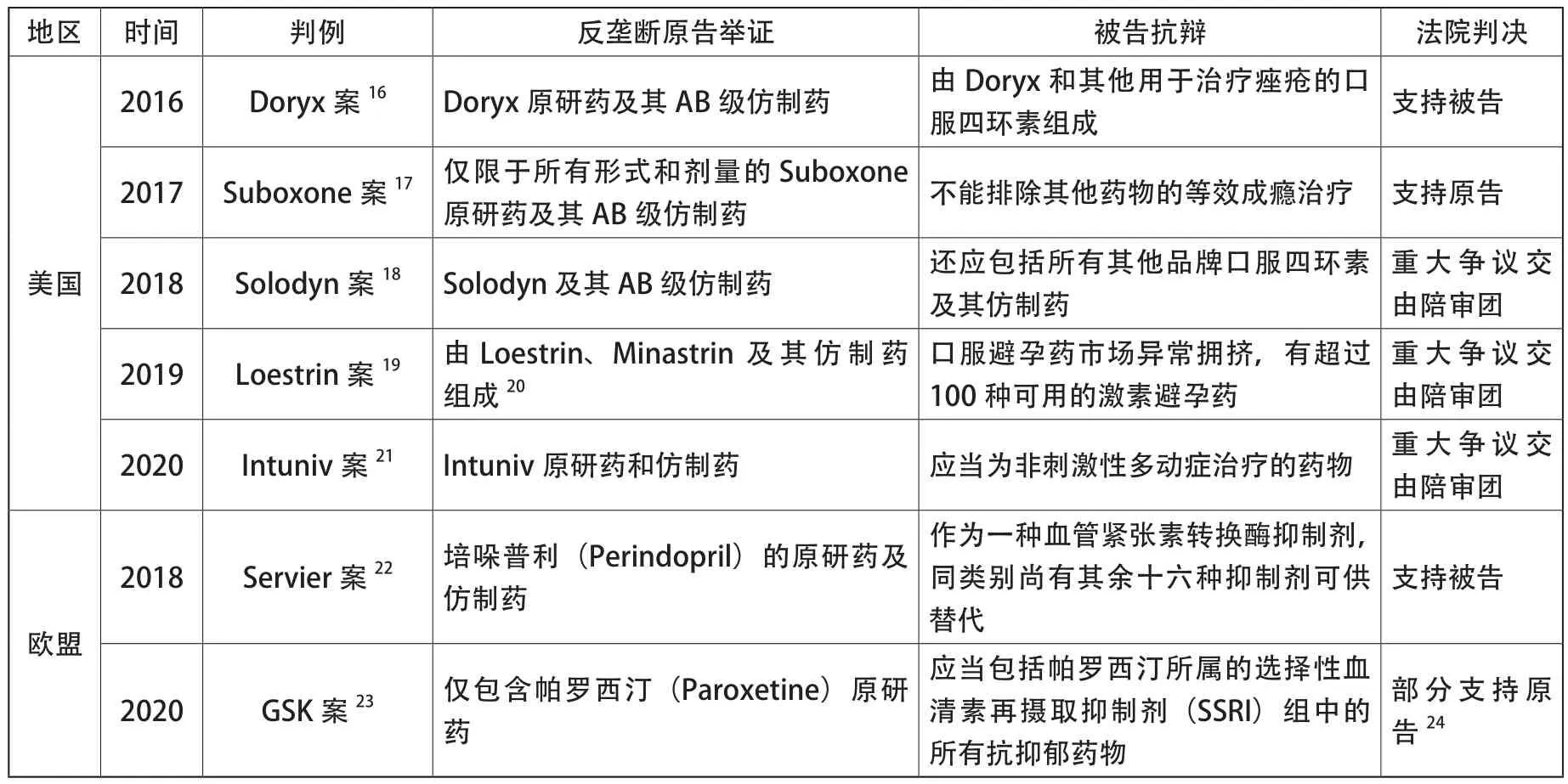
表1 美欧反向支付反垄断判例中相关市场界定一览
从判决结果来看,美国的5起判例可以分为三类,即将相关市场界定为单一药品市场(Suboxone案)或者多种药品市场(Doryx案),以及交由陪审团的未决案件。真正有争议的重大事实问题才能提交陪审团,25In re Namenda Direct Purchaser Antitrust Litig., 331 F. Supp. 3d 152 (S.D.N.Y. 2018).这也从一定程度上说明在美国司法实践中,法院所持立场各不相同,对相关市场的界定尚无定论。
2017年的Suboxone案比较具有典型性,关系到相关市场界定中需求的价格弹性、治疗等效性、给药方式、活性成分等诸多问题,在此对其进一步解读。本案中,原告将相关产品市场界定为“所有剂型和所有剂量的Suboxone原研药及其AB级仿制药”,也就是包括Suboxone薄膜、片剂以及AB级仿制药。原告举证了除Suboxone 片剂、薄膜及其仿制药外的其他产品并没有表现出显著的需求价格交叉弹性。原告进一步举证Suboxone 是唯一开具处方并由患者在家中服用的维持疗法药物。相比之下,美沙酮必须在诊所给药;而另一种上市的阿片类药物Subutex亦不可互换,因为它缺少阻止滥用的阿片拮抗剂纳洛酮。被告抗辩原告所谓的相关市场根据美沙酮的使用方式不当地将其排除在外,而Subutex则因其活性成分的不同而被排除在外。被告认为治疗等效性的问题不在于这些药物在治疗疾病时是否在相同的条件下使用,或是否具有相同的有效成分,而在于这些药物在治疗所开处方的疾病时是否能产生所需的治疗效果。最终,法院认为原告对相关市场的界定满足合理的互换性和需求的交叉弹性要求,予以支持,全面否决并驳回被告的动议。
自2013 年起,欧盟相继发生了三起影响力较大的反向支付案件,分别是欧盟委员会V.丹麦灵北制药(Lundbeck)案、欧盟委员会V.施维雅(Servier)案、以及英国竞争与市场管理局V.葛兰素史克(GSK)案。26GSK案于2018年提起诉讼,2020年3月英国竞争上诉法庭作出判决,该案例在欧盟法院网站(https://curia.europa.eu/jcms/jcms/Jo1_6308/fr/)上检索获取,因此将其归入欧盟案例。2020年1月英国“脱欧”不影响该案例分析。特此说明。其中,如何界定相关市场成为了Servier案和GSK案的重要争议点。
2018年Servier案中,欧盟普通法院认为,欧盟委员会错误地将相关市场仅界定为培哚普利(Perindopril)的原研药及仿制药,界定范围过小而导致相关市场狭窄。作为一种血管紧张素转换酶抑制剂,同类别尚有其余十六种抑制剂原研药可供替代,而欧盟委员会并未考虑这些可行的替代产品。但是,在2020年GSK案中,法院采取了相反的立场。英国竞争上诉法庭(Competition Appeal Tribuna, 简称CAT)支持英国反垄断执法机构竞争与市场管理局(CMA)将相关市场定义为仅包含帕罗西汀(Paroxetine)的原研药,并未考虑所有SSRI药物。
从判例分析可见,美欧对反向支付相关市场界定问题所持立场不一,就相关市场应当在化合物间层面还是化合物内层面进行界定尚未达成共识。
(二)相关市场界定的主要争议在于药品的市场结构
从现有判例来看,美国和欧盟都强调对市场结构的调查。在对反向支付案件的相关市场进行定义时,两者都有较为常规的市场结构,如美国的AB级仿制药和欧盟的ATC分类。

表2 美欧反向支付判例中相关市场定义的常规市场结构
在美国,一种药物如果能够被证明与对应的品牌药具备药代动力学和生物学上的等效性,那么食品和药品管理局(Food and Drug Administration,简称FDA)会将该药物评为AB级,2721 U.S.C.S. § 355(j)(2)(A)(iv).这表明该药物在治疗上与同一类别中相同评级的其他药物等效。一旦获得仿制药AB评级,那么各州法律将为仿制药带来相当大的收益。美国的每个州都有药品替代法,允许或要求药剂师在没有医生处方明确指示(处方必须采取书面形式)的情况下配给治疗等效的、成本较低的仿制药来代替品牌药。美国食品和药品管理局(FDA)在《橙皮书》(Approved Drug Products with Therapeutic Equivalence Evaluations)中公布了已批准的药物和AB级治疗等效物清单。在反向支付具有里程碑标志的Actavis案中,法院虽然没有界定相关市场,但它的决定承认,“在反向支付的情况下,一种品牌药物及其仿制药可以而且通常会构成一个反垄断的相关市场”。28In re Impax Labs., Inc., 2019-1 Trade Cas. (CCH) P80,723 (F.T.C. March 28, 2019).在美国,药品反向支付案件中原告通常将相关市场定义为品牌药及其AB级仿制药,但法院判决却不尽然。如在上述Doryx 案中,法院认为相关市场应当由Doryx和其他用于治疗痤疮的口服四环素组成,而不只是原告举证的Doryx原研药及其AB级仿制药。
在欧盟,涉及药品的案件中,一般将相关市场定义为ATC3级别。29Athanasiadou, Amalia, Servier v. Commission (Case T 691/14): 5 Crucial Points of the Second 'Pay-for-Delay' Decision of the EU General Court (December 18, 2018). Kluwer Competition Law Blog, December 18, 2018.、30苏华,徐新宇:《英国药业反垄断执法经验借鉴(二):辉瑞案的再思考》,载《中国价格监管与反垄断》2017年第1期,第34-37页。ATC(Anatomical Therapeutic Chemical)系统,即解剖学、治疗学及化学分类系统,是世界卫生组织对药品的官方分类系统。ATC系统将药物分为5个级别,ATC1表示解剖学上的分类,ATC2表示治疗学上的分类,ATC3-ATC5分别表示药理学上、化学上以及化合物上的分类。换言之,ATC3 级别包括具有相同治疗适应症的所有药品;ATC4 构成基于治疗和药理学标准(例如分子类别、配方或作用方式)的进一步细分;而 ATC5 级别更窄,仅限于单个活性物质。在Servier案中,欧盟委员会根据 ATC5 级别将相关市场定义为仅限于培哚普利(单个活性物质)的原研药和仿制药。而法院认为,作为一种血管紧张素转换酶抑制剂,ATC3类别中尚有其余十六种抑制剂(治疗等效性)可供替代,原告错误地定义了一个相对狭窄的相关市场。但是在GSK案中,法院认为应当在ATC5 级别定义相关市场。
因此,无论是美国将相关市场界定为原研药及其AB级仿制药,还是欧盟的ATC3级别,都只是一般的常规情形,并不是严格的统一标准,在司法实践中尚存在较大差异。对于一组给定的药物,稍有不同的证据可能指向不同的相关市场。原告举证的相关市场有可能是较为狭窄的市场,也有可能是较为宽泛的市场,这将会导致原告和被告双方在该问题上产生重大争议。表3对上述美欧判例基于是否属于同一活性成分对市场结构进行了分类。通过对美国和欧盟判例的分析,可以发现实践中相关产品市场引起争议最多,而针对地域和时间维度,当事双方基本无分歧。换言之,相关市场界定的主要争议点在于药品的市场结构。

表3 反垄断司法实践中相关市场定义的市场结构类型
(三)美欧对相关市场界定的宽窄倾向可预测性低
美国在市场力认定问题上,法院对相关市场界定的信任程度与市场份额阈值的采信密切相关。一般来说,对相关市场界定比较有信心时,通常会采取较低的市场份额门槛,反之亦然。通常法院要求原告证明被告保持“显著大于55%”的市场份额,以确立反垄断责任。在欧盟,原研药在相关市场中的市场份额低于40%,则不太可能具有市场支配地位,一般需要举证市场份额在40%以上。
如果对同一案件采用不同的相关市场界定,那么显然,相关市场界定得越狭窄,原研药所占的市场份额就越大,其行为对相关市场竞争产生的影响也越大,因而确定其反垄断责任的可能性也就越大。界定狭窄的相关市场,市场份额的门槛可能得到了满足,其缺点在于,有可能定义了不切实际的狭窄市场。
事实上,从现有判例来看,美国和欧盟对于相关市场界定的倾向是相对模糊的,可预测性较低。在不同案例中法院时而选择更狭窄的市场定义,时而选择更宽泛的市场定义。换言之,法院有时选择倾向于保护原研药企,激励其对创新的投资;有时选择倾向于限制原研药企过度地从市场攫取利润,鼓励仿制药尽早参与到市场竞争中。美国和欧盟在相关市场界定时倾向的摇摆,从侧面反映出了在美国和欧盟的药品市场中,原研药和仿制药受益群体力量相对均衡的局面。美国、瑞士、德国、法国等国家是传统的制药强国,其新药研发能力较强。按照权威医学杂志《制药经理人》(Pharmaceutical Executive)的药品销售统计数据,全球制药企业20强中有17家来自美国和欧盟。31Michael Christel:《2021 Pharm Exec Top 50 Companies》,https://www.pharmexec.com/view/2021-pharma-50,最后访问日期:2021年10月18日。这些公司从全球药品销售中获得巨额收入,以支撑其研发支出。因此,美国和欧盟的法院在审理相关案件时,既需要考虑国家医疗成本,也需要权衡原研药企的利益。
三、反向支付反垄断规制中相关市场界定的关键要素
美欧司法实践中各方将关注点聚焦于可替代产品的治疗等效性和需求交叉弹性,这也从一定程度上导致了各方对相关市场界定的分歧。通过美欧判例分析,结合药品产业的特殊性以及中国医疗卫生市场的实际情况,认为应当围绕市场结构的动态变化性、可替代产品的治疗等效性、可替代产品的需求交叉弹性以及医疗保障体系这四个关键要素进行事实分析,从而界定出合理的相关市场。
(一)市场结构的动态变化性
对反向支付行为进行反垄断审查,需要基于相关市场的市场结构,对反向支付所造成的竞争限制进行审查。对一种原研药而言,其竞争主要来自于不同活性成分但治疗相同疾病的其他原研药。但是,其仿制药一旦进入市场,将会把其他原研药排除相关市场之外,而对原研药造成新的威胁,市场结构因此发生变化。也就是说,相关市场与仿制药的进入状态关系密切,具有动态变化性。32Siotis G, Ornaghi C, Moura M. Market Definition and Competition Policy Enforcement in the Pharmaceutical Industry.Working Papers ECARES, 2020.、33Pablo Ibáez Colomo. The Legal Status of Pay-for-Delay Agreements in EU Competition Law: Generics (Paroxetine). SSRN Electronic Journal, 2020.
假设治疗一种疾病,目前市场上有原研药A、原研药B和原研药C。原研药A一直积极地与原研药B和C竞争,原研药B和C的市场行为(比如价格和促销)对原研药A有很大限制。此时,原研药A的相关市场可能由A、B、C三者构成。换言之,在仿制药进入市场之前,相关市场指向一个较为宽泛的、由不同活性成分药品构成的市场。而随着原研药A的仿制药竞争者A1进入市场,原研药A面临的竞争格局可能随之发生改变。因为仿制药A1的进入可能导致原研药A与仿制药A1之间的竞争加剧,以及原研药A与原研药B、C之间的竞争减弱。那么,相关市场便有可能由A与A1构成,也就是指向一个较为狭窄的、由同一活性成分构成的药品市场。仿制药的进入使得相关市场的界限发生改变,相关市场可能由不同活性成分的水平转变为同一活性成分的水平。
GSK案中,英国竞争上诉法庭(CAT)考虑到了这种动态变化性,相关产品市场会随着仿制药威胁的出现而改变。尽管在该威胁出现之前,帕罗西汀可被视为包含在所有SSRI药物更广阔的市场中。但是随着帕罗西汀仿制药进入市场,新的威胁出现了,仅针对同一活性成分的产品市场已经形成。所以,CAT认为有必要知道相关市场是否可能包括帕罗西汀的仿制药,尽管它们在和解协议签订时还没有进入市场,而且是否能在不侵犯GSK公司生产工艺专利权的情况下进入市场也是不确定的。
相关市场随仿制药进入发生动态变化这一关键要素,在逐案分析过程中,应当根据实际情况和所持立场辩证分析。不管是采取基于不同活性成分的宽泛相关市场,还是基于同一活性成分的狭窄相关市场,在原告履行举证责任或者被告进行抗辩时,都应当对动态变化性予以关注。
(二)可替代产品的治疗等效性
相关市场应当包括消费者为相同目的而合理互换的所有产品,相关市场的外部边界由使用的合理互换性所决定。具有治疗等效性的药品具备可替代性,可以进行合理互换。治疗等效性是指一组药品在临床上对同一种疾病具有相同的治疗效果。对于药品以外的其他商品领域,判断某商品是否属于相关市场的关键在于消费者是否认为该商品构成了可替代产品。而在药品领域,处方药的购买决策者并不是最终消费者(患者),而是开具处方的医生,医生对药品的治疗等效性则更为敏感。换言之,当一种药品在治疗方面明显优于其他药品,甚至代表了医疗领域普遍认可的唯一治疗药品时,即使其价格明显高于其他药品,那么医生也可能会选择该药品,而其他低价药品不会产生决定性的影响。
治疗等效性构成了相关市场定义的关键要素,可以从两方面进行考量。一方面,就相关市场定义而言,有必要评估药品或药品类别在治疗上的差异和相似之处。对于相同病症的治疗,开处方的医生做出选择并不取决于药品价格,而是取决于药品在治疗上的差异程度以及对患者的适用性。因此,在不同活性成分水平上定义相关市场是可能的。
另一方面,如果因对某种原研药的忠诚效应使得医生在做出选择时具有高度惯性,这可能导致市场被封锁。只要该药的仿制药不进入市场,该药就可能免受有效竞争压力的影响。因此在同一活性成分水平上定义相关市场是合理的。在这个相关市场中可能只包括原研药,也可能还包括其仿制药。
由于医生可以出于与成本无关的原因在药品之间做出选择,因此药品的使用频率、医生对药品的忠诚度、医生的处方决策影响了药品的市场份额。故定义相关市场时,对可替代产品进行评估的关键要素之一就是治疗等效性。基于案情需要,可以从两个维度进行考量,界定出较为宽泛的或者狭窄的相关市场。
(三)可替代产品的需求交叉弹性
就药品领域的反垄断分析而言,治疗等效性本身不足以建立相关市场。如果同一活性成分的原研药或者仿制药、以及不同活性成分的原研药和仿制药之间具有治疗等效性,医生在它们之间可以自由选择,那么价格竞争则是一个重要约束,基于价格的限制也可能存在。
判例研究发现,在药品反向支付问题上,与界定相关市场有关的要素中,当事方要分析可替代产品的治疗等效性和价格因素的各自地位,二者不可偏废。即使药品具有治疗等效性,仅凭这一点也不足以将其纳入相关市场。美欧判例清楚地表明,药品行业独特的监管和竞争机制并没有否定价格因素在竞争约束评估中的重要性。药品产业的整体经济背景,尤其药品的价格,仍然是一个不可忽视的关键要素。
即使一种药品具备治疗等效性,相关市场定义的间接证据也需要证明可替代产品的经济互换性。也就是说,评估药品是否可以被纳入相关市场,还必须考量药品的需求交叉弹性。当一种药品是经济上最为接近的替代品时,原研药价格的微小变化就会引起市场反应,使得消费者向该药品转移,这意味着其需求交叉弹性很高,属于相关市场。
需求交叉弹性是从购买者的角度衡量药品可替代性的指标。从技术上讲,它衡量药品X的需求对药品Y价格变化的反应程度。Doryx案中,被告提供了无可争议的证据表明,被告通过促销活动以提高Doryx与其他四环素类药物的竞争能力。另外,当被告提高Doryx的价格时,其销售额下降,而其他口服四环素的销售额增加。34Mylan Pharms. Inc. v. Warner Chilcott Pub. Ltd. Co., 838 F.3d 421, 2016 U.S. App.显然Doryx与其他用于治疗痤疮的口服四环素类药物之间存在需求交叉弹性,Doryx的价格变化对患者需求有影响。据此可以证明原告举证的相关市场仅由Doryx品牌药及其仿制药组成是不成立的。最终,地方法院和第三巡回法院判定本案的相关市场应当包括Doryx和其他用于治疗痤疮的口服四环素类药物。Intuniv案中,法院认为,在Intuniv品牌药仅与其仿制药具有需求交叉弹性的问题上,存在重大事实争议。与Doryx案类似,被告的证据表明其通过促销活动回应市场对其价格的反应,以提高与非刺激性多动症ADHD治疗药物的竞争能力,这削弱了原告的论点。因此法院拒绝了原告关于在仅包含Intuniv品牌药和仿制药的相关市场中拥有市场支配力的简易判决动议。由于本案中市场支配力的直接证据和间接证据存在重大事实的合理争议,故交由陪审团解决。35In re Intuniv Antitrust Litig., 496 F. Supp. 3d 639, 2020 U.S. Dist.
因此,在对反向支付进行反垄断审查时,相关市场界定不仅需要考量药品在功能上是否具有治疗等效性,还要考量药品在价格上是否存在需求交叉弹性。两者共同构成了可替代产品的考量因素。
(四)医疗保障体系
药品行业有其特殊的监管框架,美国Hatch-Waxman法案和州仿制药替代法案的基本目的都是降低用药成本以减少医疗基金的支出。社会医疗保障体系对药品的报销安排也是相关市场分析中的一个重要因素。
Doryx案中,医疗保险公司和部分医疗服务机构鼓励患者使用其他口服四环素广泛替代原研药Doryx来治疗痤疮,甚至一些组织已取消将原研药Doryx作为可报销药物或者限制其报销。而另有部分医疗服务机构试图限制患者使用其他四环素替代原研药Doryx,卫生健康管理部门向这些医疗服务机构发出通知,敦促其使用其他口服四环素替代Doryx。显然,卫生健康管理部门承认,其他四环素类药物完全可以替代Doryx。因此,在该案中,原告Mylan公司无法否认原研药Doryx和其他用于治疗痤疮的口服四环素之间存在高度的合理互换性这一事实。
对于进入社会医疗保障系统的药品而言,药品之间的价格差异可能并不是很重要,因为报销水平降低了患者的经济负担。其结果是,如果一家制药公司的药品不再受到医疗保障体系及其从业者的认可,那么该公司在市场竞争中几乎没有成功的机会。与此同时,一种被公认为优质的医保药品,即使其价格更高,但是仍然可以对具有治疗等效性的其他未入医保的药品施加巨大的竞争压力。
四、结语
2022年1月21日,最高人民法院公布了阿斯利康有限公司与江苏奥赛康药业有限公司侵害发明专利权纠纷的二审裁定书。36参见最高人民法院(2021)最高法知民终388号民事判决书。最高院认为“该协议基本符合所谓的‘药品专利反向支付协议’的外观”,这是中国首个关于反向支付的案例。虽然该案考虑到“涉案专利保护期已经届满”,以及“缺乏涉案无效宣告请求审查程序中的相关证据”,最高院不再对反垄断做进一步的审查和处理。但是,可以预见,随着中国药品专利纠纷早期解决机制的落地,以及中国制药企业研发创新能力的提升,反向支付行为在今后或将陆续出现。
对反向支付适用反垄断法进行规制,需要对相关市场做出合理的定义。目前中国制药产业整体实力与美欧国家还有较大距离,药品生产以仿制药为主。考虑到庞大的医疗需求、药品的可支付性和药品的可及性,建议中国在现阶段采用狭窄的相关市场界定,对垄断行为实施严格规制。其中,市场结构的动态变化性、可替代产品的治疗等效性、可替代产品的需求交叉弹性以及医疗保障体系,应当成为相关市场定义重点考量的四大关键要素。

