基于COSMO-SAC模型研究离子液体对氨水溶液汽液平衡的影响
李明宴,李进龙,彭昌军,刘洪来
(1 华东理工大学化学与分子工程学院,上海 200237; 2 常州大学石油化工学院,江苏 常州 213164)
引 言
氨水常用作制冷、制热中的工质。如能调控氨水溶液的汽液平衡,则传统的氨水热力循环系统的性能便可进一步得到提升,并降低能量的消耗[1-5]。一般可利用无机盐[6-12]、碱[13-14]等无机物来调控氨水系统的汽液平衡,但缺点是系统在运行时存在结晶和腐蚀等问题[15]。因此,寻找合适的添加剂以调节氨水溶液的汽液平衡至关重要。
近些年来,人们已开始将离子液体(ILs)引入到含氨水系统中,一是将离子液体作为溶剂捕集有毒气体氨[16-27]。二是以离子液体为吸收剂,氨为制冷剂组成工质对应用于吸收式制冷/热泵循环系统[28-34],但高黏度、高密度的工质对会极大影响热经济学性能。一种替代方案是以离子液体和水作为吸收剂,此时,ILs-NH3-H2O 三元系统的汽液相平衡性质将直接影响氨的分离。目前,人们已开始ILs-NH3-H2O 三元溶液的汽液平衡的研究[7,15,35-37],但研究的离子液体极为有限。本文将利用COSMO-SAC模型研究不同离子液体存在下氨水溶液的汽液相平衡,探讨离子液体的亲水性、酸碱性、阴阳离子种类以及功能基团修饰等因素对氨的相对挥发度的影响。
1 计算详情
COSMO 模型是一种先验性模型,仅通过分子结构优化获得的表面链节电荷密度即可完成相平衡等性质预测,并提供分子水平的机理信息[38-39]。本文借助Material Studio(V7.0)中的DMol3 模块、使用GGA/VWN-BP密度泛函形式和DNP+基组对分子结构进行优化,得到COSMO 文件和分子相互作用能,重点是获得相关物质表面电荷密度分布图(即σprofile),然后利用COSMO-SAC 模型预测热力学性质。相互作用能采用式(1)计算
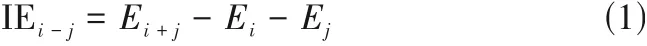
式中,IE 为相互作用能,kJ·mol-1;E为孤立体系的能量,kJ·mol-1。
对于NH3(1)-H2O(2)-ILs(3)三元系统,假设汽相可视为理想气体混合物,汽液平衡时,有

本文以氨的相对挥发度α12作为指标定量考察离子液体对氨水系统汽液相平衡的影响。如添加离子液体后的α12大于未添加离子液体的α12,表示添加的离子液体有利于氨水的分离。相对挥发度定义为:

式中,x1'、x2'分别为液相中无离子液体基并归一化后氨和水的摩尔分数;y1、y2分别为氨和水在汽相中的摩尔分数。
2 结果与讨论
考虑到工厂实际,本文选择x1'为0~0.55 的氨水系统,预测中离子液体添加量统一规定为摩尔分数x3=0.10,系统温度为308.75 K和353.15 K。
2.1 氨水汽液平衡预测
为了验证COSMO-SAC 模型预测氨水溶液汽液平衡的可靠性,根据式(2)相平衡原理,预测了不同压力条件下的氨水等压汽液平衡,结果如图1所示,其中点为实验值[40],线为预测值,预测的压力和温度范围分别为2~8 atm(1 atm=101325 Pa)和313~444 K。图1(a)为T-x(y)相图预测和实验结果比较,可见在所研究的浓度、温度及压力范围内COSMOSAC 与实验结果一致;图1(b)比较了氨-水相对挥发度,在低浓度下理论模型给出了较好的预测效果,随着水溶液中氨浓度的增加,预测偏差逐渐增大,但总体上理论模型预测的变化趋势与实验观察吻合。因此,可借助COSMO-SAC 获得的相对挥发度变化评估离子液体促进氨水分离的效果。

图1 氨水溶液汽液平衡预测(线)与实验(点)结果比较Fig.1 Comparison between predicted(lines)and experimental(symbols)VLE for ammonia aqueous solution
2.2 阴离子性质对氨水汽液平衡的影响
2.2.1 阴离子亲水性的影响 在氨水系统中分别添加以不同亲水性阴离子和[C2mim]+为阳离子组成的离子液体,系统的p-x(y)预测结果见图2(a)。其中,选择的阴离子的亲水性顺序为[Ac]->[Cl]->[NO3]->[BF4]->[NTf2]->[PF6]-[41]。研究发现,在308.75 K 和353.15 K两个温度下,阴离子不同,对相平衡的影响也不同。在温度与液相组成不变的情况下,添加离子液体后会导致平衡时系统总压发生变化,升高的顺序是[Cl]->[Ac]-≈[NO3]->[BF4]->[PF6]->[NTf2]-。与无离子液体系统相比,添加[C2mim][Cl]后,系统的总压将升高,汽-液两相共存的区域将扩大。添加[C2mim][Ac]和[C2mim][NO3],在x'1≤0.40 下,系统总压均升高,相区会扩宽。这说明,添加[Cl]-、[Ac]-和[NO3]-型离子液体有利于氨水系统的分离。但添加[BF4]-、[PF6]-和[NTf2]-型离子液体,系统压力一般会降低且两相共存区会缩小,这对分离是不利的。

图2 阴离子亲水性的影响(实线:308.75 K;虚线:353.15 K)Fig.2 The effect of anionic hydrophilicity(solid line:308.75 K;dotted line:353.15 K)
图2(b)示意了α12~x'1的关系。两个温度下,阴离子为[Cl]-、[Ac]-和[NO3]-的离子液体中,氨的α12均高于无离子液体时的α12,说明此离子液体有利于氨水的分离。阴离子为[PF6]-和[NTf2]-时,α12要比无离子液体时的低,即此离子液体的存在不利于氨水分离。[BF4]-的离子液体较特殊,当x'1较低时,α12要高于无离子液体时的α12。浓度较高时,α12要比无离子液体的低。无论是低温还是高温,α12排序均为[Cl]->[Ac]->[NO3]->[BF4]->[PF6]->[NTf2]-,这与系统总压的升高顺序是一致的,且308.75 K 下的α12均高于353.15 K下的α12。
图2(c)示意了相关物质的σ-profile,它体现了分子表面的极化作用,也决定着分子间作用能的大小[42]。图中两条垂直虚线(σ=-0.0082 e·Å-2,σ=0.0082 e·Å-2,1 Å=0.1 nm)为氢键分隔线。如物质的σ-profile 曲线落在σ<-0.0082 e·Å-2区域,则表示该物质具有较强的氢键提供能力,可作为氢键供体。如落在σ>0.0082 e·Å-2表示该物质具有较强的氢键接受能力,可作为氢键受体。峰位置离氢键分隔线距离越远,阈值越宽,表示形成氢键的能力越强。由图可知,NH3和H2O 两种分子在供体和受体区域均存在峰,它们间既能各自形成氢键,也能相互形成氢键。相对而言,NH3在氢键受体区域具有更远位置的峰,H2O 在氢键供体区域具有更远位置的峰,[C2mim]+在氢键供体区域具有更远位置的峰,而阴离子峰位置则集中于氢键受体区域。因此,H2O 更容易与带负电的阴离子形成氢键,NH3更容易与带正电的阳离子形成氢键,不同研究者也得出类似结论[43-47]。另外,阴离子按峰远离分割线位置的排序为[Ac]->[Cl]->[NO3]->[BF4]->[NTf2]->[PF6]-,这一顺序与阴离子亲水性的顺序一致[41],即阴离子与水形成氢键的能力会越来越弱。按理离子液体越容易与水形成氢键,则氨越容易从混合物中分离出来。实际上氨的相对挥发度并不按此排序,而是[Cl]->[Ac]->[NO3]->[BF4]->[PF6]->[NTf2]-。
表1 给出了不同物质间相互作用能的计算结果,其中氨与水的相互作用能为-36.23 kJ·mol-1。显然,阴离子的亲水性与阴离子与水的相互作用大小的顺序是一致的。对于[Cl]-、[Ac]-和[NO3]-,它们与水的相互作用要高于与氨的相互作用,即阴离子更容易与水结合,导致氨分子更易逸出。但相对挥发度的大小不仅要考虑阴离子与水的相互作用,还要综合考虑阴离子与氨分子的相互作用以及氨与水的相互作用。水与[Ac]-的相互作用能(-58.40 kJ·mol-1)大于水与[Cl]-的相互作用能(-29.14 kJ·mol-1),这说明[Ac]-有利于氨的逸出。但氨与[Ac]-的相互作用能(-40.81 kJ·mol-1)也远大于氨与[Cl]-的相互作用能(-19.61 kJ·mol-1),而且也高于氨和水之间的作用能,说明[Ac]-并不利于氨的逸出。因此,综合考虑[Cl]-更有利于氨水的分离,导致相对挥发度出现[Cl]->[Ac]->[NO3]-的情况。
实际上,对于疏水性的离子液体,一般水与阴离子可形成弱氢键,但咪唑阳离子会与氨分子形成较强氢键。计算发现,对于[BF4]-、[PF6]-和[NTf2]-的离子液体,它们与氨的相互作用能要高于其与水的相互作用能(表1),因而添加离子液体后的α12一般要比无离子液体时的低,即加入[BF4]-、[PF6]-和[NTf2]-型的离子液体不利于氨水分离。
当系统温度升高时,氢键会被破坏,系统靠氢键筛分的作用会减弱。因此,高温下相对挥发度会比低温时低。当加入可促进氨水分离的离子液体后,相对挥发度均会提高,但低温下相对挥发度的提高幅度要高于高温下的提高幅度。这便是图2(b)所示意的结果。
2.2.2 阴离子β值的影响 研究发现,离子液体的亲水性由氢键供体能力、氢键受体能力、极性以及偶极极化率等因素决定[48]。其中,离子液体中阴离子形成氢键的能力也可用标度氢键受体能力的β值来定量,β值越大表示其形成氢键的能力越强[48]。以[C2mim]+为阳离子,研究了几种不同β值的氨基酸阴离子型离子液体对氨水汽液平衡的影响,它们的β值大小顺序为[Gly]->[Pro]->[Ala]->[Glu]->[Lys]-[48],相关结果见图3。由图3(a)可知,在308.75 K 和353.15 K 下,添加氨基酸离子液体后,氨的α12均高于无离子液体时的α12,且低温下的α12均高于高温下的α12,说明离子液体有利于氨水的分离,低温下更有利于氨水的分离。离子液体提升α12的顺序为[Gly]->[Ala]->[Lys]->[Pro]->[Glu]-,说明[C2mim][Gly]最有利于促进氨水分离。
图3(b)示意了阴离子的σ-profile,发现阴离子均在氢键受体区域出现峰,峰尖的位置基本相同,显示这些阴离子均倾向于优先与水形成氢键。由表1 可知,离子液体与水的相互作用能要高于离子液体与氨的相互作用能,因此,添加离子液体有利于氨水的分离。水与离子液体作用能的顺序为[Glu]->[Gly]-≈[Ala]->[Pro]->[Lys]-,氨与离子液体作用能顺序为[Glu]->[Ala]->[Pro]-≈[Gly]->[Lys]-。两者间作用能差值的顺序是[Gly]->[Glu]-≈[Ala]->[Pro]->[Lys]-,差值越大,越有利于氨水分离。
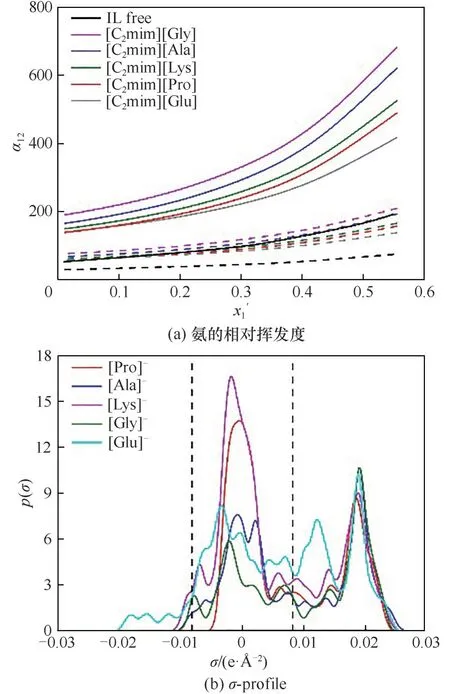
图3 阴离子β值的影响(实线:308.75 K;虚线:353.15 K)Fig.3 The effect of anionic β(solid line:308.75 K;dotted line:353.15 K)
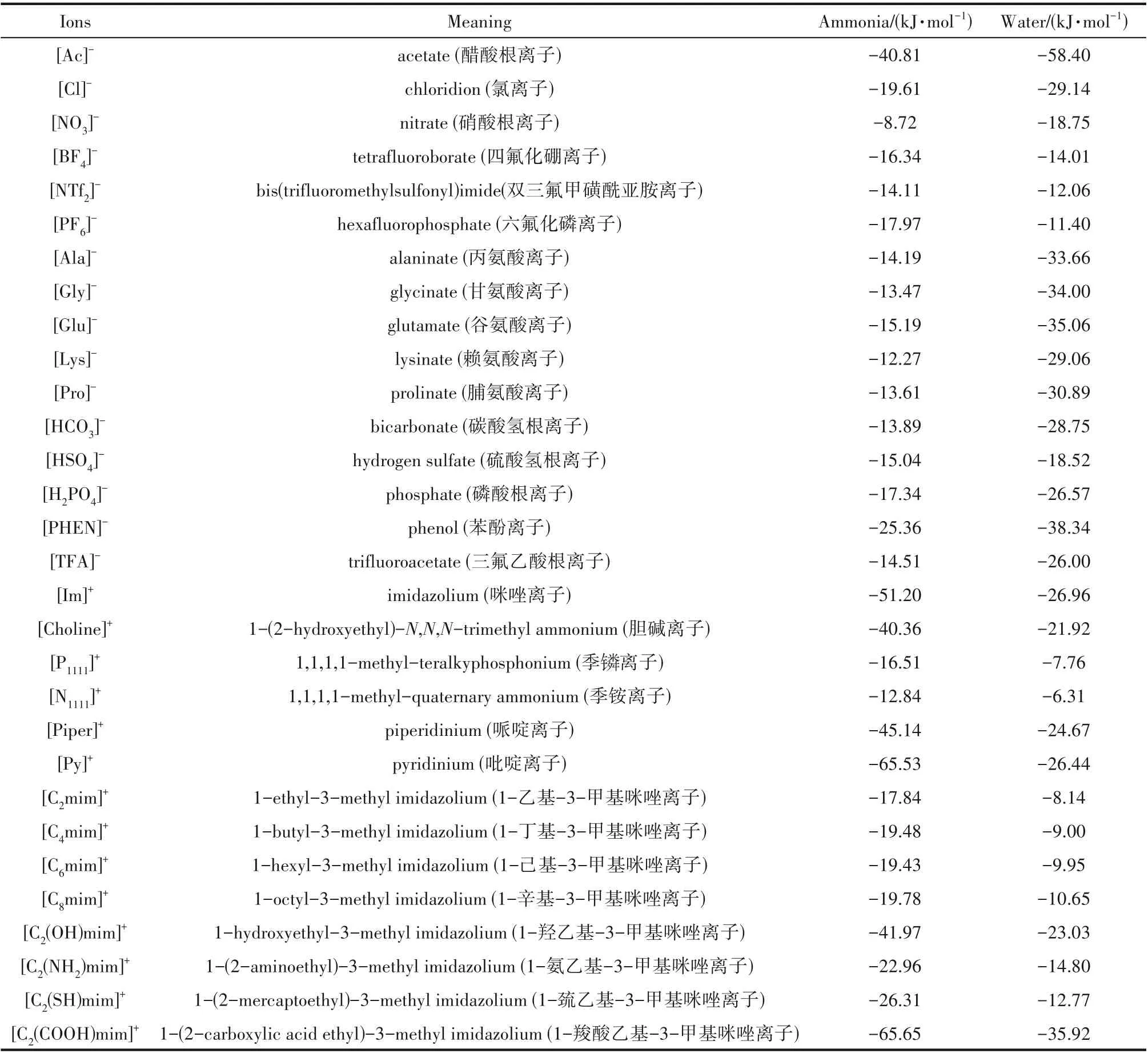
表1 不同离子与氨和水之间的相互作用能Table 1 Interaction energies of ammonia-ILs and water-ILs
2.2.3 阴离子酸碱性的影响 [C2mim]+与不同酸碱性阴离子组成的离子液体对氨水汽液平衡的影响见图4。其中,离子液体碱性顺序为[PHEN]->[HCO3]->[H2PO4]->[TFA]->[HSO4]-,这与离子液体与水相互作用能的顺序(表1)是一致的。图4(b)示意了阴离子的σ-profile,发现阴离子均在氢键受体区域出现峰,显示这些阴离子均倾向于优先与水形成氢键,且水与离子液体的相互作用能高于氨与离子液体的相互作用能(表1),最终导致氨易于从混合物中逸出。图4(a)直观示意了这一结果,即在不同温度下,添加不同酸碱性离子液体,氨的α12均高于无离子液体时的α12,且低温下的α12要高于高温下的α12。说明离子液体可促进氨水分离,低温状态下更有利于氨水分离。但离子液体提升α12的顺序与其酸碱性的顺序并无对应关系,总体而言,[HCO3]-和[H2PO4]-型离子液体更有利于氨水分离。
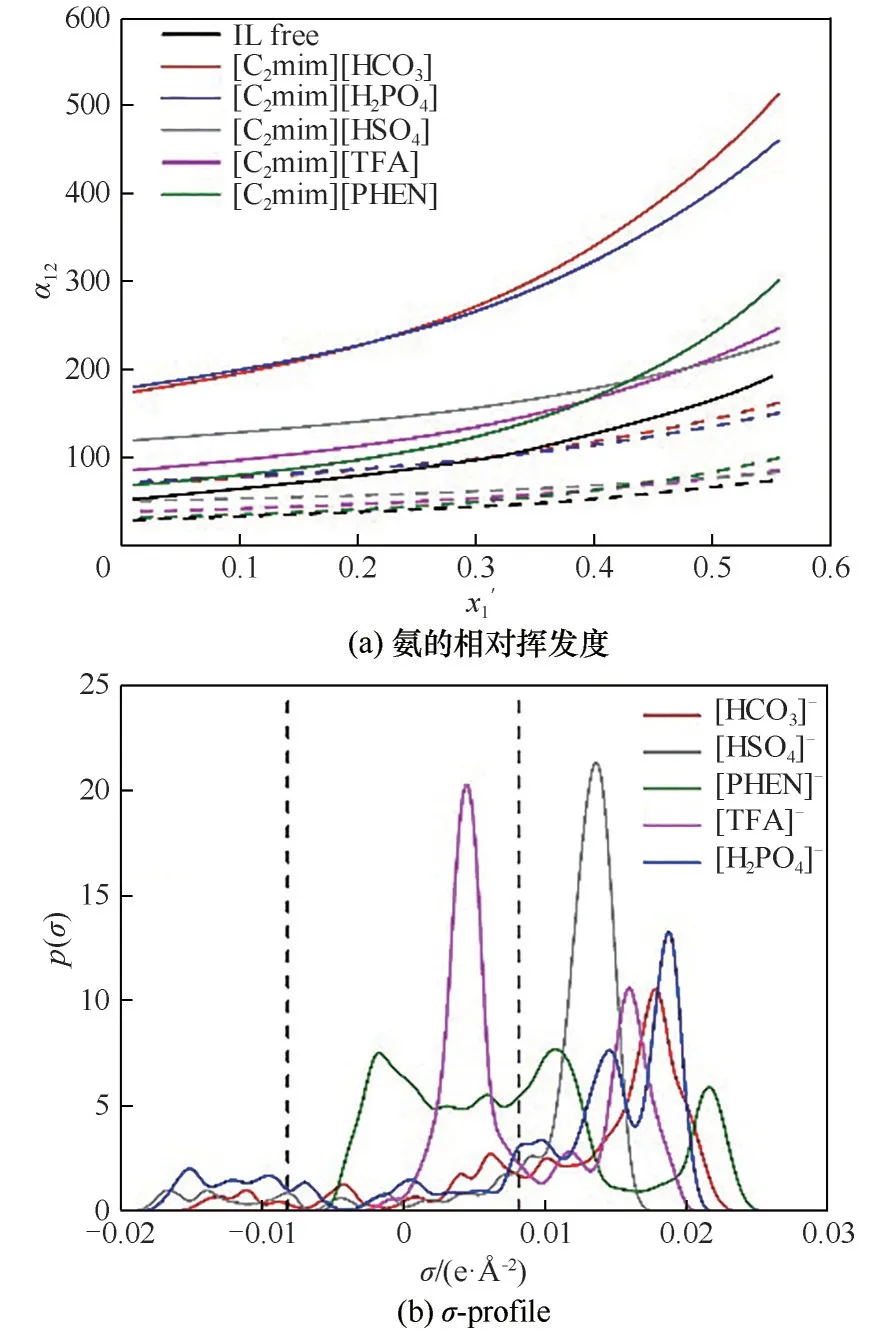
图4 阴离子酸碱性的影响(实线:308.75 K;虚线:353.15 K)Fig.4 The effect of anion acidity and alkalinity(solid line:308.75 K;dotted line:353.15 K)
综上,当不同性质的阴离子与[C2mim]+组合成的离子液体添加到氨水系统后,均会影响汽液相平衡。阴离子[Cl]-、[Gly]-和[Ac]-型的离子液体更能促进氨水分离。308.75 K 下,添加[Cl]-型离子液体的α12为无离子液体系统α12的3.5~4.8 倍,353.15 K 下的α12为无离子液体系统α12的3.2~3.4 倍。[NTf2]-和[PF6]-会导致氨的相对挥发度下降而不利于氨水分离。[BF4]-型离子液体较特殊,308.75 K 下,当x'1高于0.35 时,α12要比无离子液体时的低,为无离子液体系统α12的0.8~1.0 倍。低于这一浓度,α12为无离子液体系统α12的1.0~1.5 倍。353.15 K 下,x'1高于0.25 时的α12为无离子液体系统α12的0.8~1.0 倍。低于这一浓度,α12为无离子液体系统α12的1.0~1.2倍。
2.3 阳离子性质对氨水汽液平衡的影响
2.3.1 阳离子种类的影响 [BF4]-和不同阳离子构成的离子液体对氨水溶液的汽液平衡影响见图5。图5(a)示意了α12~x'1的关系。计算发现,在低氨浓度区,离子液体对α12影响的排序为[N1111]+>[Choline]+>[P1111]+>[Py]+>[Piper]+>[Im]+,且α12均高于无离子液体系统的α12,说明添加离子液体有利于氨水分离。随着氨浓度逐渐升高,α12排序变为[Im]+>[Piper]+>[Py]+>[N1111]+>[P1111]+>[Choline]+,此时温度、组成以及离子液体种类均对相对挥发度产生影响。随着浓度的增加,[N1111]+、[P1111]+和[Choline]+的α12均低于无离子液体的α12。说明这三种离子液体仅有利于促进低浓度氨水的分离,而不利于高浓度氨水的分离。
图5(b)示意了相关物质的σ-profile。在氢键供体区域,按峰远离分割线的位置和峰强度排序为[Py]+>[Im]+≈[Piper]+>[Choline]+>[P1111]+>[N1111]+,它们均能优先与氨分子形成氢键。只有[Choline]+在受体区域具有峰值,它将优先与水分子形成氢键。
由表1 可知,氨与阳离子的相互作用能以及水与阳离子的相互作用能大小顺序为[Py]+≈[Im]+>[Piper]+>[Choline]+>[P1111]+≈[N1111]+,这与阳离子氢键供体峰的顺序一致。另外,阳离子与氨的相互作用能均大于阳离子与水的相互作用。如仅从作用能的角度考虑,添加离子液体将会降低氨的相对挥发度,但从图5(a)可知,这一现象仅在氨浓度较高时才体现。氨浓度较低时,这些阳离子型的离子液体仍能促进氨水分离。总地来说,低氨浓度下,[N1111]+有利于氨水的分离。高氨浓度下,[Im]+有利于氨水的分离。[Choline]+较为特殊,在氨浓度较低时能促进氨的分离,高氨浓度下能促进氨的吸收。

图5 不同种类的阳离子的影响(实线:308.75 K;虚线:353.15 K)Fig.5 The effect of different kinds of cations(solid line:308.75 K;dotted line:353.15 K)
2.3.2 阳离子链长的影响 [BF4]-和不同链长阳离子([Cnmim]+,n=2、4、6、8)组成的离子液体对氨水汽液平衡的影响见图6。图6(a)表明,随着阳离子烷基链的长度增加,系统中氨的相对挥发度将逐渐减小。与无离子液体系统相比,链越长,加入离子液体后的α12会越来越低于无离子液体系统的α12。说明较长侧链的阳离子不利于氨水分离,反而有利于氨的吸收,这与烷基链越长,离子液体越有利于捕集氨的结论一致[49]。
图6(b)示意了阳离子的σ-profile。发现阳离子在氢键供体区均存在峰,出峰位置和强度并无多大区别,说明氨均可与阳离子形成氢键,但氢键强度并无显著差异。阳离子的非氢键区域的峰面积会随链长的增加而增加,系统中水和氨与阳离子间的范德华力会越来越强。由相互作用能来看,随着链长的增加,阳离子与氨、阳离子与水的相互作用能均会有些许增加,且阳离子与氨的相互作用能均大于阳离子与水的相互作用能(表1)。此时,阳离子与氨的相互作用能对氨的分离效果将起决定作用,作用能越强,氨的相对挥发度越低,以至于系统越有利于氨的吸收。

图6 烷基链长的影响(实线:308.75 K;虚线:353.15 K)Fig.6 The effect of alkyl chain length(solid line:308.75 K;dotted line:353.15 K)
2.3.3 功能基团修饰的影响 [BF4]-和不同功能基团修饰[C2mim]+后组成的离子液体对氨水汽液平衡的影响见图7,为比较,图中也列出了[C2mim][BF4]的结果。图7(a)表明,308.75 K 和353.15 K 下,具有不同功能基团的阳离子型的离子液体影响α12的顺序一般为[C2(NH2)mim]+>[C2(OH)mim]+>[C2(SH)mim]+>[C2(COOH)mim]+,只是在较高的氨浓度区,[C2(SH)mim]+与[C2(COOH)mim]+顺序会发生颠倒。
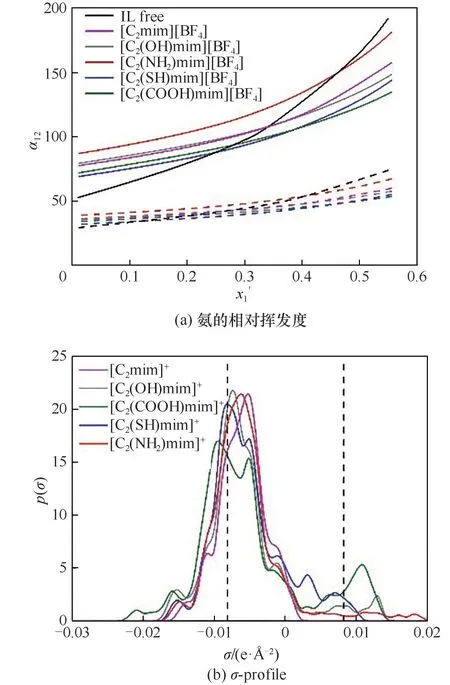
图7 不同基团的影响(实线:308.75 K;虚线:353.15 K)Fig.7 The effect of different groups(solid line:308.75 K;dotted line:353.15 K)
图7(b)的阳离子σ-profile 说明,阳离子在氢键供体和受体区域均会出现峰。在供体区域,峰强度顺序为[C2(COOH)mim]+>[C2(OH)mim]+>[C2(SH)mim]+>[C2(NH2)mim]+,这一顺序与阳离子与氨的相互作用能的大小顺序是一致的(表1)。在受体区域,峰强度顺序为[C2(COOH)mim]+>[C2(OH)mim]+>[C2(NH2)mim]+>[C2(SH)mim]+,这与阳离子和水的结合能排序是一致的(表1)。理论上,阳离子与氨的作用越强,越不利于氨的逸出。阳离子与水的作用越强,越有利于氨的逸出。实际计算发现,对于功能化的阳离子,对氨的相对挥发度的影响主要由阳离子与氨、阳离子与水相互作用能的差值来决定。作用能间的差值由大到小的顺序为[C2(COOH)mim]+>[C2(OH)mim]+>[C2(SH)mim]+>[C2(NH2)mim]+,差值越大,越不利于氨的逸出。因此,仅从相互作用能的角度考虑,影响氨的相对挥发度顺序应该是[C2(NH2)mim]+>[C2(OH)mim]+>[C2(SH)mim]+>[C2(COOH)mim]+,这与图7(a)所示意的结果基本一致。另外,氨与阳离子相互作用能要高于水与阳离子的相互作用能,如仅从作用能的角度考虑,添加离子液体将会降低氨的相对挥发度。但从图7(a)可知,这一现象仅在氨浓度较高时才体现。氨浓度较低时,这些阳离子型的离子液体仍能促进氨水分离。
很明显,在[C2mim]+上嫁接功能基团后会导致分离效果发生变化。图7(a)的结果显示,—NH2基团的引入能使氨的α12由1.4421~0.8032 提高到1.6457~0.9235,即在[C2mim]+引入—NH2基团能进一步促进低浓度下氨水的分离。引入—OH 基团后的α12为1.5012~0.7565,说明这一基团的引入并未明显改善低浓度下氨水的分离效果。引入—SH 和—COOH后会导致α12进一步降低。
3 结 论
(1)不同性质的离子液体均会影响氨水系统的汽液相平衡。有些能促进氨水分离,有些只在一定浓度范围内促进分离,有些对分离不利,主要取决于离子液体的性质及其与氨和水的相互作用。电荷密度分布表明,如果离子液体存在氢键供体和受体,水分子会优先与阴离子形成氢键,氨分子会优先与阳离子形成氢键。
(2)一般地,如果水与离子液体相互作用能高于氨与水的相互作用能,离子液体的添加将有利于氨的逸出。当阴离子亲水性和形成氢键的能力越强;或者水与阴离子相互作用能越强,氨与阳离子相互作用越弱,则离子液体越能促进氨水的分离。水/离子液体之间的相互作用能与氨/水之间的相互作用能差值越大,离子液体越能提高氨的相对挥发度,但提高幅度还要兼顾氨与离子液体的相互作用。
(3)当水与离子液体相互作用能低于氨与水的相互作用能时,离子液体也能促进低浓度下的氨水分离,但高浓度下将有利于氨的吸收。
(4)温度升高时,氢键会被破坏,高温下氨的相对挥发度会比低温时的低。当加入可促进氨水分离的离子液体后,相对挥发度均会提高,但低温下相对挥发度的提高幅度要高于高温下的提高幅度。
(5)阴离子要比阳离子更能影响氨的相对挥发度。阴离子[Cl]-和[Ac]-型的离子液体更能促进氨水分离。对于[Cnmim]+(n=2、4、6、8)型阳离子,烷基链越长,越不利于氨的分离。但在[C2mim]+上嫁接—NH2基团将会改善低浓度下氨水的分离效果。
符 号 说 明
E——孤立体系能量,kJ·mol-1
IE——相互作用能,kJ·mol-1
p——蒸气压,kPa
p(σ)——表面电荷密度分布
xi——液相中组分i的摩尔分数
x'1——无离子液体基归一条件下液相中组分i的摩尔分数
yi——汽相中组分i的摩尔分数
αij——组分i,j的相对挥发度
γi——组分i的活度系数
σ——表面电荷密度,e·Å-2
——以高中化学“氢键”的教学为例

