昆虫双杂交实验中家蚕BmHSP83和BmMAD3蛋白引起的假性现象
方 康,彭海涛,胡琼波
(华南农业大学植物保护学院,广州 510642)
昆虫双杂交(Insect two-hybrid, I2H)技术是一种测定昆虫细胞蛋白质相互作用的方法(Monetal., 2009),该系统由pIE2-AD、pIE2-DBD和pUAS-Luc三个载体构成,pIE2-DBD载体含有酵母GAL4-DNA结合域(DNA binding domain, DBD),而pIE2-AD载体含有小鼠核转录因子NF-κB的转录激活域(activating domain, AD),DBD和AD结构域相互靠近时,激活pUAS-Luc荧光素酶报告基因的表达(图1)。将两个待测蛋白(X和Y)分别构建成pIE2-DBD-X和pIE2-AD-Y两个载体,与pUAS-Luc一起共转染昆虫细胞,如果两个蛋白相互作用,则触发下游报告基因的表达。昆虫双杂交依靠荧光素酶检测系统来反映昆虫细胞内蛋白质的相互作用特性,因而在研究昆虫蛋白质相互作用方面具有独特的优势。
昆虫双杂交(I2H)是在酵母双杂交(Y2H)技术基础上发展起来的一种蛋白质互作分析技术,使那些无法用Y2H分析的蛋白,尤其是那些受到翻译后修饰(如糖基化、磷酸化和乙酰化)的蛋白,可以用I2H进行互作检测(Stynenetal., 2012);I2H还可用于分析Y2H系统中自激活蛋白(Monetal., 2009; Stynenetal., 2012)。
假性是生物学实验中常见的现象,然而,I2H实验中的假性现象则少有报导。本文作者在家蚕蛋白I2H实验中发现了BmHSP83和BmMAD3蛋白导致的假性现象。HSP83(Heat shock protein 83,热休克蛋白83)也被称为HSP90,它是一种伴侣蛋白,帮助其它蛋白质正常折叠,稳定蛋白质抵抗热应激,并帮助蛋白质降解(Biebl and Buchner, 2019)。尽管对HSP83的研究已有几十年的历史,但家蚕BmHSP83的报道却很少。为了进一步了解BmHSP83的功能,本研究根据蛋白数据库(https://string-db.org/)的预测结果,研究了BmHSP83与蛋白二硫键异构酶A5(BmPDIA5,XP_004933309.1,得分>0.8)的相互作用。MAD3是Smads家族蛋白,在将TGF-β信号从细胞表面受体传导至细胞核的过程中作为转录因子启动某些基因表达(Verrecchia and Mauviel, 2002)。为了研究家蚕BmMAD3蛋白的功能,本研究参考哺乳动物和人类中MAD3可以与MAN1(内核膜蛋白MAN1)相互作用(Panetal., 2005; Morettietal., 2017; Miyazonoetal., 2018)事实,研究了BmMAD3与BmMAN1二者的相互作用。有趣的是,在利用I2H系统研究上述蛋白互作过程中发现了BmHSP83和BmMAD3引起I2H假阳性现象,并进一步分析了这种现象的原因。现将研究结果报告如下,希望有助于I2H技术的应用。

图1 昆虫双杂交技术原理示意图Fig.1 Schematic diagram of I2H analysis principle注:A,如果两种蛋白质相互作用,报告基因就会被转录激活;B,如果两个蛋白质不相互作用,报告基因就不能表达;C,昆虫双杂交载体pIE2-DBD,pIE2-AD和报告基因结构示意图(仿Mon et al., 2009)。Note: A, If the two proteins interacted, the reporter gene was activated; B, If two proteins did not interact, the reporter gene could not express; C, Schematic diagram of pIE2-DBD, pIE2-AD and reporter genes of insect two-hybrid vectors (modified on the basis of Mon et al., 2009).
1 材料与方法
1.1 细胞与培养
家蚕卵巢组织Bm12细胞系来自华南农业大学曹阳教授课题组,采用TNM-FH培养基(Hyclone,美国匹兹堡),添加10%胎牛血清(Gibco,美国马萨诸塞州)培养;草地贪夜蛾SpodopterafrugiperdaSF-9细胞系采用SFX昆虫细胞培养基(Hyclone,美国犹他州)和5%胎牛血清(Gibco,美国马萨诸塞州)培养。培养温度27℃,细胞生长对数期时取用。
1.2 载体构建
采用Gateway技术构建载体(包括入门载体与目的载体)(Katzen, 2007)。首先,用总RNA试剂盒Ⅱ(Omega Bio-Tek,美国佐治亚州)从Bm12细胞中提取总RNA(Khuradetal., 2009),用逆转录酶试剂盒(Takara,中国北京)按照产品提示说明合成cDNA,根据目标蛋白的基因序列设计引物,并在5′端加入4个碱基序列(CACC)(表1),采用2×PrimeSTAR Max Premix试剂盒(Takara,中国北京)及其所提示方法PCR克隆这4个基因,反应体系50 μL:25 μL 2×PrimeSTAR Max Premix、1 μL引物、1 μL模板,加无菌双蒸水至50 μL;反应条件为:98℃变性10 s,58℃退火15 s,72℃延伸2 min,32个循环;然后将纯化的PCR产物连接到pENTR-TOPO克隆载体(Invitrogen,美国加利福尼亚州)并转化TOP10菌株(中国北京青科),在含卡那霉素的LB平板上筛选阳性菌落,PCR并测序其产物,验证基因序列,得到4个入门载体。

表1 供试家蚕蛋白质信息
将上述入门载体与I2H载体pIE2-AD、pIE2-DBD(Addgene,美国马萨诸州)反应,得到I2H目的载体pIE2-AD-BmPDIA5、pIE2-AD-BmHSP83、pIE2-AD-BmMAN1、pIE2-AD-BmMAD3、pIE2-DBD-BmPDIA5、pIE2-DBD-BmHSP83、pIE2-DBD-BmMAN1和pIE2-DBD-BmMAD3,转化E.coliDH5α(中国北京青科),挑取单菌落,PCR并测序其产物,验证基因序列。
1.3 细胞转染
将上述目的载体与报告基因载体pUAS-Luc转染SF-9细胞,首先,将细胞转移到96孔板上,每孔100 μL培养基,当90%以上细胞贴壁时方可进行转染。然后,将FuGENE©HD转染试剂(Promega,美国威斯康辛州)4 μL和上述载体1 μg混合,并在室温下静置10 min。转染时,向96孔板中每孔添加10 μL FuGENE©HD转染试剂/载体混合物,吹打均匀后继续培养60 h,再进行发光值检测。实验重复3次。
1.4 发光值检测与数据分析
将100 μL细胞从96孔板中移入空白96孔板,并加入荧光素酶Bright-Gloμ Luciferase Assay System(Promega,赛默飞中国)100 μL,孵育10 min后,用Synergy H1全功能酶标仪(Bio-Tek,美国弗吉尼亚州)检测发光值,并计算相对光单位(Relative light unit, RLU),即实际发光值与对照组(仅转染报告质粒pUAS-Luc)的发光值之比,采用新复极差法比较平均数显著性差异。
2 结果与分析
2.1 载体的构建
入门载体:从4个入门载体中通过PCR分别扩增了目标基因片断,其分子量大小与BmMAN1(2 328 bp)、BmHSP83(2 151 bp)、BmPDIA5(1 899 bp)和BmMAD3(1 335 bp)基因的碱基序列长度一致(图2)。将PCR产物回收并连接到pENTR-TOPO克隆载体中,选择阳性克隆转化子进行PCR鉴定,经测序比对,测序结果与目的基因序列一致,说明入门载体构建成功。

图2 入门载体PCR产物电泳图Fig.2 Electrophoresis profile of PCR products of entry vectors注:M,DNA标记DL5000,marked DL5000;A-1,BmMAN1;B-1,BmHSP83;C-1,BmPDIA5;D-1,BmMAD3。
目的载体:将入门载体与I2H载体pIE2-AD、pIE2-DBD反应构建I2H目的载体,选择阳性菌落并进行PCR鉴定(图3),测序结果与目标序列一致,表明成功构建了目的载体pIE2-AD-BmPDIA5、pIE2-AD-BmHSP83、pIE2-AD-BmMAN1、pIE2-AD-BmMAD3、pIE2-DBD-BmPDIA5、pIE2-DBD-BmHSP83、pIE2-DBD-BmMAN1和pIE2-DBD-BmMAD3。
图3 目的载体PCR产物电泳图Fig.3 Electrophoresis profile of PCR products of objective vectors注:M,DNA标记DL5000,marked DL5000;A1-A3,pIE2-AD-BmHSP83;B1-B3,pIE2-DBD-BmHSP83;C1-C3,pIE2-AD-BmPDIA5;D1-D3,pIE2-DBD-BmPDIA5;E1-E3,pIE2-AD-BmMAN1;F1-F3,pIE2-DBD-BmMAN1;G1-G3,pIE2-AD-BmMAD3;H1-H3,pIE2-DBD-BmMAD3。
2.2 发光值检测
细胞转染60 h后测定发光值(图4)。当单独转染pIE2-DBD-BmHSP83时,相对发光单位(RLU)达到7.37,但显著低于pIE2-AD-BmPDIA5和pIE2-DBD-BmHSP83共转染时10.25的RLU值。然而,当转染单个pIE2-AD-BmPDIA5、pIE2-DBD-BmPDIA5和pIE2-AD-BmHSP83,或pIE2-AD-BmHSP83与pIE2-DBD-BmPDIA5共转染时,其RLU与对照(单独转染报告基因载体)的RLU无显著性差异。
同样,转染pIE2-DBD-BmMAD3或联合转染pIE2-AD-BmMAN1和pIE2-DBD-BmMAD3激活了报告基因的表达,RLU分别为92.49和123.04,两者差异显著。同时,单个pIE2-AD-BmMAN1、pIE2-DBD-BmMAN1和pIE2-AD-BmMAD3的转染,以及pIE2-AD-BmMAD3和pIE2-DBD-BmMAN1的共转染时,RLU值与对照的比没有显著变化(图4)。

图4 不同载体转染SF-9细胞时的发光值检测Fig.4 Luminescent value detection of SF-9 cells transfected by different vectors注:柱状图顶端不同字母表示显著性差异(新复极差法)。Note: Different letters on the colum indicated the significant difference (Duncan’s multiple-range test, DMRT).
3 结论与讨论
本实验发现BmHSP83和BmMAD3在I2H试验中引起假性现象,这是怎样形成的呢?毫无疑问,这与该两种蛋白的功能有关。众所周知,HSP83作为分子伴侣调节基因转录(Khurana and Bhattacharyya, 2015)。在细菌中,HSP83与RNA聚合酶相互作用,引导可热诱导的基因转录(Taipaleetal., 2010);在大多数真核生物中,HSP83可能通过与NF-Κb p65、STA-Ts、Bcl-6、SP1和NF-Il6β等转录因子相互作用来调节基因的转录(Wangetal.,2009; Stark and Jr. Darnell, 2012; Taipaleetal., 2012; Khurana and Bhattacharyya, 2015)。因此,HSP83似乎有转录激活结构域(AD结构域)的功能,但是,HSP83由于缺乏DNA结合能力而不能与DNA结合(Khurana and Bhattacharyya, 2015),因此当它与含有DBD结构域的pIE2-DBD载体融合表达时(pIE2-DBD-BmHSP83),即可以触发下游的报告基因的表达,而pIE2-AD-BmHSP83融合载体由于缺乏BDB结构域而无法启动下游报告基因表达(图5)。
同样,MAD3是TGF-β途径的转录因子,起转录激活剂的作用(Liuetal., 1996; Panetal., 2005),因此pIE2-DBD-BmMAD3可以激活报告基因的表达。尽管MAD3的MH1结构域可以与特定的DNA碱基序列结合(Shietal., 1998; Zaweletal., 1998),但由于报告基因载体上缺少该特定序列,因此pIE2-AD-BmMAD3不能启动报告基因转录,而只有在与DBD结构域融合后才能激活报告基因的表达(图5)。
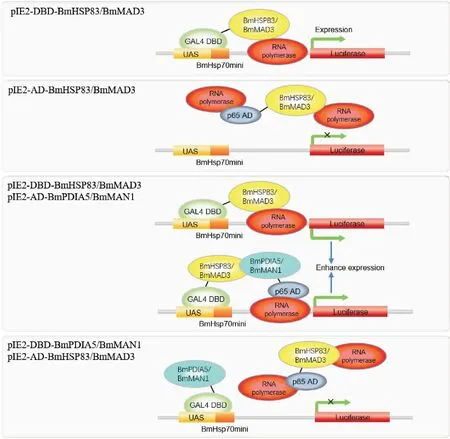
图5 本实验I2H结果的分析Fig.5 Hypothesis analysisfor this experimental result
有趣的是,共转染pIE2-DBD-BmHSP83/MAD3和pIE2-AD-BmPDIA5/BmMAN1质粒时,其发光值显著高于单独转染pIE2-DBD-BmHSP83/MAD3质粒时的发光值,推测这可能是一种叠加效应。一方面是因为pIE2-DBD-BmHSP83/MAD3启动报告基因表达造成的假阳性,另一方面,是共转染pIE2-DBD-BmHSP83/BmMAD3和pIE2-AD-BmPDIA5/BmMAN1时因为BmHSP83与BmPDIA5互作,或BmMAD3与BmMAN1互作造成的真阳性(图5)。反之,共转染pIE2-AD-BmHSP83/MAD3和pIE2-DBD-BmPDIA5/BmMAN1质粒时,其发光值与对照比没有变化,未启动报告基因表达,造成了假阴性结果(图5)。
综上,本实验发现BmHSP83和BmMAD3蛋白当与BDB结构域融合表达时,可引起I2H实验的假阳性,这可能与BmHSP83和BmMAD3蛋白的转录激活功能有关;但是,当融合BDB结构域的BmHSP83和BmMAD3蛋白与融合AD结构域的BmPDIA5或BmMAN1蛋白联合表达时,则产生真假阳性的叠加效应,因此证明BmHSP83和BmPDIA5,以及BmMAD3和BmMAN1是互作蛋白;反之,当融合AD结构域的BmHSP83或BmMAD3蛋白与DBD结构的BmPDIA5或BmMAN1蛋白联合表达时,则产生假阴性结果。本研究结果值得那些利用I2H系统研究具有转录激活功能的蛋白质互作分析时借鉴。

