脊神经内侧支射频消融治疗下腰痛疗效的影响因素
殷婷婷, 刘月军, 杨孺牛, 许亚春
超过80%的成年人在一生中经历过下腰痛,约半数成年人在过去1年经历过下腰痛[1-2]。下腰痛给患者带来了重大的精神和经济负担,也是临床研究的重点[3]。
腰椎小关节、骶髂关节、椎间盘和尾骨的病变都可引起下腰痛,其中腰椎小关节病变占到下腰痛的15%~45%[4-5]。脊神经初级背支的两个内侧支支配腰椎小关节,所以腰椎小关节疼痛的治疗措施包括关节内注射类固醇、内侧支神经阻滞和内侧支神经射频消融(RFA)[6]。在RFA中电流通过射频针尖并产生热量,这种热量会对针尖周围的脊神经内侧分支产生损伤,这种损伤阻止了疼痛信号到达中枢神经系统,因此患者感觉到的疼痛显著减少。
本研究观察RFA术后1年内的临床疗效及其相关影响因素。
1 材料与方法
1.1 临床资料
收集2017年7月至2019年12月于X线引导下行脊神经内侧分支RFA的113例患者的临床数据,患者诊断为下腰痛,年龄>18岁。
下腰痛的诊断根据病史及体格检查确定,包括下腰部僵硬、局部下腰痛以及腰部扭曲、向后弯曲和站立时出现显著的疼痛或者疼痛加重。
纳入患者都行脊神经内侧支阻滞,若阻滞后患者疼痛缓解程度超过50%则可以行相应节段的脊神经内侧支的RFA治疗,并在6个月和1年的随访中记录疼痛视觉模拟评分(VAS)。
排除①RFA术后1年内再次接受RFA治疗的患者;②先前有神经刺激治疗的患者,如脊髓刺激、周围神经刺激和背根神经节刺激。
1.2 方法
介入手术操作使用前后位或略微倾斜的X线透视对目标小关节进行放射学识别。标准射频靶点为目标小关节横突内侧的基底部,并在体表皮肤标记穿刺点,穿刺点及周围皮肤常规消毒铺无菌洞巾,1%利多卡因皮下浸润麻醉,取两根射频电极针在X线监视下将针尖放置到靶点的骨面处。一旦骨接触感觉良好,置入电极连接射频发生器,在开始射频消融治疗前进行3 mv的运动测试,以确保电极位置安全。每个靶点通过针芯注入2%利多卡因1 mL,而后在80℃下进行75 s的RFA治疗,RFA治疗后,每个部位注射0.5%的布比卡因1 mL,然后拔除套管针,穿刺点贴无菌贴膜。
收集患者的信息包括年龄、性别、体重指数(BMI)、吸烟史、术前镇痛药物的使用以及剂量(为了便于分析,将镇痛药物的剂量转换为口服吗啡等效剂量[7])、雌激素使用、术前和术后VAS评分以及与手术相关的并发症。VAS评分基于自我报告的腰背部疼痛的测量,并记录为量表两端之间的连续量表,无痛对应于量表的左端(0 cm),最严重的疼痛对应于量表的右端(10 cm);吸烟史定义为在手术前的任何一段时间内以及在随访期间吸烟者,没有自我报告为吸烟者的个人归类为不吸烟者。
完成数据收集后,将研究队列中的患者划分为疗效确切组和疗效不佳组。疗效确切定义为VAS评分较术前改善≥30%[8],其他的则纳入疗效不佳组。
1.3 统计分析
使用SPSS 22.0软件进行统计分析。正态分布的计量资料以均数±标准差表示,比较采用两独立样本的t检验;非正态分布的计量资料采用中位数和四分位数间距表示,使用Mann-Whitney U检验进行组间比较;计数资料以例数(%)表示,并使用卡方检验。对所有纳入的临床影响因素进行回归分析,连续变量用线性回归分析,二分类变量采用二元logistic回归分析,P<0.05认为差异有统计学意义。
2 结果
113例患者年龄为(64.2±11.7)岁,女性48例(42.47%),男性65例(57.53%)。56例(49.56%)患者在手术前服用镇痛药物。随访期间无一例患者发生与RFA治疗相关的并发症。
2.1 术后6个月的随访结果
术后6个月两组患者的临床特征见表1。113例患者中有74例(65.5%)疗效确切,39例(34.5%)疗效不佳。RFA术后6个月疗效确切与雌激素使用、低镇痛药物使用和较低的术前镇痛药物使用剂量显著相关。

表1 脊神经内侧支行RFA术后6个月的患者特征和临床疗效
2.2 术后1年的随访结果
RFA术后1年患者的临床特征如表2所示。113例患者中有42例(37.17%)疗效确切,71例(62.83%)疗效不佳。RFA术后1年疗效确切与较低的镇痛药物使用率、术前镇痛药物消耗低消耗剂量和较高的术前VAS疼痛评分显著相关。

表2 脊神经内侧支行RFA术后1年的患者特征和临床疗效
2.3 镇痛药物使用剂量的临床疗效
镇痛药物使用剂量分为<20 mg/d、20~40 mg/d、>40 mg/d,镇痛药剂量<20 mg/d的临床疗效好于20~40 mg/d、>40 mg/d。见表3。
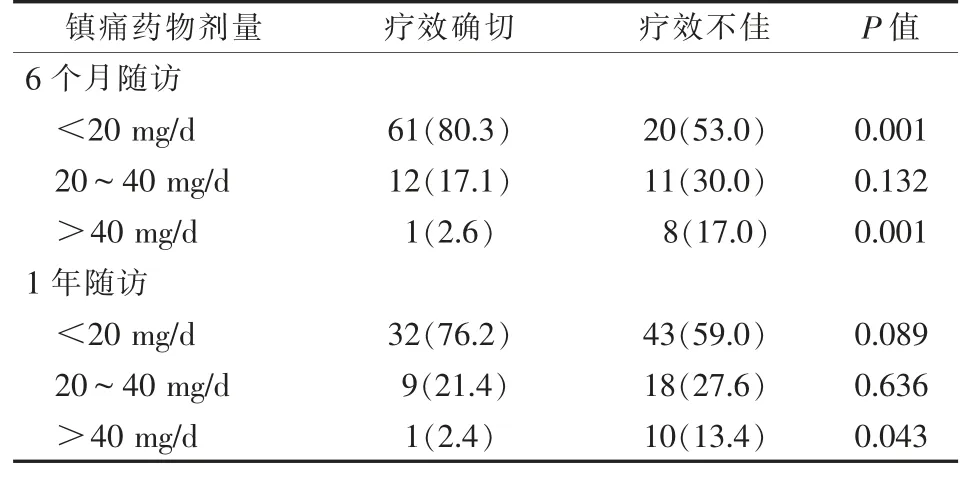
表3 术前镇痛药物不同使用剂量的临床疗效[例(%)]
3 讨论
一项随机对照试验的meta分析得出结论,与神经阻滞等其他治疗手段相比,RFA可以显著改善下腰痛患者的疼痛评分、提高生活质量、恢复工作能力[8]。RFA是治疗慢性脊柱疼痛常用的介入手术[1,9]。本研究结果显示,较低的镇痛药物使用率、较低的剂量以及较高的术前VAS评分与术后1年的临床疗效有显著的相关性,使用<20 mg/d的患者在术后第6个月和1年时,RFA的临床疗效显著增加;而>20 mg/d时,镇痛药物的使用剂量与临床疗效成负相关,其他因素包括年龄、BMI、吸烟史和性别等与临床疗效无显著相关性。
较低的镇痛药物使用率相关的临床数据与Cohen等[10]的研究一致,而Odonkor等[11]的研究发现,镇痛药物的使用剂量与RFA的临床效果之间无显著的相关性。本研究表明,使用镇痛药物<20 mg/d患者临床疗效显著,随着镇痛药物使用剂量的继续增加,临床疗效会逐渐降低。评估脊髓刺激器有效性的研究表明,镇痛药物使用剂量较高的患者疼痛缓解率降低[12]。其机制可能是镇痛药物使伤害性感受器敏感化以及患者对疼痛耐受性降低[13]。
本研究还发现术前较高的VAS评分与RFA术后1年内的临床疗效存在相关性。说明VAS评分较高的患者有更多的机会从疼痛介入治疗中受益。考虑到VAS评分的主观性,推测一些患者可能只在极端情况下才对疼痛评分,而不是在中等疼痛强度时进行评分。Loh等[14]研究发现,术前VAS评分和RFA术后的临床疗效没有显著关联,与本研究不一致。
有研究表明高BMI指数和高龄患者会导致不佳的临床疗效[15-16]。本研究未发现临床疗效与年龄或体重指数之间有显著的相关性。性别和吸烟史对RFA的疗效亦没有影响,其实女性和男性、吸烟者和不吸烟者下腰痛疼痛的患病率是相似的[17]。众所周知,疼痛存在性别差异,而造成这些差异的潜在机制尚不清楚。在临床工作中,女性患者相对于男性对疼痛的耐受性更低且比男性有更高的VAS评级[18]。吸烟可以增加循环中促炎性细胞因子的释放而加剧疼痛,且与脊柱手术后疼痛复发有显著的相关性[19]。
一项对植入脊髓刺激器的患者进行的多中心回顾性研究得出结论,肥胖、吸烟、年龄、镇痛药物的使用、体重指数和性别对1年临床疗效没有显著影响[20]。
雌的激素使用与6个月后的临床疗效呈正相关,但与1年后没有相关性。雌激素有多种作用,如免疫调节、骨沉积、血管扩张和伤害性感受器调节。本研究结果表明RFA治疗后雌激素的使用有短期益处而无长期益处。在RFA术后1年的临床疗效与激素治疗之间无相关性可能是由于其他原因导致的,包括样本量低、雌激素使用者数量少等因素。
本研究的局限性是观测临床疗效的唯一指标是VAS评分,而单独疼痛评分是一种主观的衡量标准,未来的研究应该考虑更客观的疼痛衡量标准,如身体功能、残疾指数或术后镇痛类药物消耗剂量等因素。
总之,RFA治疗下腰痛1年后,使用镇痛药物尤其是大剂量镇痛药物的患者临床疗效欠佳。年龄、性别、体重指数和吸烟史与RFA术后一年的临床疗效无关。以后的研究应该根据本研究中确定的因素对患者进行分层,最终确定预测因素,为患者带来更好的治疗选择,节约宝贵的医疗资源。

