miR-213靶向SRC抑制胃癌细胞的增殖和迁徙
侯花屏,刘新奇,石菲
1.榆林市第一医院普外科,陕西 榆林 719000;2.空军军医大学航空航天医学院,陕西 西安 710032
胃癌又称胃腺癌,是世界上第四大癌症类型,也是癌症相关死亡的第二大原因[1]。研究表明,胃癌发生与性别和年龄有关,男性发病率高于女性。50 岁以上人群中胃癌的发病率明显升高[2-3]。胃癌在亚洲、拉丁美洲、中欧和东欧的发病率较高[1]。由于在早期阶段,胃癌没有临床表现,许多患者在疾病的晚期才被诊断,因此胃癌的治疗效果欠佳[2]。虽然病理诊断和手术治疗是提高胃癌患者生存率的有效手段,但由于胃癌的复发和转移,胃癌患者的5 年生存率仍然很低[3]。越来越多的证据表明,miRNA 对胃癌发生发展有着重要调节作用,miRNA 代谢的紊乱可能是胃癌的潜在发病机制[4-6]。有研究表明,miR-213在乳腺癌、头颈部鳞状细胞癌和舌细胞癌中发挥重要的调控作用[7-10],而miR-213对胃癌的调控作用尚不明确。本研究拟探究miR-213 对胃癌细胞增殖和转移的作用及机制。
1 材料与方法
1.1 材料和仪器 澳洲胎牛血清(美国Gibco 公司,货号:10100147)、低糖的DMEM 细胞培养基(美国Gibco 公司,货号:31330095)、Ⅰ型胶原(美国Gibco公司,货号:A1048301);Lipofectamine 2000(美国Invitrogen 公 司,货 号:11668030);miRNA 核 苷 酸 序 列(miR-213 序列)(生工生物公司);RNA 的抽提试剂盒(日本TaKaRa 公司,货号:639505)、反转录试剂盒(日本TaKaRa 公司,货号:639549)、扩增试剂盒(日本Ta-KaRa 公司,货号:639503);q-PCR 引物由生工生物公司合成;CCK-8细胞增殖检测试剂盒(碧云天公司,货号:b4758);抗Ki67 抗体(美国Abcam 公司,货号:ab32147)、抗E-cadherin 抗体(美国Abcam 公司,货号:ab128873)、抗N-cadherin 抗体(美国Abcam 公司,货号:ab135745)和抗GAPDH 抗体(美国Abcam 公司,货号:ab78453);DNA 内切酶及连接酶(北京百奥莱博科技有限公司,货号:BTN130639 和BTN130653)。实时荧光定量PCR仪(美国Applied Biosystems公司,型号:ABI7500fast);酶标仪(上海沛欧分析仪器有限公司,型号:SPS5845);显微镜(日本Olympus 公司,型 号:cx21fs1);电泳仪及发光仪(中国天能公司,型号:天能EPS600)。
1.2 方法
1.2.1 标本收集 选取2018年1月至2020年1月期间在榆林市第一医院行胃腺癌切除术的患者30例,收集患者胃癌组织及癌旁组织。标本收集均经过患者知情同意并签署知情同意书后进行。纳入标准:首次行手术切除的胃癌患者,术后经病理诊断为胃腺癌者;年龄为45~75岁男性。排除标准:不同意参加本次试验者;存在心、肝及肾脏等重要脏器功能障碍者;不能够配合者;长期服用药物者;近5 年间罹患高血压、糖尿病、冠心病及其他恶性肿瘤者;有过胃肠道手术病史者。
1.2.2 细胞培养及转染 人正常胃黏膜上皮细胞GES-1 和胃癌细胞系MNK-45、MGC803、SCG-7901、AGS 购买自苏州思瑞坦细胞库。根据转染寡核苷酸序列不同分为转染miR-213 阴性对照序列(5'-CAG GGC UAU GGC UAU GGC UAU GC-3')的对照组和转染miR-213 模拟序列(5'-AGC AGC CUU GUA CAG GGC UAU GA-3')的模拟物组[11]。转染时将普通培养基去除,换为低血清的、不含抗生素的培养基继续培养6 h;在此期间,将Lipofectamine 2000 和由公司合成的miRNA 相关核苷酸序列混合均匀,室温放置30 min,待脂质体将核苷酸序列充分包裹;在培养6 h后将适量上述脂质体混合液加入到上述低血清培养基中(miRNA 相关核苷酸序列浓度为80 nmol/L)继续常规培养6 h,随后更换上述培养基为常规培养基,继续培养细胞。
1.2.3 q-PCR 检测miRNA 表达量 按照说明书利用RNAiso进行细胞裂解,室温裂解2 min 后加入适量的三氯甲烷震荡,待溶液完全乳化,室温放置10 min后见萃取分层,高速离心后取无色上清加入等体积的异丙醇,充分混合后冰冻过夜。离心后弃去上清,加入无水乙醇充分洗涤沉淀,弃去上清,加入DEPC水溶解RNA。根据说明书配制反应液并设置参数,反转录条件:37℃预热15 min,42℃加热15 min,85℃加热5 s,反应结束后得到的cDNA用于后续实验。根据扩增试剂盒说明书配制反应液,经过预变性和扩增反应等步骤完成扩增步骤,利用相对定量法进行数据分析,扩增条件:95℃预变性30 s,95℃维持5 s,60℃维持34 s,进行40个循环[11]。
1.2.4 细胞增殖能力检测 根据CCK-8 试剂盒说明书配制反应液,将上述反应液按照一定浓度加入到MNK-45 细胞中,随后再将细胞放入常规孵箱培养,利用酶标仪检测各组细胞的吸光度[11]。
1.2.5 transwell实验检测细胞迁徙 利用常规方法在transwell 的上、下培养室中加入基质凝胶和相应培养基。将MNK-45 细胞接种到上部培养室,48 h 后利用固定液固定MNK-45细胞,染色后利用显微镜对细胞进行观察,记录发生迁徙的细胞数目[12]。
1.2.6 划痕实验检测细胞迁徙 使用移液器的细枪头在培养有融合度达到80%左右MNK-45 细胞的培养板上进行划线,随后将划线后的培养板继续放入孵箱中常规培养,分别记录各时间点不同组别细胞划痕的愈合情况[12]。
1.2.7 Western blot 技术检测蛋白表达量 利用蛋白酶裂解液裂解细胞,在上述液体中加入缓冲液,利用煮沸方法制备上样蛋白样品。电泳参数:95 V进行30 min 完成浓缩胶的电泳,随后调整为120 V 电泳90 min 完成分离胶的电泳;转膜参数:250 mA 恒流转膜2 h。按照Ki67 (1∶3 000 稀释)、E-cadherin(1∶5 000 稀释)、N-cadherin(1∶3 000稀释)和GAPDH(1∶10 000稀释)抗体说明书配制抗体,室温孵育4 h,取出条带后冲洗干净,配制带有辣根过氧化物酶的二抗孵育液,随后室温孵育1 h,进行发光[11]。
1.2.8 荧光素酶报告基因系统的构建和检测 通过靶基因预测软件发现潜在靶基因肉瘤基因(sarcoma gene,SRC)的结合序列,并对其人工合成,即可得到非编码(untraslated regions,UTR)序列,对上述序列进行突变即可得到突变(mutation,MUT)序列。利用DNA内切酶及连接酶将合成的上述基因插入到质粒中,将上述质粒进行扩增并抽提。随后利用制备得到的质粒和UTR 或者MUT 序列共转染入MNK-45 细胞(细胞转染方法同前)。随后利用酶标仪检测细胞内荧光素酶活性[11-12]。
1.3 统计学方法 利用SPSS19.0 统计软件进行相关数据分析。计量数据以均数±标准差(±s)表示;当进行两样本间比较时采用独立t 检验,当进行不同时间点多次测量的样本分析时采用重复测量方差分析;组间比较采用Bonferroni post hoc检验。以P<0.05为差异有统计学意义。
2 结果
2.1 miR-213 在胃腺癌组织和胃癌细胞系中低表达 与癌旁组织比较,胃癌组织中miR-213低表达,差异有统计学意义(P<0.05),见图1A。与正常胃黏膜上皮细胞GES-1 比较,胃癌细胞系MNK-45、MGC803、SCG-7901 和AGS 中miR-213 低表达,差异均有统计学意义(P<0.05),见图1B。
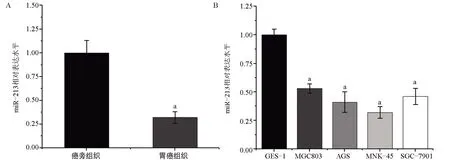
图1 q-PCR检测临床胃癌样本及细胞系内miR-213的含量
2.2 转染miR-213 模拟序列能够上调细胞内miR-213 的水平 与对照组比较,模拟物组细胞内miR-213含量增加,差异有统计学意义(P<0.05),见图2。
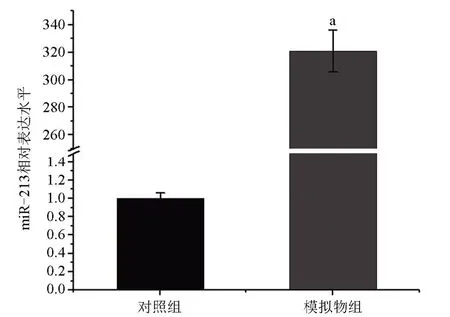
图2 q-PCR检测胃癌细胞系MNK-45内miR-213的含量
2.3 转染miR-213 模拟序列抑制胃癌细胞系MNK-45 的增殖 与对照组比较,模拟物组细胞增殖能力降低,差异有统计学意义(P<0.05),见图3。
2.4 transwell 验证转染miR-213 模拟序列抑制胃癌细胞的迁徙 与对照组比较,模拟物组细胞迁徙能力下降,差异有统计学意义(P<0.05),见图4。
2.5 划痕实验验证转染miR-213 模拟序列抑制胃癌细胞的迁徙 与对照组比较,模拟物组细胞迁徙能力下降,差异有统计学意义(P<0.05),见图5。
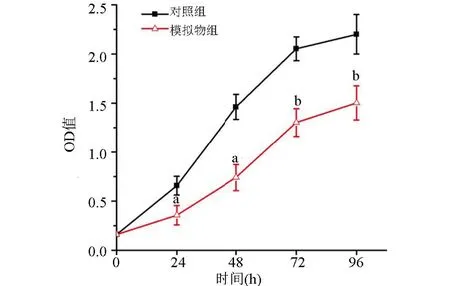
图3 CCK-8法检测MNK-45细胞的增殖能力
2.6 miR-213模拟序列调控相关蛋白表达 与对照组比较,模拟物组细胞Ki67 和N-cadherin 表达下降,但E-cadherin 表达增加,差异有统计学意义(P<0.05),见图6。
2.7 SRC 是miR-213 的靶基因 为进一步研究miR-21 的抑癌机制,利用Targetscan 和MiRanda 等靶基因预测软件预测了miR-213 的潜在靶基因,发现SRC 基因的3’UTR 上存在miR-213 的潜 在结合位点。继而,利用荧光素酶报告基因技术发现,与对照组比较,模拟物组质粒的荧光素酶活性降低,差异有统计学意义(P<0.05),见图7。
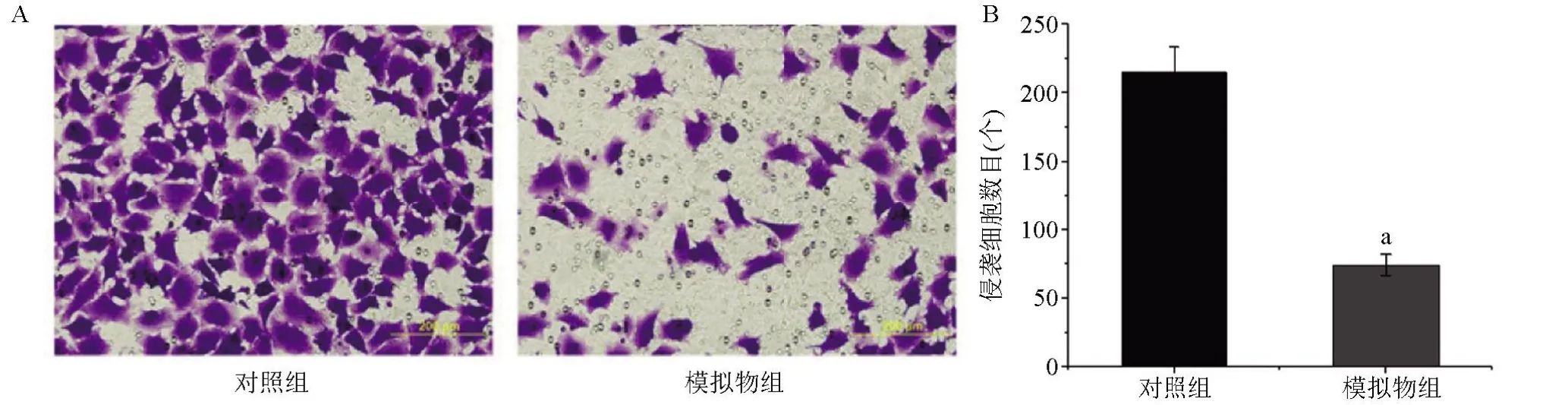
图4 transwell检测MNK-45细胞的迁徙能力
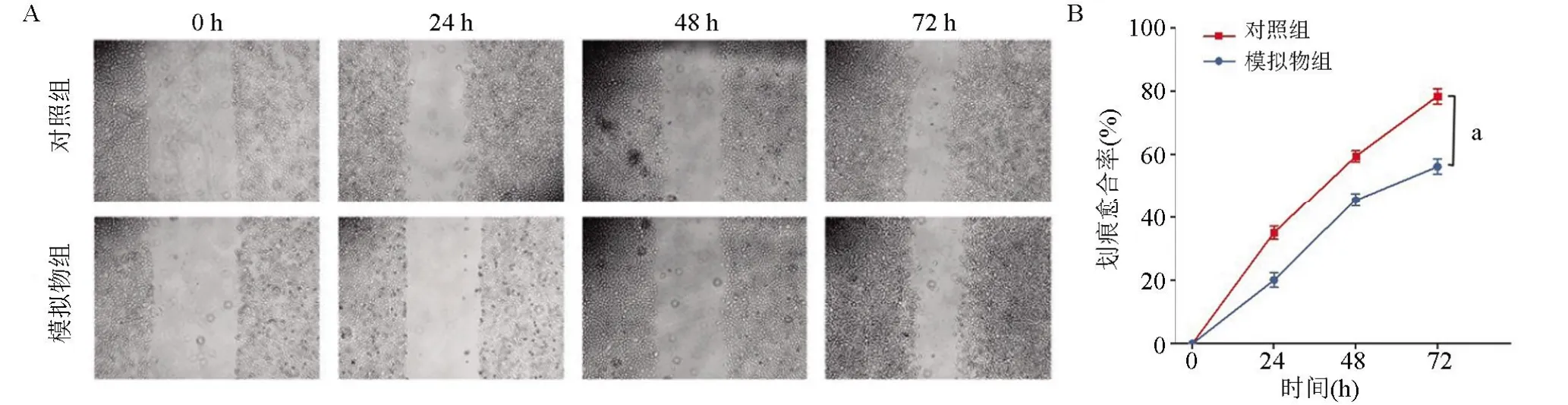
图5 划痕实验检测MNK-45细胞的迁徙能力
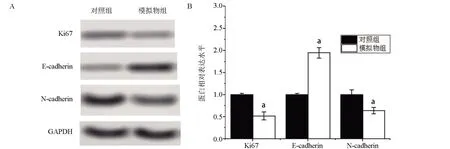
图6 Western Blot检测MNK-45细胞中Ki67、E-cadherin和N-cadherin蛋白的表达
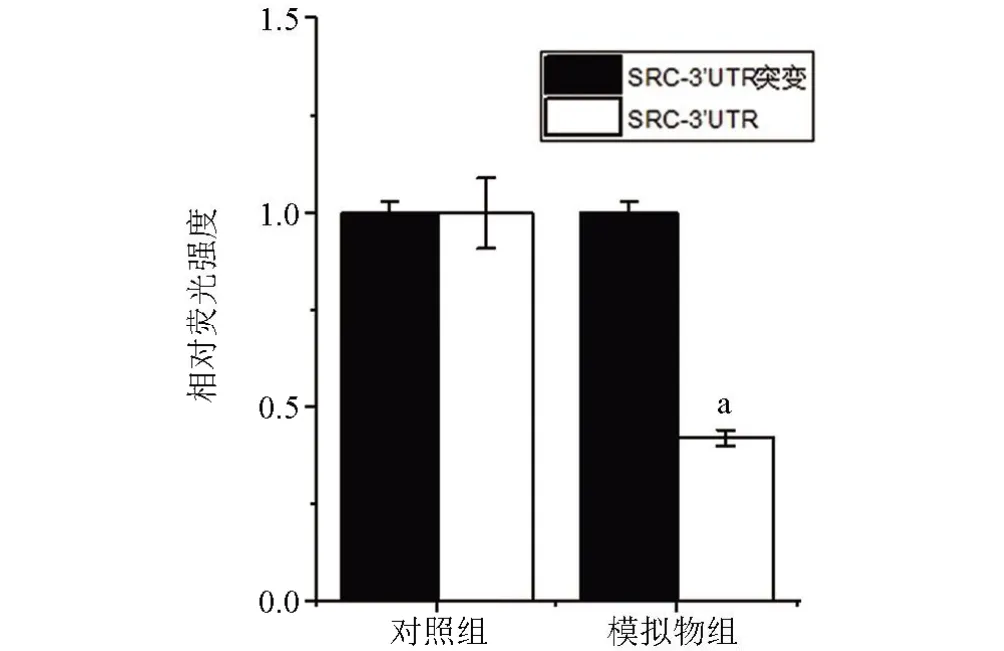
图7 荧光素酶报告基因结果验证
3 讨论
胃癌是世界范围内最常见的胃肠道疾病之一,是导致癌症相关死亡的第二大原因。由于胃癌在早期没有明显临床表现,大多数患者在后期才被发现,往往错过治愈机会[1-3]。故深入研究胃癌发病机制及寻求治疗新靶点成为近年来的研究热点。而miRNA研究较为深入,已有多种miRNA药物已经进入临床试验[13]。
在文献回顾中发现,miR-213在乳腺癌、头颈部鳞状细胞癌和舌细胞癌中发挥重要的调控作用[7-10]。为探究miR-213 在胃腺癌中的作用,课题组首先在患者知情同意下,按照严格的纳入标准和排除标准收集胃腺癌样本30 例。与癌旁组织比较,胃腺癌组织中miR-213低表达;与正常胃黏膜细胞比较,多种胃癌细胞系中miR-213 低表达。上述结果表明,miR-213 可能在胃癌中发挥抑癌作用。随后课题组证明,上调miR-213 抑制胃癌细胞系的增殖和迁徙,这与之前学者研究报道一致[9-10]。GREITHER 等[9]发现,miR-213在头颈部鳞状细胞癌中低表达,上调miR-213 能够抑制鳞状细胞癌的增殖和迁徙。WONG 等[10]证实,miR-213能够抑制舌细胞癌的增殖和侵袭作用。但也有学者报道,miR-213在乳腺癌中高表达,其能够促进乳腺癌的增殖和侵袭[7-8]。miR-213在调控肿瘤细胞增殖方面的差异可能是由于肿瘤细胞来源不同,这同时也说明了miR-213在细胞增殖调控中的复杂性。
Ki67 是临床和基础研究中较为常见的细胞增殖标志物,其含量越高,增殖能力越强[14]。N-cadherin 和E-cadherin两种蛋白在上皮间充质转化这一肿瘤转移的始动环节中发挥关键调控作用。N-cadherin作为常用间叶细胞标志物,而E-cadherin 作为常见的上皮细胞标志物,广泛用于临床诊断。细胞从上皮细胞向间叶细胞表型的转变的一个标志是:E-cadherin 的表达下降以及N-cadherin 的表达升高,此时肿瘤细胞的转移能力增强[15-16]。在本实验中,课题组发现miR-213能够下调Ki67 和N-cadherin 的表达,而上调E-cadherin的表达,这从另一方面证实了miR-213能够抑制胃癌细胞的增殖和迁徙。
目前研究表明,在人类的多种肿瘤中SRC 基因被过度激活,进而促进肿瘤的生长及侵袭[17]。已有研究证实,抑制SRC 基因的活化可以发挥有效的抑癌作用[18-19]。为了探究miR-213抑制胃癌细胞增殖和迁徙的机制,首先利用生物信息学分析技术预测了miR-213 可能的靶基因,发现miR-213 与SRC 基因有着较高的匹配度。随后课题组通过荧光素酶报告基因技术证明了miR-213 直接靶向作用于癌基因SRC,这可能是miR-213 发挥抑癌作用的重要方式。后续研究将进一步在体验证miR-213的抑癌作用。
综上所述,胃癌组织及胃癌细胞系内低表达miR-213,miR-213 可靶向SRC 抑制胃癌细胞的增殖和迁徙。

