内脂素-Nampt轴在卵巢上皮癌进展中的作用
白 娥,王 丽,李海军,韩苏夏
(1.西安交通大学第一附属医院:1.妇产科;2.胸外科;3.肿瘤放射治疗科,陕西西安 710061)
卵巢癌发病率在我国居女性生殖系统恶性肿瘤第3位,死亡率居妇科恶性肿瘤第2位[1-2]。卵巢癌组织学类型繁多,其中以上皮性癌(epithelial ovarian cancer,EOC)最为常见,约占原发性卵巢肿瘤的50%~70%,占卵巢恶性肿瘤85%~90%。大量流行病学研究显示,肥胖增加卵巢癌的发病风险[3];卵巢癌解剖毗邻于大网膜、肠系膜等区域,也常出现大网膜、腹腔转移;此外,卵巢癌患者多合并有肥胖或腹部脂肪堆积。因此,肥胖与卵巢癌的发生与进展关系甚为密切。
目前,全球超重、肥胖人群日益庞大,而超重、肥胖人群主要特征之一即表现为高内脂素血症。内脂素(visfatin)主要由脂肪细胞分泌,尤其在肥胖状态下明显升高,其与细胞糖脂代谢密切相关[4]。内脂素与肿瘤关系密切,也成为肿瘤新治疗方案潜力靶点之一。有大量研究结果表明,内脂素与结肠癌、乳腺癌、胃癌、膀胱癌及子宫内膜癌等上皮源性肿瘤发病风险增加有关;在肿瘤患者血清中升高且与大部分肿瘤进展呈正相关性;内脂素还与人口腔鳞癌、乳腺癌、胶质瘤、胃癌等上皮源性肿瘤患者总体生存率和远处转移相关[5]。脂肪细胞、炎症细胞及内皮细胞等多种类型细胞均可释放内脂素,进而作用于肿瘤;肿瘤细胞也可分泌内脂素,肿瘤患者血清中存在高水平的内脂素,这提示内脂素涉及自分泌、旁分泌及内分泌信号作用于肿瘤细胞。内脂素可通过调控AKT、ERK 1/2等多种信号通路作用于靶细胞[6];还具有类似烟酰胺磷酸核糖转移酶(nicotinamide phosphoribosyl transferase,Nampt)的活性而催化烟酰胺合成烟酰胺单核苷酸,其进入细胞内进行补救合成烟酰胺腺嘌呤二核苷 酸(nicotinamide adenine dinucleotide,NAD)[5]。Nampt是一种具有多功能的生物活性蛋白,在NAD生物合成、代谢、炎症免疫反应与细胞增殖、分化、凋亡等诸多领域内发挥作用。因分布不同分为细胞内Nampt、细 胞 外Nampt(extracellualr Nampt,即 内 脂素)。细胞内Nampt是细胞内烟酰胺生物合成NAD+途径中的关键限速酶,催化烟酰胺合成烟酰胺单核苷酸,进而完成NAD+的补救合成;其也与肿瘤关系密切并在卵巢癌中呈高表达[7]。另有研究表明,腹水来源的内脂素可促进卵巢上皮癌细胞迁移进而形成腹腔内转移[8]。因此,内脂素-细胞内Nampt轴与卵巢上皮癌进展有着重要联系,但现阶段相关研究甚少。本研究目的在于探讨内脂素-Nampt轴在卵巢上皮癌进展中的作用及对患者预后的影响。
1 材料与方法
1.1 研究对象
将西安交通大学第一附属医院妇产科2015年1月至2016年1月经手术治疗且随访资料完整的卵巢上皮癌患者(n=70)作为主要研究对象,采集卵巢上皮癌患者术前血清与术中切除的肿瘤组织;另采集同期卵巢良性肿瘤患者(n=28)与健康体检人群血清(n=20),以及因其他疾病切除的正常卵巢组织(n=20)。所有患者既往无其他恶性肿瘤病史,术前均未接受化学治疗、放射治疗、免疫治疗等。所有患者及健康体检人群均知晓该实验内容并签知情同意书。收集患者年龄、身高、体质量、肿瘤组织学类型、分化程度、TNM、FIGO分期(2017年,第8版)。计算体质指数(BMI),即BMI(kg/m2)=体质量/身高平方。
1.2 ELISA检测血清CA125、HE4、内脂素水平
严格按照ELISA试剂盒说明书进行测定各组血清CA 125、HE4及内脂素浓度。
1.3 免疫组化SP法检测组织Nampt表达
所有组织标本经福尔马林固定,常规制作5μm厚石蜡切片,免疫组化SP法检测Nampt在卵巢上皮癌及正常卵巢组织的表达。兔抗人Nampt单克隆抗体购自美国Proteintech公司,工作浓度1∶100稀释。通用型SP免疫组化试剂盒购自北京中杉金桥公司,染色方法按照试剂盒说明书进行。
1.4 判定标准
细胞内Nampt蛋白位于胞核与胞质,阳性显色为不均质棕色颗粒,依据细胞染色强度和阳性细胞比例进行评分[9]。每例标本随机选取5个高倍镜视野:①按染色强度计分:无色(0分)、淡黄色(1分)、棕黄色(2分)、棕褐色(3分);②按各视野中阳性细胞数的平均百分比计分:≤4%(0分)、5%~24%(1分)、25%~49%(2分)、50%~74%(3分)、≥75%(4分)。总体评分=①×②,本研究中将总体评分<4作为阴性表达,≥4作为阳性表达。
1.5 统计学分析
参数均值用(±s)表示,分类变量组间比较采用χ2检验,计量变量组间比较采用t检验,相关性分析采用Spearman相关分析,受试者工作特征曲线(receiver operating characteristic curve,ROC)用于评估CA 125、HE4、内脂素对卵巢上皮癌的诊断价值。1年、3年、5年生存率采用Life tables,生存比较分析采用Kaplan-Meier,Cox多因素回归模型用于评估患者预后的危险因素。P<0.05为差异有统计学意义。
2 结 果
2.1 临床病理特征分析
卵巢上皮癌患者年龄22~69岁,平均年龄(50.06±10.00)岁;组织学类型包括低级别浆液性癌4例、高级别浆液性癌54例、Ⅰ级黏液性癌4例、Ⅱ-Ⅲ级黏液性癌4例、Ⅱ-Ⅲ级子宫内膜样癌2例、透明细胞癌2例。TNM分期中T 1a 27例、T 1b 11例、T 1c 4例、T 2a 12例、T 2b 3例、T 3a 4例、T 3b 1例、T 3c 8例;N 0 58例、N 1 12例;M 0 68例、M 1 2例。FIGO分期中Ⅳ27例、ⅠB 11例、ⅠC 4例、ⅡA 12例、ⅡB 3例、ⅢA 4例、ⅢC 7例、Ⅳ2例。卵巢良性肿瘤患者年龄25~62岁,平均年龄(47.52±9.19)岁。健康体检人群年龄21~59岁,平均年龄(46.77±11.27)岁。
2.2 各组人群血清中CA 125、HE4、内脂素水平的比较
卵巢上皮癌患者血清CA 125、HE4、内脂素浓度显著高于卵巢良性肿瘤患者及正常对照人群(P<0.05),但卵巢良性肿瘤患者与正常对照组间差异无统计学意义(P>0.05,表1)。

表1 3组人群血清CA125、HE4、内脂素水平的比较Tab.1 CA 125,HE4 and visfatin in the serum from different groups
ROC曲线分析显示,血清CA 125诊断卵巢上皮癌的AUC为0.906(P<0.001,95%CI:0.849~0.964),界值34.5 U/mL;HE4诊断卵巢上皮癌的AUC为0.933(P<0.001,95%CI:0.884~0.983),界值156.5 pmol/L;血清内脂素诊断卵巢上皮癌的AUC为0.744(P<0.001,95%CI:0.656~0.832),界值5.95 ng/mL(图1)。以上结果显示,血清内脂素水平对卵巢上皮癌诊断具有一定的价值。

图1 CA125、HE4、内脂素用于诊断卵巢上皮癌的ROC曲线Fig.1 ROC analysis for the optimal cut-off value of CA 125,HE4 and visfatin
Ⅲ-Ⅳ期患者血清内脂素水平[(7.92±1.24)ng/mL]显著高于Ⅰ、Ⅱ期患者[(6.02±0.91)ng/mL、(5.72±0.96)ng/mL](P<0.05),但Ⅰ、Ⅱ期患者组间差异无统计学意义(P>0.05)。卵巢上皮癌患者血清内脂素浓度与T、N、FIGO分期有关(P<0.05),但与患者年龄、BMI、肿瘤组织学类型、分化程度无明显相关(P>0.05)。卵巢上皮癌患者血清内脂素水平与CA 125呈正相关性(r s=0.389,P=0.001),与HE4无显著相关性(r s=0.220,P>0.05)。
2.3 Nampt在卵巢上皮癌组织中表达与临床病理特征之间关系
Nampt蛋白存在于细胞胞质与细胞核内(图2)。卵巢上皮癌组织Nampt阳性表达率为78.6%(55/70),正常卵巢组织为40.0%(8/20),差异有统计学意义(χ2=11.020,P=0.001)。卵巢上皮癌组织Nampt的表达与FIGO分期、患者血清内脂素水平有关(表2,P<0.05),但与患者年龄、肿瘤组织学类型、分化程度及T、N分期和BMI无关(P>0.05)。肿瘤细胞内Nampt蛋白表达与患者血清内脂素水平呈正相关性(r s=0.55,P<0.001)。

表2 Nampt在卵巢上皮癌组织中的表达与临床病理特征之间的关系Tab.2 Expression of Nampt protein in epithelial ovarian cancer and its relationship with these clinicopathological features
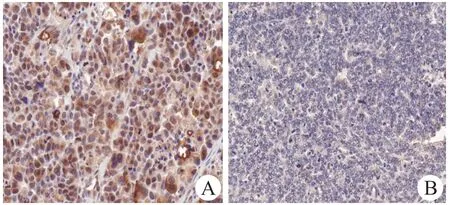
图2 免疫组化染色检测Nampt在卵巢上皮癌组织中的表达情况Fig.2 Expression of Nampt protein in epithelial ovarian cancer tissues(×400)
2.4 内脂素-细胞内Nampt轴与卵巢上皮癌患者预后之间的关系
采用Cox多元回归模拟方程分析患者性别、年龄、组织学类型、分化程度、TNM、FIGO分期、血清内脂素水平、细胞内Nampt表达情况对患者总体生存期的影响。本研究中卵巢上皮癌患者1年、3年、5年生存率分别为98.6%、74.3%、34.3%。单因素生存分析显示,卵巢上皮癌患者生存期与T(T 1+T 2vs.T 3)、N(N 0vs.N 1)、FIGO分期(Ⅰ+Ⅱvs.Ⅲ+Ⅳ)、血清内脂素水平(<5.95 ng/mLvs.≥5.95 ng/mL)、肿瘤细胞Nampt表达(阴性vs.阳性)有关(P<0.05,表3),但与患者年龄、BMI、组织学类型、分化程度无关(P>0.05);多因素生存分析显示,FIGO分期、肿瘤细胞Nampt表达是影响患者预后的独立因素(P<0.05)。Nampt表达阳性、阴性卵巢上皮癌患者平均总体生存期分别为(58.40±4.45)月、(48.77±2.17)月,差异有统计学意义(P=0.003,图3);FIGO分期中Ⅰ+Ⅱ期、Ⅲ+Ⅳ期卵巢上皮癌患者平均总体生存期分别为(56.95±1.54)月、(25.50±1.87)月,差异有统计学意义(P<0.001,图3)。
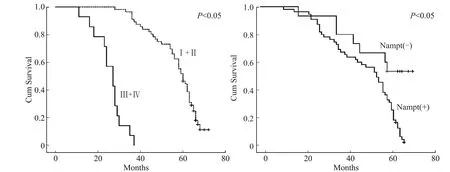
图3 FIGO分期与肿瘤细胞Nampt表达对患者总体预后影响的生存曲线Fig.3 Kaplan-Meier analysis of the EOC patients’overall survival relative to FIGO stage and Nampt expression
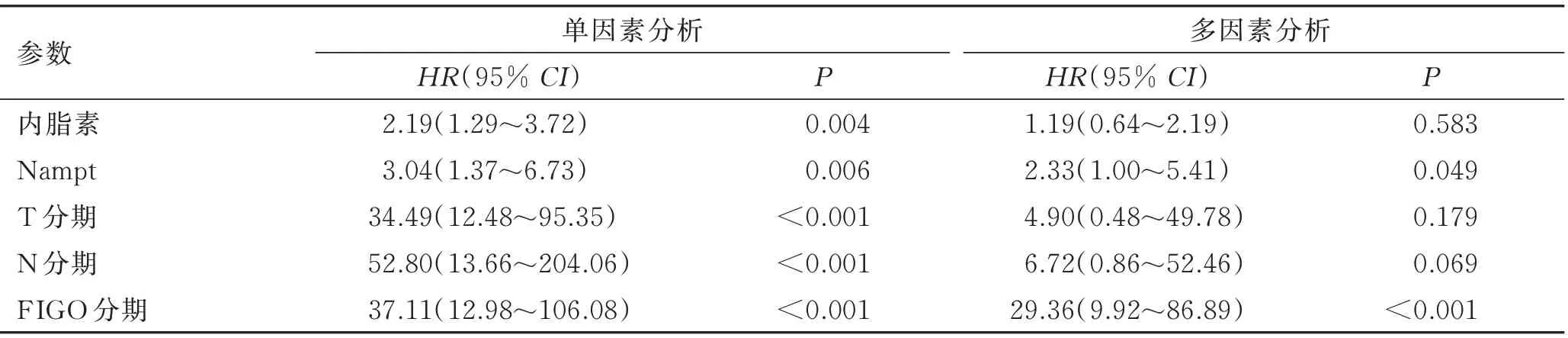
表3 卵巢上皮癌患者的总体生存期分析Tab.3 Association of Nampt and clinicopathological features with overall survival by univariate analysis and Cox multivariate regression analysis
3 讨 论
肥胖与多种恶性肿瘤发生与进展密切有关[3],肥胖也增加卵巢癌发病率,但肥胖与卵巢癌尤其卵巢上皮癌进展之间关系研究较少。近年研究表明,与肥胖状态、糖脂代谢密切相关的内脂素-Nampt轴与恶性肿瘤如食管胃交界部腺癌等的发生进展关系紧密[10],但其与卵巢上皮癌之间关系相关研究目前罕见。因此,研究内脂素-Nampt轴与卵巢上皮癌进展之间关系具有重要意义。
本研究结果显示,卵巢上皮癌患者血清内脂素浓度显著高于卵巢良性肿瘤患者及正常对照人群,因此血清内脂素对卵巢上皮癌术前诊断具有一定的价值,但其诊断价值小于经典肿瘤标志物如CA 125、HE4。卵巢上皮癌患者血清内脂素与CA 125呈正相关性(r=0.389),但与HE4无相关性。卵巢上皮癌患者血清内脂素与T、N、FIGO分期有关,且Ⅲ-Ⅳ期患者血清内脂素水平显著高于Ⅰ、Ⅱ期患者,但与患者年龄、BMI、肿瘤组织学类型、分化程度无明显相关。免疫组化染色结果显示,卵巢上皮癌组织Nampt阳性表达率显著高于正常卵巢组织(78.6%vs.40.0%,P<0.05)。卵巢上皮癌Nampt表达与FIGO分期、患者血清内脂素水平有关且与患者血清内脂素呈正相关性(r s=0.55),但与患者年龄、肿瘤组织学类型、分化程度、T、N分期、BMI无关。生存分析显示,T、N、FIGO分期、血清内脂素水平、肿瘤细胞Nampt表达显著影响卵巢上皮癌患者预后,且FIGO分期、肿瘤细胞Nampt表达是患者预后的独立影响因素(P<0.05)。本研究中因黏液性癌(8例)、子宫内膜样癌(2例)、透明细胞癌(2例)这三种组织学类型病例数少,统计分析时整合至非浆液性癌组;另外,在分析肿瘤分化程度时,透明细胞癌因其特殊性,未列出分化程度,故统计分析时已筛除;而肿瘤M分期因M 1病例数仅2例,未进行M分期对肿瘤组织Nampt、患者预后影响的分析。
内脂素作为细胞因子,不仅由脂肪细胞、前B淋巴细胞产生,还在大多数细胞系的体外培养基中已被检测到,这些细胞类型包括癌细胞如肝癌、结直肠癌、乳腺癌、黑素瘤、前列腺癌、宫颈癌细胞等与非肿瘤细胞如内皮细胞等[3,5]。内脂素可促进乳腺癌和前列腺癌在内的多种恶性肿瘤扩散与转移[11-13];血清内脂素浓度还与恶性星形细胞瘤、胃癌、结直肠癌等肿瘤进展相关[3]。本研究也证实了卵巢上皮癌与内脂素之间的密切关系,且Ⅲ-Ⅳ期患者血清内脂素水平显著高于Ⅰ、Ⅱ期患者。细胞内Nampt高表达与食管胃交界部腺癌、乳腺癌、胃癌、尿路上皮癌等多种恶性肿瘤进展密切相关[10,14]。本研究也发现Nampt在卵巢上皮癌组织中呈过表达状态且与肿瘤分期有关,并与患者血清内脂素水平呈正相关性,这提示内脂素-Nampt轴在卵巢上皮癌中存在。本研究可能受限于研究样本量偏小,导致未能发现BMI与血清内脂素、组织Nampt表达量之间相关性,因而未能发现肥胖因素对卵巢上皮癌中内脂素-Nampt轴的影响,但内脂素与肥胖程度关系密切,其在肥胖人群血清中显著升高,因此肥胖仍可能通过分泌内脂素作用于卵巢上皮癌以及内脂素-Nampt轴信号通路。卵巢上皮癌患者血清存在高水平内脂素,这内脂素进而通过某种信号通路调控细胞内Nampt表达;和(或)通过其类似细胞内Nampt酶活性,进而调控细胞内NAD的补救合成,甚至影响细胞内基因的不稳定性[15]。因此,需要进一步的研究来确定内脂素如何改变肿瘤细胞内Nampt的表达。

