基于数据挖掘和网络药理学探讨肺癌化疗后骨髓抑制的用药规律及作用机制
王璐瑶 张培彤 林月洁 罗钺 黄蓉 王菁

〔摘要〕 目的 探究中药防治肺癌化疗后骨髓抑制的用药规律及核心药物潜在作用机制。方法 檢索中国知网、万方、维普数据库自建库以来关于中药防治肺癌化疗后骨髓抑制的文献,运用IBM SPSS Statistics 24.0、IBM SPSS Modeler 18.0软件进行数据挖掘,总结用药规律,筛选核心药对,利用网络药理学方法分析其潜在作用机制。结果 (1)共纳入62篇文献,包含62个处方、153味中药;(2)使用频次最高的10味中药依次是黄芪、白术、甘草、当归、茯苓、党参、熟地黄、白芍、女贞子、鸡血藤,以补虚药为主,补气药最多,补血药次之,主要归于脾、肺、肾三经,以甘、苦、辛味居多,药性多温、平;(3)筛选得到核心药对为“黄芪-白术”,其主要通过槲皮素、山柰酚、芒柄花素、异鼠李素等成分作用于PTGS2、NOS3、MAPK14、RELA、GSK3B等疾病靶点,调控PI3K-Akt、MAPK、TNF、IL-17等信号通路刺激造血干细胞分化,发挥造血功能。结论 中药治疗肺癌化疗后骨髓抑制以补益脾肺为核心,以补气、补血为主,药物通过多成分、多靶点、多通道对化疗后骨髓抑制发挥作用。
〔关键词〕 肺癌;化疗;骨髓抑制;中药;数据挖掘;网络药理学;用药规律
〔中图分类号〕R273 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.03.013
〔Abstract〕 Objective To explore the regularity and potential mechanism of core drugs of Chinese medicine in the prevention and treatment of bone marrow suppression after chemotherapy of lung cancer. Methods The literatures on Chinese medicine for prevention and treatment of bone marrow suppression after chemotherapy of lung cancer since the establishment of CNKI, Wanfang and Weipu databases were searched, IBM SPSS Statistics 24.0 and IBM SPSS Modeler 18.0 were used for data mining, medication rule was summarized, and core drug pairs were screened. Network pharmacology method was used to analyze its potential mechanism of action. Results (1) A total of 62 literatures were included, including 62 prescriptions and 153 traditional Chinese medicines; (2) The 10 most frequently used Chinese medicines were Huangqi (Astragali Radix), Baizhu (Atractylodis Macrocephalae Rhizoma), Gancao (Glycyrrhizae Radix Et Rhizoma), Danggui (Angelicae Sinensis Radix), Fuling (Poria), Dangshen (Codonopsis Radix), Shudihuang (Rehmanniae Radix Praeparata), Baishao (Paeoniae Radix Alba), Nvzhenzi (Ligustri Lucidi Fructus), Jixueteng (Spatholobi Caulis). Tonic drugs were the main ones, the Qi-tonifying drugs were the most, and the blood-tonifying drugs were the second, and they were mainly attributed to the three meridians of the spleen, lung and kidney. They were mostly sweet, bitter and pungent. The property was mainly temperature and flat. (3) The core drug pair selected as “Huangqi (Astragali Radix)-Baizhu (Atractylodis acrocephalae Rhizoma)”, mainly through quercetin, kaempferol, formononetin, isorhamnetin and other ingredients to act on PTGS2, NOS3, MAPK14, RELA, GSK3B and other disease targets, regulate PI3K-Akt, MAPK, TNF, IL-17 signaling pathway and other pathways to stimulate hematopoietic stem cell differentiation and perform hematopoietic function. Conclusion The treatment of bone marrow suppression after chemotherapy of lung cancer with traditional Chinese medicine focus on tonifying the spleen and lung, mainly tonifying Qi and blood. The drugs play a role in treating bone marrow suppression after chemotherapy through multi-component, multi-target and multi-channel.
〔Keywords〕 lung cancer; chemotherapy; bone marrow suppression; traditional Chinese medicine; data mining; network pharmacology; medication rules
肺癌是我国最常见的癌症类型,也是癌症死亡的主要原因[1]。现代医学对肺癌的治疗手段主要包括手术、化疗、放疗、免疫治疗、靶向治疗等,其中化疗是治疗中晚期肺癌的主要方法之一,而骨髓抑制是化疗最常见的不良反应,也是导致化疗中断的主要原因之一,以外周血中白细胞、血小板、红细胞计数降低为主要表现[2]。临床研究证明,化疗联合中药可以有效防治化疗导致的骨髓抑制等不良反应[3-4],一方面能减少骨髓抑制的发生,另一方面可以减轻骨髓抑制的严重程度,加快骨髓功能的恢复。然而众多医家运用中药防治骨髓抑制的理法方药不尽相同,用药规律尚不十分明确。利用频数分析、关联规则分析方法,挖掘既往发表相关文献的方药配伍规律以及用药经验,再利用网络药理学方法探究核心药对治疗骨髓抑制的潜在机制,以期为临床防治肺癌化疗后骨髓抑制提供借鉴。
1 资料与方法
1.1 处方来源
以“肺癌”“化疗”“骨髓抑制”“中医”“中药”为检索词组合,检索中国期刊全文数据库、万方数据库、维普数据库自建库以来至2021年1月25日收录的文献。
1.2 纳排标准
1.2.1 纳入标准 (1)中药联合化疗治疗肺癌的随机对照临床研究文献,研究对象为病理诊断明确的肺癌患者,且治疗组样本量≥20例;(2)治疗组采用内服中药复方(包含汤剂、颗粒剂、散剂、丸剂)联合化疗治疗,对照组采用与治疗组一致的化疗方案治疗;(3)疗效评价指标:治疗组骨髓抑制发生率及白细胞、血红蛋白、血小板数量下降程度均小于对照组(P<0.05)。
1.2.2 排除标准 (1)中药组成不明确的文献;(2)患者同时接受靶向治疗或免疫治疗的文献;(3)重复发表的所载复方相同的文献只取其中1篇。
1.3 数据筛选
按检索规则共检索到583篇初始文献,导入至NoteExpress去除重复文献,再通过人工筛选,最终按纳排标准纳入62篇文献。
1.4 药名规范
以《中华人民共和国药典》[5]为标准,参考《中药学》[6]《中药大辞典》[7],对录入的中药名称、性味、归经进行标准化处理。如:“生晒参”“人参须”规范为“人参”,“芍药”规范为“白芍”,“龟板”规范为“龟甲”,“旱莲草”规范为“墨旱莲”;若药物名称含有产地名称则规范为通用药名,如:“潞党参”规范为“党参”,“川牛膝”规范为“牛膝”等。
1.5 统计学分析
将数据录入Excel表格,采用二分类变量数据转换方法处理,文献中出现的中药记为“1”,未出现记为“0”,完成后再次进行数据核对,确保完整性和准确性,导入IBM SPSS Statistics 24.0、IBM SPSS Modeler 18.0进行数据统计分析,再根据关联规则分析筛选出核心药对。
1.6 机制研究
通过网络药理学方法探究核心药对治疗骨髓抑制的潜在机制,利用TCMSP数据库筛选核心药对的有效成分(OB≥30%、DL≥0.18)及潜在靶点,利用GeneCards数据库筛选骨髓抑制“myelosuppression”“bone marrow suppression”疾病靶点,通过BioVenn在线软件将药物靶点与疾病靶点进行映射,获得共同靶点;利用Metascape数据库进行KEGG通路富集分析,使用微生信在线工具对分析结果进行可视化;通过Cytoscape软件构建“药物-有效成分-作用靶点-信号通路”网络,筛选核心药对治疗骨髓抑制的主要成分、关键靶点及重要信号通路。
2 结果
2.1 药物频次、功效分类
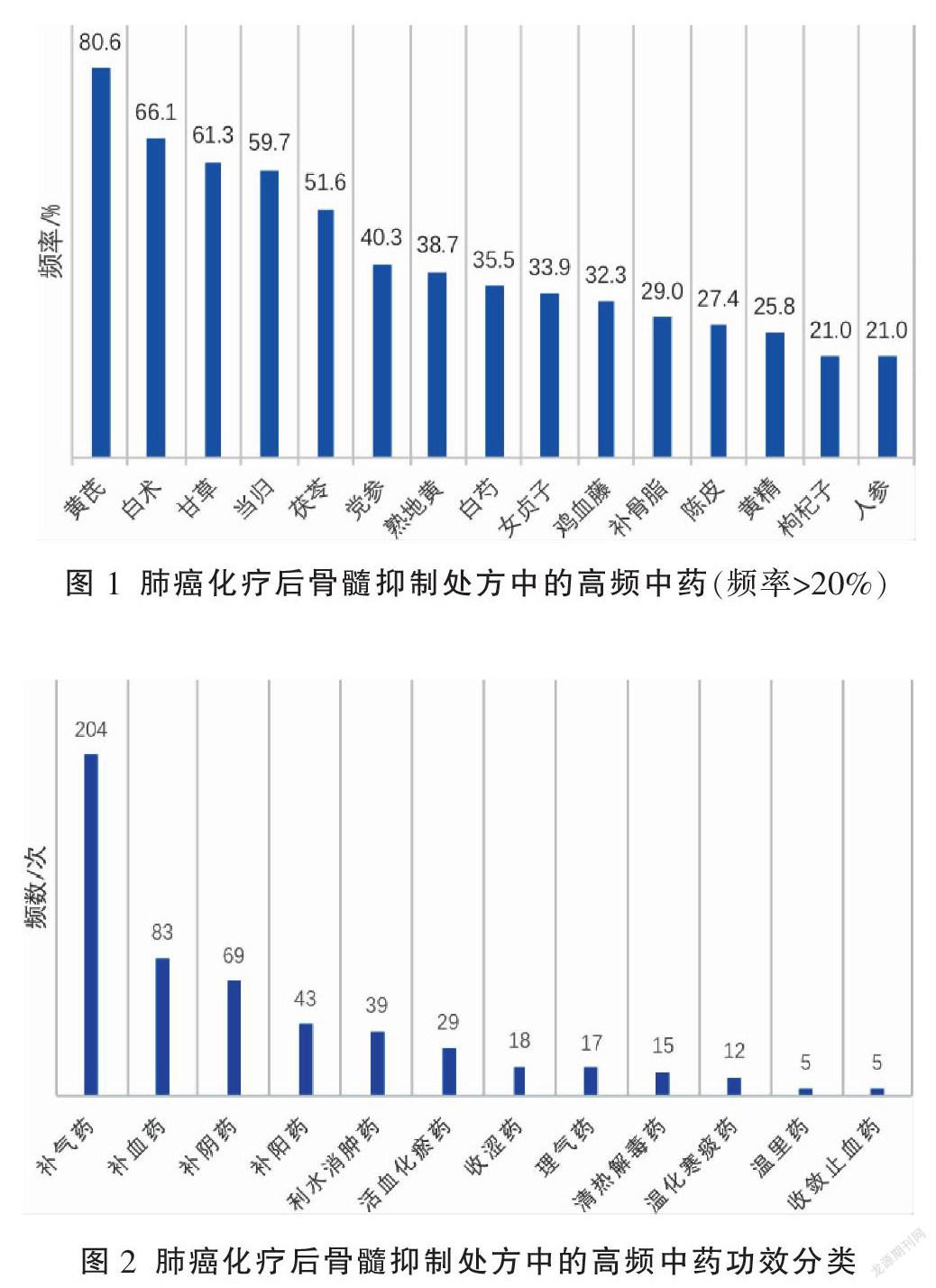
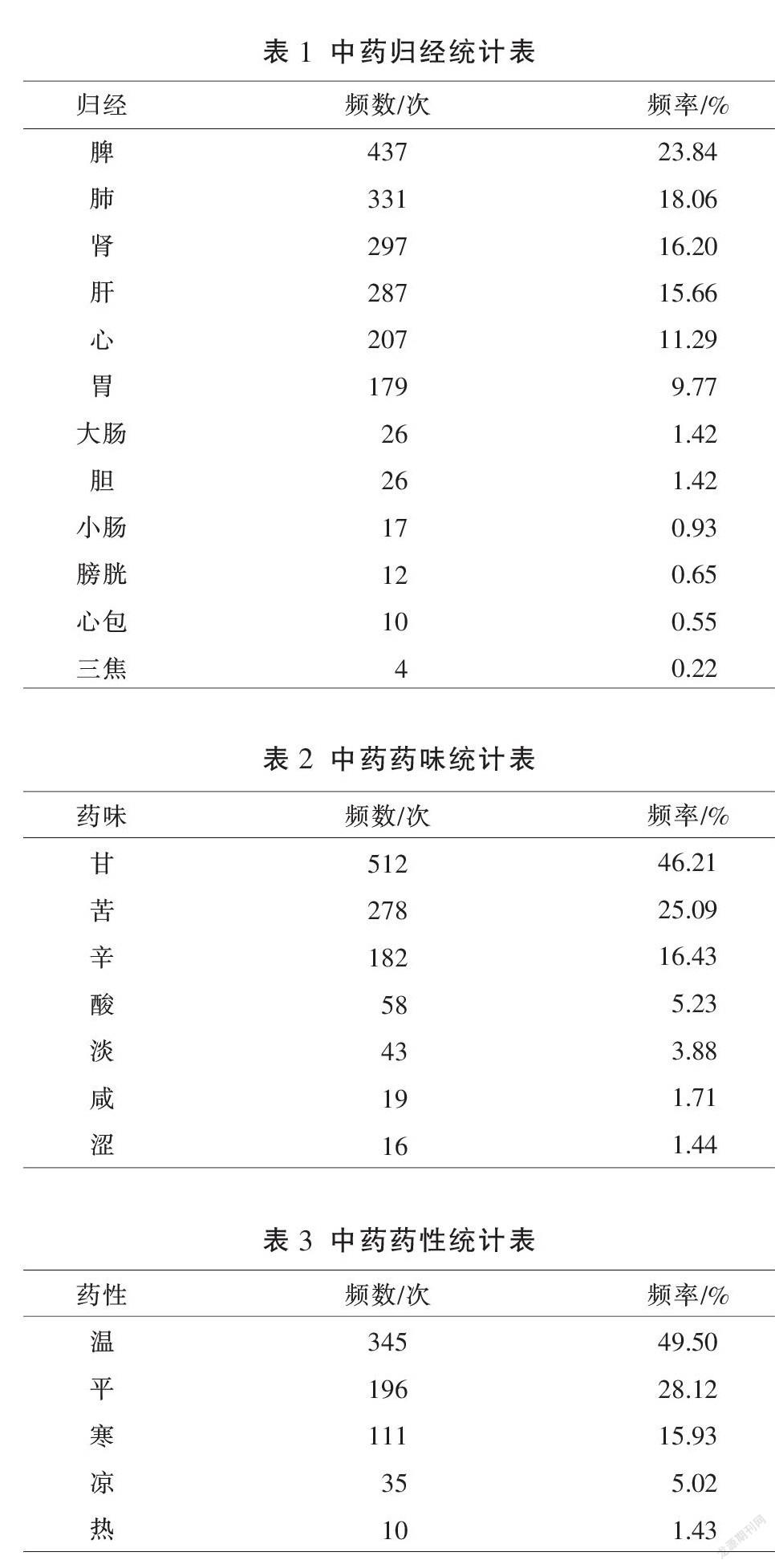
62篇文献共含153味中药,用药总频数达695次,其中使用频率大于20%的中药有15味,分别为黄芪、白术、甘草、当归、茯苓、党参、熟地黄、白芍、女贞子、鸡血藤、补骨脂、陈皮、黄精、枸杞子、人参,详见图1。其中用药频数在5次以上者34種(占总频数的77.55%),按《中药学》[6]中药功效分类标准对使用频数≥5次的中药进行分类,用药总频数最高的是补虚药,其中补气药最多,补血药次之,详见图2。
2.2 药物归经、药味、药性分析
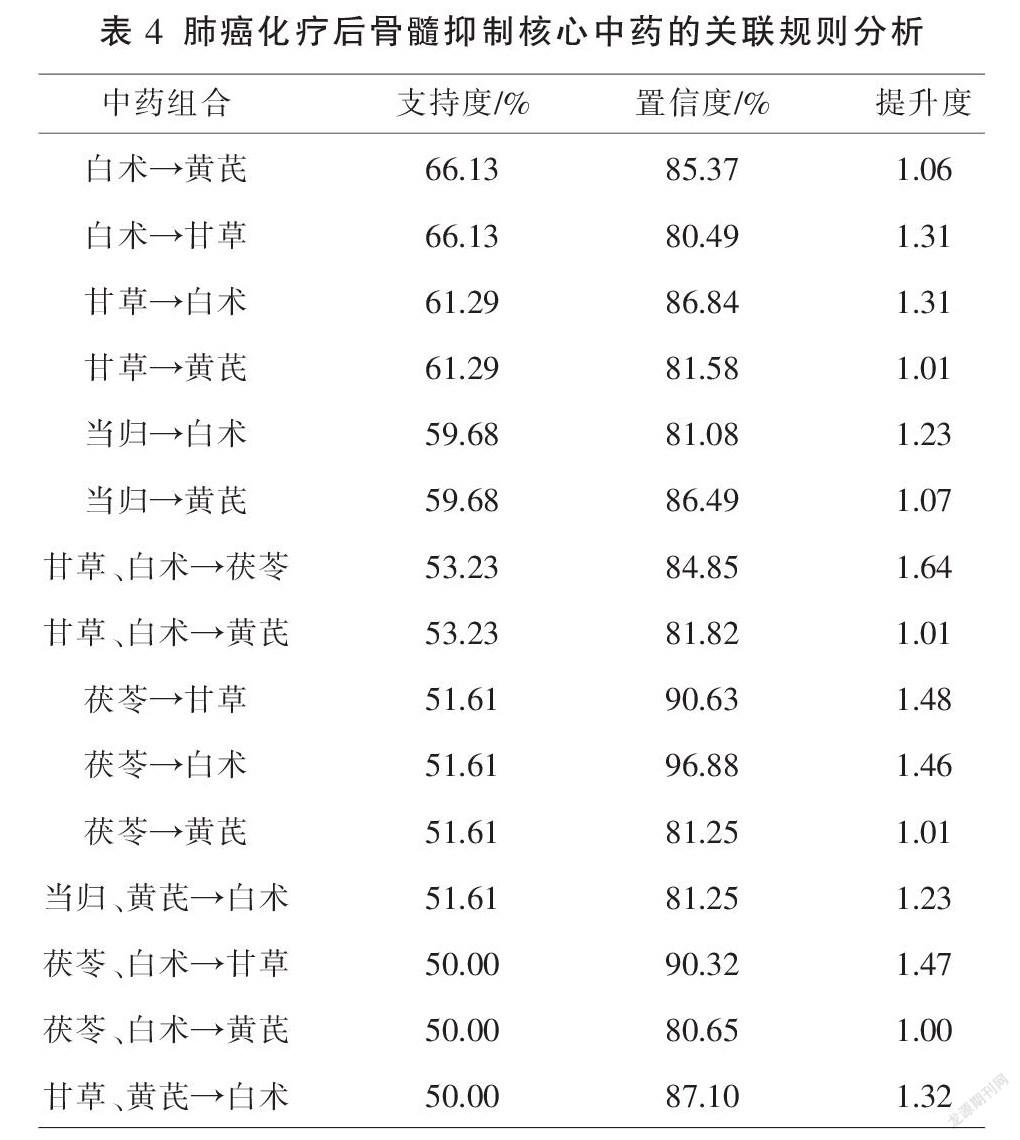
对文献中153味中药进行归经、药味、药性统计分析,若同一中药具有不同归经、药味,则分别统计。归经频次降序排列依次为脾经、肺经、肾经、肝经、心经等;药味以甘味、苦味、辛味居多;药性以温性、平性为主。见表1-3。
2.3 核心中药关联规则分析
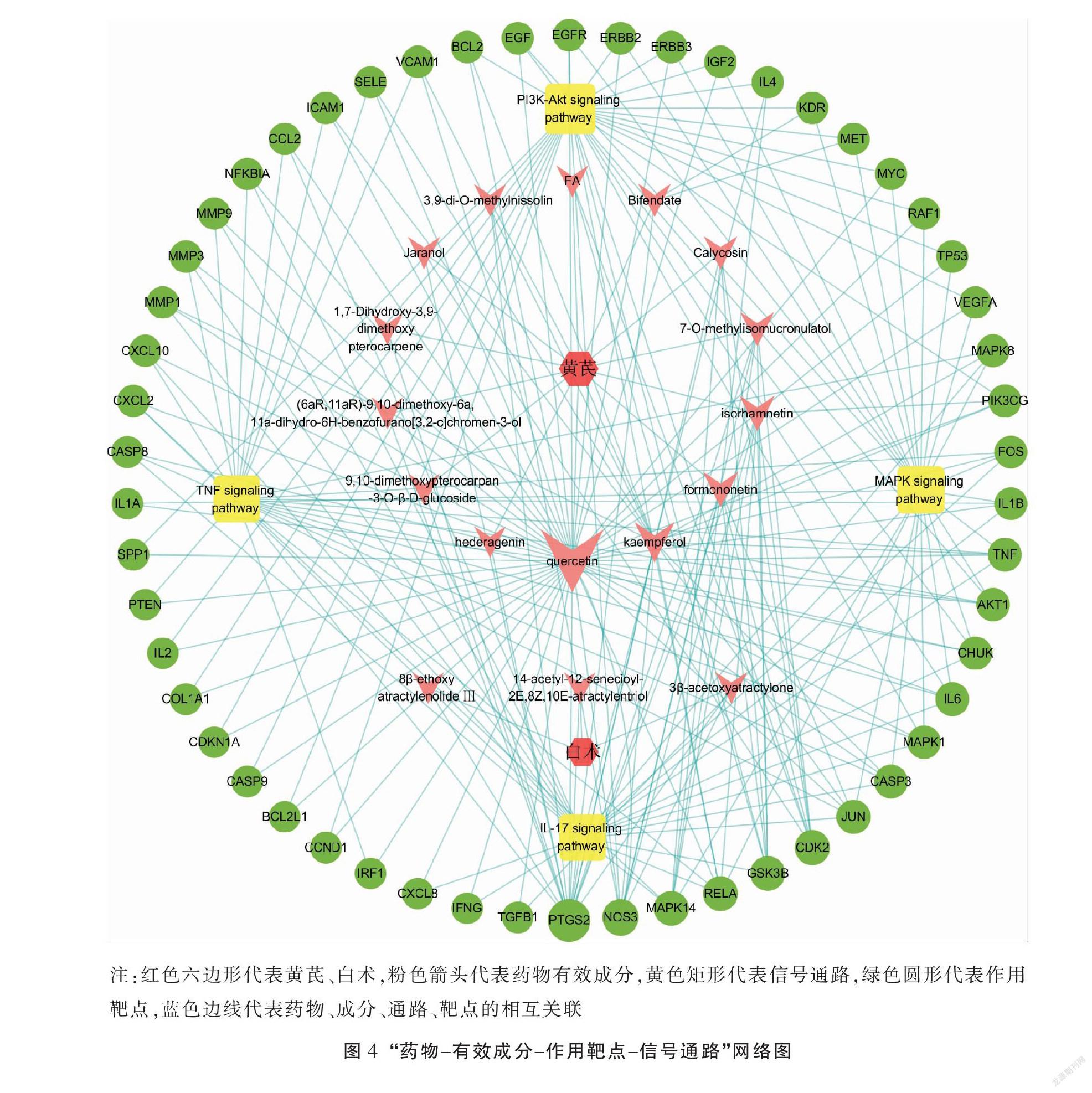
使用IBM SPSS Modeler 18.0中的Apriori算法挖掘防治肺癌化疗后骨髓抑制的核心中药(频数前20位)配伍关系,设定最低支持度为50%,最小置信度为80%,最大前项数为2,提升度≥1,按支持度降序排列,共得到15个常用药对,详见表4。其中支持度最高的药对是白术→黄芪和白术→甘草,前者置信度更高,且数据挖掘结果显示,黄芪、白术为防治肺癌化疗后骨髓抑制处方中使用频率最高的两味中药,故以“黄芪-白术”作为核心药对进行更深入的研究。
2.4 基于网络药理学的作用机制研究
通过数据挖掘筛选出“黄芪-白术”为中药防治肺癌化疗后骨髓抑制的核心药对,利用TCMSP数据库筛选得到“黄芪-白术”27个活性成分、202个潜在作用靶点,通过GeneCards数据库筛选得到780个疾病靶点,两者取交集得到98个药物与疾病的交集靶点。KEGG通路富集分析显示交集靶点主要涉及384条信号通路,对前20条信号通路进行可视化(图3),去除广泛通路,筛选得到4条与骨髓抑制密切相关的信号通路,分别是PI3K-Akt、MAPK、TNF、IL-17信号通路。运用Cytoscape软件构建“药物-有效成分-作用靶点-信号通路”网络(图4),计算degree值,根据degree值筛选出“黄芪-白术”治疗骨髓抑制的主要成分是quercetin(槲皮素)、kaempferol(山柰酚)、formononetin(芒柄花素)、isorhamnetin(异鼠李素)等,主要作用于PTGS2、NOS3、MAPK14、RELA、GSK3B等疾病靶点,调控PI3K-Akt、MAPK、TNF、IL-17等信号通路。
3 讨论
通过对纳入文献中153味中药的统计分析,筛选出使用频率最高的10味中药依次是黄芪、白术、甘草、当归、茯苓、党参、熟地黄、白芍、女贞子、鸡血藤,用药总频数最高的是补虚药,其中补气药最多,补血药次之,辅以利水消肿药、活血化瘀药、收涩药、理气药、清热解毒药、温化寒痰药等。中医认为正虚邪实是肺癌发病的基本病机,正虚有气、血、阴、阳之虚,邪实有痰、瘀、毒之实[8]。化疗药物在杀伤肿瘤细胞的同时,对人体正常细胞也造成一定损害,使正气虚损更甚。正如《诸病源候论·虚劳病诸候》所言:“虚劳则脏腑不和,脾胃气弱……虚劳之人,精髓萎竭,血气虚弱,阴阳俱虚……”,众多医家均认同化疗所致骨髓抑制的病因病机以虚证为主,以“精髓萎竭,血气虚弱,阴阳俱虚”的理论最有代表性,多以益气养血、健脾益肾、滋阴温阳治法为主[9],这与本研究结果基本相符。现代药理研究表明,黄芪、白术、甘草、党参等补虚类中药可提高机体的免疫功能,具有抗肿瘤作用,并能改善骨髓抑制状态,提高化疗疗效,达到扶正祛邪的作用[10-13]。根据中药归经、药味、药性统计分析,中药归经涉及脾经、肺经、肾经、肝经、心经、胃经、大肠经、胆经等,主要以脾经、肺经、肾经为主。脾为后天之本、气血生化之源,肺为气之本、主一身之气,肾为先天之本、主骨生髓,故中药主要归于脾、肺、肾三经,补益脾、肺、肾三脏。化疗药物对机体各器官均可造成不同程度的损害,而中药具有多成分、多靶点、多通路的特点,能发挥整体调节的作用。药味以甘味、苦味、辛味居多,甘味能补益和中、调和药性,苦味能清泄火热、燥湿坚阴,辛味能发散、行气、行血,攻补兼施,以补为主。化疗药物药性峻烈,骨髓抑制病机复杂,以虚证为主,中药当以温、平为主,忌大热、大寒。
通过关联规则分析,筛选出15个常用药对,其中“黄芪-白术”药对的支持度和置信度均较高。研究证明,黄芪甲苷、毛蕊异黄酮通过促进p-JAK2、p-STAT5蛋白表达,下调SOCS3 mRNA表达,能促进化疗后骨髓抑制的修复[14];黄芪多糖则通过下调PTEN mRNA的表达,减少对PI3K-Akt信号通路的抑制,从而促进骨髓干细胞增殖[15]。白术主要通过增强免疫功能来提高白细胞水平,使Th细胞明显增加,纠正T细胞亚群分布状态,使IL-2水平显著提高[16]。目前缺乏对“黄芪-白术”药对治疗骨髓抑制的机制研究,故有必要通过网络药理学方法探究其潜在作用机制,为临床应用和后续研究提供一定参考。
网络药理学研究结果显示,“黄芪-白术”主要通过槲皮素、山柰酚、芒柄花素、异鼠李素等成分发挥治疗骨髓抑制的作用。槲皮素、山柰酚、芒柄花素、异鼠李素都是黄酮类化合物,具有广泛的抗肿瘤、抗氧化、保护血管内皮细胞、保护神经、保护骨骼等药理作用[17]。研究发现,槲皮素可以通过调控PI3K/Akt信号通路来调节促红细胞生成素依赖性红细胞的早期发育,从而参与调节造血功能[18],可以防止依托泊苷引起髓样前体和有核红细胞百分比的降低,被认为是依托泊苷化疗期间骨髓细胞的一种保护性化合物[19]。芒柄花素可以通过诱导促红细胞生成素的表达来增强造血功能,缓解由环磷酰胺引起的贫血症状,改善红细胞、白细胞、血红蛋白等水平[20]。山柰酚和异鼠李素均能调节PI3K/Akt、MAPK等信号通路,发挥抗肿瘤、抗炎、抗氧化等药理作用[21-22],本研究推测二者可能具有改善骨髓抑制的作用,但目前相关研究较少,值得进一步探索。PTGS2、NOS3、MAPK14、RELA等靶点是“黄芪-白术”治疗骨髓抑制的主要预测靶点。研究表明,PTGS2对造血系统的稳态和血细胞的成熟是必不可少的,它能促进巨核细胞成熟和促血小板生成[23]。NOS3在干细胞和祖细胞的活化过程中发挥重要的作用,NOS3产生的NO可作为细胞生长因子调节干细胞和祖细胞动员,缺乏NOS3将导致干细胞和祖细胞动员减少,引起骨髓抑制[24]。MAPK14表达异常可导致机体生理功能紊乱,引发机体免疫功能失调,MAPK14蛋白活化后可激活p38MAPK通路,導致疾病发生[25]。RELA作为NF-κB家族中重要成员之一,不仅能促进细胞增殖,还能调控间充质干细胞分化[26],而间充质干细胞能分泌多种促进造血干细胞增殖并抑制其分化的细胞因子,在维持造血微环境及调控造血干细胞功能中发挥着重要的作用[27]。PI3K-Akt、MAPK、TNF、IL-17等信号通路均参与细胞增殖、分化和凋亡等生命过程,也在造血调节系统中发挥重要作用。PI3K-Akt信号通路在维持造血干细胞自我更新和定向分化过程中扮演着重要的角色,过度激活该通路会造成造血干细胞的耗竭,而过度抑制则会导致B细胞的分化受到显著的抑制[28]。MAPK信号通路在维持造血系统稳态中发挥着重要作用,MAPK家族主要包括ERK、JNK、p38MAPK三大类,ERK通路负责控制造血祖细胞的扩增、存活和分化之间的平衡,JNK通路和p38MAPK通路参与红细胞生成和骨髓生成的调节[29]。
本研究通过对防治肺癌化疗后骨髓抑制的中药进行数据挖掘,总结出用药规律,主要以补虚药为主,其中补气药最多、补血药次之,主要涉及脾、肺、肾三脏,药味以甘味、苦味、辛味居多,药性以温性、平性为主。通过关联规则分析得到核心药对“黄芪-白术”,利用网络药理学方法预测其发挥治疗骨髓抑制作用的主要成分为槲皮素、山柰酚、芒柄花素、异鼠李素等,作用于PTGS2、NOS3、MAPK14、RELA等靶点,调控PI3K-Akt、MAPK、TNF、IL-17等信号通路。但本研究挖掘的文献数量有限,可能对研究结果造成影响;网络药理学方法存在局限性,主要用于预测分析,研究结论仍需通过实验进一步验证。
参考文献
[1] WILD C P, WEIDERPASS E, STEWART B W. World Cancer Report: Cancer research for cancer prevention[M]. Lyon: International Agency for Research on Cancer, 2020.
[2] HU W Y, SUNG T, JESSEN B A, et al. Mechanistic investigation of bone marrow suppression associated with palbociclib and its differentiation from cytotoxic chemotherapies[J]. Clinical Cancer Research, 2016, 22(8): 2000-2008.
[3] WU Y H, CHEN H Y, LAI C H, et al. Use of Chinese herbal medicine improves chemotherapy-induced thrombocytopenia among gynecological cancer patients: An observational study[J]. Evidence-Based Complementary and Alternative Medicine, 2018, 2018: 1-8.
[4] JIA Y J, DU H H, YAO M, et al. Chinese herbal medicine for myelosuppression induced by chemotherapy or radiotherapy: A systematic review of randomized controlled trials[J]. Evidence-Based Complementary and Alternative Medicine, 2015, 2015: 1-12.
[5] 国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2020.
[6] 钟赣生.中药学[M].北京:中国中医药出版社,2013.
[7] 南京中医药大学.中药大辞典[M].2版.上海:上海科学技术出版社,2006.
[8] 陈滨海,张光霁.肺癌的“痰毒瘀”微观模型初探[J].中华中医药杂志,2019,34(1):50-54.
[9] 苏 轲,司文涛,侯爱画.中医治疗化疗所致骨髓抑制的研究进展[J].中医肿瘤学杂志,2020,2(5):73,87-91.
[10] 巩雅宁,王 帅, 張 静,等.黄芪多糖对老年肺癌患者化疗期间骨髓抑制的改善作用及造血干细胞的影响[J].海南医学院学报, 2020,26(19):1468-1473.
[11] 杨 颖,魏梦昕,伍耀业,等.白术多糖提取分离、化学组成和药理作用的研究进展[J].中草药,2021,52(2):578-584.
[12] 石玉花,李瑞萍,陈小芸,等.异甘草素抗肿瘤作用及其机制研究进展[J].实用药物与临床,2020,23(4):371-375.
[13] 谢 琦,程雪梅,胡芳弟,等.党参化学成分、药理作用及质量控制研究进展[J].上海中医药杂志,2020,54(8):94-104.
[14] 崔运浩,初 杰,范 颖,等.黄芪甲苷、毛蕊异黄酮及其配伍对化疗性骨髓抑制小鼠骨髓干细胞JAK2/STAT5信号转导通路的影响[J].中华中医药学刊,2016,34(7):1576-1580.
[15] 崔运浩,初 杰,范 颖,等.当归多糖、黄芪多糖及其配伍对化疗性骨髓抑制小鼠骨髓干细胞增殖和PI3K/AKT信号转导通路的影响[J].中华中医药学刊,2019,37(6):1471-1478.
[16] 郭秋玲.健脾益肾方治疗化疗后白细胞减少症的临床研究[D]. 济南:山东中医药大学,2007.
[17] 张东霞.黄芪中黄酮类化合物药理作用研究进展[J].内蒙古中医药,2021,40(2):148-149.
[18] CHIANG C L, CHEN S S A, LEE S J, et al. Lysophosphatidic acid induces erythropoiesis through activating lysophosphatidic acid receptor 3[J]. Stem Cells, 2011, 29(11): 1763-1773.
[19] PAPIE M A. The effect of quercetin on oxidative DNA damage and myelosuppression induced by etoposide in bone marrow cells of rats[J]. Acta Biochimica Polonica, 2014, 61(1): 7-11.
[20] ZHANG L, GONG A G W, RIAZ K, et al. A novel combination of four flavonoids derived from Astragali Radix relieves the symptoms of cyclophosphamide-induced anemic rats[J]. FEBS Open Bio, 2017, 7(3): 318-323.
[21] 雷晓青,陈 鳌,刘 毅,等.山萘酚药理作用的研究进展[J].微量元素与健康研究,2017,34(2):61-62.
[22] GONG G, GUAN Y Y, ZHANG Z L, et al. Isorhamnetin: A review of pharmacological effects[J]. Biomedicine & Pharmacotherapy, 2020, 128: 110301.
[23] AMADIO P, ROCCA B, PESCE M, et al. Abnormal megakaryopoiesis and platelet function in cyclooxygenase-2-deficient mice[J]. Thrombosis and Haemostasis, 2015, 114(12): 1218-1229.
[24] AICHER A, HEESCHEN C, DIMMELER S. The role of NOS3 in stem cell mobilization[J]. Trends in Molecular Medicine, 2004, 10(9): 421-425.
[25] 邢译文,刘 鑫,周林林,等.miR-638慢病毒载体的构建及其对MAPK14的靶向调控作用[J].免疫学杂志,2014,30(9):782-786.
[26] YU S X, LI P, LI B J, et al. RelA promotes proliferation but inhibits osteogenic and chondrogenic differentiation of mesenchymal stem cells[J]. FEBS Letters, 2020, 594(9): 1368-1378.
[27] 汪姝玥,林凡莉,钱 怡,等.不同共培养模式下间充质干细胞对造血干细胞增殖的作用[J].中国组织工程研究,2018,22(13):2068-2074.
[28] 张英驰,程 涛,袁卫平.PI3K/AKT/mTOR信号通路在造血干细胞中作用的研究进展[J].中国实验血液学杂志,2013,21(1):245-249.
[29] GEEST C R, COFFER P J. MAPK signaling pathways in the regulation of hematopoiesis[J]. Journal of Leukocyte Biology, 2009, 86(2): 237-250.

