复方葶苈子汤改善COPD相关性肺动脉高压大鼠的肺血管重塑的机制研究
刘敏 王启芝 刘雨 柏正平



〔摘要〕 目的 探討复方葶苈子汤对慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)相关性肺动脉高压(pulmonary arterial hypertension, PAH)大鼠肺血管重塑的影响及机制。方法 将90只SD大鼠随机分为正常组、模型组、低剂量组、中剂量组、高剂量组和西药组。正常组大鼠正常喂养,其余组大鼠均采用烟熏加气管滴注脂多糖构建COPD-PAH大鼠模型。低剂量组、中剂量组、高剂量组予复方葶苈子汤(生药量分别为2.56、5.13、10.26 g/kg),西药组予辛伐他汀2.5 mg/kg,模型组予以等量0.9%生理盐水,给与相应药液(10 mL/kg),在实验第60天开始,每天灌胃1次,连续14 d。HE染色观察肺组织病理变化,Masson染色观察肺小动脉胶原沉积,免疫组化观察肺组织增殖指标增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)的变化,Western blot检测细胞焦亡通路NLRP3、Caspase-1、GSDMD、IL-1β、IL-18的蛋白水平。结果 与正常组相比,模型组出现典型的COPD-PAH病理变化,肺小动脉胶原沉积面积、PCNA表达及肺组织中NLRP3、Caspase-1、GSDMD、IL-1β、IL-18蛋白水平均增加(P<0.05);与模型组相比,中剂量组、高剂量组和西药组肺组织病理变化明显改善,肺小动脉胶原沉积面积、PCNA表达及肺组织中NLRP3、Caspase-1、GSDMD、IL-1β、IL-18蛋白水平均减少(P<0.05);与低剂量组相比,中剂量组、高剂量组和西药组肺组织病理变化明显改善,肺小动脉胶原沉积面积、PCNA表达均及肺组织中NLRP3、Caspase-1、GSDMD、IL-1β、IL-18蛋白水平均减少(P<0.05);与中剂量组相比,高剂量组肺组织病理变化明显改善,肺小动脉胶原沉积面积、PCNA表达及肺组织中NLRP3、Caspase-1、GSDMD、IL-1β、IL-18蛋白水平均减少(P<0.05)。结论 复方葶苈子汤可通过抑制NLRP3炎症小体介导的细胞焦亡,改善COPD-PAH大鼠的肺血管重塑,且随着复方葶苈子汤剂量的增加,COPD-PAH大鼠的肺血管重塑改善效果越明显。
〔关键词〕 复方葶苈子汤;NLRP3;细胞焦亡;肺血管重塑;慢性阻塞性肺疾病相关性肺动脉高压
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.03.006
〔Abstract〕 Objective To investigate the effects and mechanisms of Compound Tinglizi Decoction on pulmonary vascular remodeling in rats with chronic obstructive pulmonary disease (COPD)-pulmonary arterial hypertension (PAH). Methods Ninety SD rats were randomly divided into normal group, model group, low-dose group, middle-dose group, high-dose group and western medicine group. The rats in the normal group were fed normally, and the rats in the other groups were all used to construct the COPD-PAH rat model by smoke plus tracheal drip of lipopolysaccharide. The low-dose group, middle-dose group, and high-dose group were given Compound Tinglizi Decoction (the crude drug doses were 2.56, 5.13, and 10.26 g/kg, respectively), the western medicinegroup was given simvastatin 2.5 mg/kg, and the model group was given the same amount of 0.9% physiological saline administered, with the corresponding drug solution (10 mL/kg), and from the 60th day of the experiment, the rats were given intragastrical once a day for 14 consecutive days. Histopathological changes in the lungs of rats in each group were observed by HE staining. Collagen deposition in small pulmonary arteries was observed by Masson staining. Changes in proliferation indicators proliferating cell nuclear antigen (PCNA) in lung tissue were observed by immunohistochemistry. Protein levels of NLRP3, Caspase-1, GSDMD, IL-1β, IL-18 in pyroapoptotic pathways were measured by Western blot. Results Compared with the normal group, the model group had typical pathological changes of COPD-PAH, and the collagen deposition area of pulmonary arterioles, the expression of PCNA and the protein levels of NLRP3, Caspase-1, GSDMD, IL-1β and IL-18 in the lung tissue were increased (P<0.05). Compared with the model group, the pathological changes of lung tissue in the middle-dose group, high-dose group and western medicine group were significantly improved, the collagen deposition area of pulmonary arterioles, the expression of PCNA, and the protein levels of NLRP3, Caspase-1, GSDMD, IL-1β, and IL-18 in lung tissue were reduced (P<0.05). Compared with the low-dose group, the pathological changes of lung tissue in the middle-dose group, high-dose group and western medicine group were significantly improved, the collagen deposition area of pulmonary arterioles, the expression of PCNA and the protein levels of NLRP3, Caspase-1, GSDMD, IL-1β, IL-18 were reduced (P<0.05). Compared with the middle-dose group, the pathological changes of lung tissue in the high-dose group were significantly improved, and the collagen deposition area of pulmonary arterioles, the expression of PCNA and the protein levels of NLRP3, Caspase-1, GSDMD, IL-1β and IL-18 in the lung tissue were all decreased (P<0.05). Conclusion Compound Tinglizi Decoction can improve pulmonary vascular remodeling in rats with COPD-PAH through inhibiting NLRP3 inflammatory vesicle-mediated pyroptosis, and with the increase of the dose of Compound Tinglizi Decoction, the improvement effect of pulmonary vascular remodeling in COPD-PAH rats is more obvious.
〔Keywords〕 Compound Tinglizi Decoction; NLRP3; pyroptosis; pulmonary vascular remodeling; chronic obstructive pulmonary disease-associated pulmonary hypertension
肺動脉高压(pulmonary arterial hypertension, PAH)是慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)的一种常见和重要的并发症[1],肺血管重塑是PAH的重要标志[2]。研究认为,慢性炎症在COPD的气道重塑、气流阻塞和PAH过程中起着重要作用[3]。激活的Caspase-1可以诱发一种炎症形式的程序性细胞坏死,即细胞焦亡,其特征是大量促炎症因子释放和炎症级联反应[4]。NLRP3炎症小体是目前研究最深入的一种炎症小体,它可通过活化Caspase-1介导细胞焦亡[5]。且研究证实,NLRP3炎症小体参与了COPD及PAH气道和血管的慢性炎症[6-7]。因此,推测NLRP3炎症小体介导的细胞焦亡可能参与了COPD-PAH的肺血管重塑。
目前,许多中药复方用于治疗COPD,如丰白散[8]、参芪补肺散[9]、桑梅止咳颗粒[10]等,均具有一定疗效。研究发现,活血化瘀中药有效成分通过抑制NLRP3炎症小体通路参与多种疾病治疗[11-13]。本课题组长期从事采用中药复方治疗呼吸系统疾病的临床工作,如本课题前期研究发现,麻葶舒喘汤可通过缓解哮喘气道黏液高分泌症状,有效治疗哮喘[14]。本课题柏正平教授根据多年临床经验及COPD-PAH中医病机原理,根据“饮瘀同治”的治则创立了复方葶苈子汤。研究显示复方葶苈子汤可明显改善COPD-PAH患者临床症状及减少急性发病次数,动物实验证实可降低PAH,改善肺血管重塑[15-17]。由此,推测复方葶苈子汤可能通过抑制NLRP3炎症小体介导的细胞焦亡改善COPD-PAH肺血管重塑。
本次研究通过构建COPD-PAH大鼠模型,观察COPD-PAH大鼠肺组织中细胞焦亡的情况,探究复方葶苈子汤改善COPD-PAH肺血管重塑的作用机制,现将实验方法及结果报道如下。
1 材料
1.1 动物
清洁级健康雄性SD大鼠90只,鼠龄10~12周,体质量(200±20) g,由湖南斯莱克景达实验动物有限公司提供,许可证号:SYXK(湘)2019-0017。实验地点:湖南中医药研究所,本实验经湖南中医药大学动物伦理委员会批准(备案编号:2020-0092),符合实验动物福利与伦理原则。
1.2 药物制备
复方葶苈子汤组成:葶苈子15 g,黄芩10 g,桃仁10 g,红花10 g,水蛭6 g,川芎15 g,茯苓15 g,桂枝15 g,白术15 g,矮地茶15 g,甘草6 g。中药材购自湖南省中医药研究院附属医院中药房,经湖南省中医药研究院附属医院药剂科田其学教授鉴定为道地药材。按生药量加入10倍水,煎煮1 h保存药液;药渣再加入8倍量水,煎煮1 h,过滤去沉淀,合并滤液蒸干,制备成浸膏干粉,临用前用蒸馏水配成所需浓度。
1.3 主要试剂和仪器
辛伐他汀(上海信谊万象药业股份有限公司,批号:H19980174);黄果树牌香烟(贵州中烟工业有限责任公司,批号:6901028102353);Masson染色试剂盒(美国Wellbio公司,批号:WB00231A);增殖细胞核抗原(proliferating cell nuclear antigen,PCNA,批号:ab92552)、IgG(批号:pv9000)、NLRP3(批号:ab263899)、GSDMD(批号ab219800)、IL-1β(批号:ab205924)、IL-18(批号:ab191860)均购自美国Abcam公司;Caspase-1(批号:22915-1-AP)、β-actin(批号:60008-1-Ig)均购自美国Proteintech公司;总 RNA 提取 TRIZOL 试剂盒(美国Thermo公司,批号:15596026)。化学发光成像系统(广州勤翔光电科技有限公司,型号:Chemiscope6100);显微镜(型号:BA210T)、光学显微镜(型号:BA410T)均购自德国Motic公司。
2 方法
2.1 分组
将90只SD大鼠随机分为正常组、模型组、低剂量组、中剂量组、高剂量组和西药组,每组15只。
2.2 模型制备与干预
除正常组外,其余组别均参照舒家泽等[18]采用烟熏加气管滴注脂多糖方法建立COPD-PAH大鼠模型,通过肺功能检测、超声心动图及肺组织病理切片判定建模是否成功。肺功能残气量、吸气阻力、右心室平均压及右心室肥厚指数增加,肺组织病理切片可观察到炎症细胞浸润,气管壁和肺细小血管壁平滑肌增厚等,则表明建模成功[18]。于第1、30天大鼠麻醉后气管内滴脂多糖;然后将大鼠放入自制熏烟箱内经大鼠口鼻吸入,第2~29天、第31~59天香烟烟熏,1 h/次,2次/d。参考人和动物体表面积折算的等效剂量比率表,大鼠的等效剂量相当于人的6.3 倍。每只动物每千克体质量给药量按临床人(70 kg)的等效量为中剂量,0.5倍等效量为低剂量,2倍等效量为高剂量,故低剂量组、中剂量组、高剂量组生药量分别为2.56、5.13、10.26 g/kg,西药组辛伐他汀予2.5 mg/kg,在实验第60天开始,每天灌胃1次,给与相应药液(10 mL/kg),正常组不予以任何处理,模型组予以等量0.9%生理盐水,连续14 d。各组于末次给药后禁食8 h,次日处死大鼠,取血及肺组织进行相关指标检测。
2.3 标本制备
用10%水合氯醛(0.4 mL/100 g)麻醉大鼠,处死后,取右肺,浸入10%中性福尔马林固定液中固定,石蜡包埋,切片行HE染色、Masson染色、免疫组化检测,余肺组织迅速放入液氮罐中速冻用于Western blot检测。
2.4 指标检测
2.4.1 HE染色觀察肺组织病理变化 先将肺组织切片脱蜡至水,然后按照HE染色试剂盒说明书操作,在显微镜下观察拍照。选择视野主要观察非毛细血管、细支气管、肺泡等结构的形态,有无炎性细胞浸润等。
2.4.2 Masson染色观察肺小动脉胶原沉积 先将肺组织切片脱蜡至水,然后按照Masson染色试剂盒使用说明书依次加染液操作(苏木素染细胞核-丽春红染色-磷钼酸处理-苯胺蓝染色),然后用1%冰醋酸处理1 min,脱水、封片、显微镜下观察拍照。染色结果判读:肌纤维呈红色,胶原纤维呈绿色或蓝色,用ImageJ软件对染色结果进行分析。
2.4.3 免疫组化检测肺组织PCNA的表达 肺组织切片脱蜡至水,然后进行灭活,暴露抗原结合位点,蒸馏水冲洗3次。滴加稀释好的一抗(PCNA,1∶100),4 ℃过夜。PBS冲洗5 min×3次。滴加50~100 μL二抗,37 ℃,孵育30 min,PBS冲洗5 min×3次。滴加DAB显色,复染、脱水、透明、中性树胶封片。阳性染色为黄色或棕黄色或褐色,用ImageJ软件对染色结果进行分析。
2.4.4 Western blot检测肺组织NLRP3、Caspase-1、GSDMD、IL-1β、IL-18蛋白的表达 提取各组肺组织蛋白,根据BCA法蛋白含量检测试剂盒说明书测定蛋白浓度。10%、15%分离胶,4.8%的浓缩胶,每个泳道加入10 μL蛋白样品,SDS-PAGE恒压电泳、转膜,脱脂牛奶封闭,不同稀释比例的一抗(NLRP3为1∶1000;Caspase-1为1∶1000;GSDMD为1∶1000;IL-1β为1∶1000;IL-18为1∶2000),4 ℃,孵育过夜;稀释好的二抗与膜共同室温孵育90 min。ECL显色曝光,用ImageJ分析目标条带的灰度值。
2.5 统计学方法
采用SPSS 16.0软件分析数据。计量资料采用“x±s”描述,计量资料符合正态分布且方差齐时,两组间的比较采用t检验,两组以上的比较采用方差分析。P<0.05表示差异具有统计学意义。
3 结果
3.1 各组肺组织病理变化
正常组的肺组织内气道、肺泡壁及周围血管壁结构基本正常,血管壁光滑,管腔通畅,仅有少数炎性细胞浸润。模型组可见气道结构完整性遭到破坏,血管壁增厚,管腔缩小,肺泡内大量炎性细胞弥散性浸润。采用药物处理后,随着复方葶苈子汤药物浓度的增加,大鼠肺组织中血管壁变薄,炎性浸润减少。西药组采用辛伐他汀处理后,大鼠肺组织出现了与中剂量组、高剂量组肺组织相似的病理变化,即血管壁变薄,炎性浸润减少。见图1。
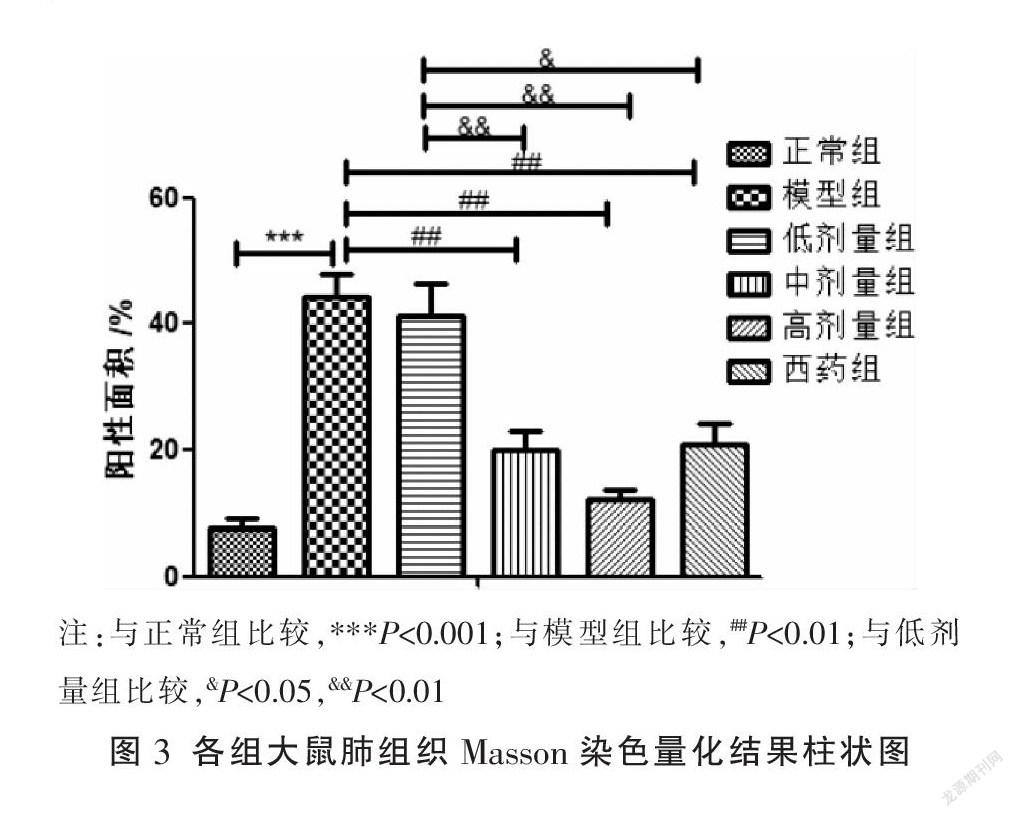
3.2 各组肺组织中肺小动脉胶原沉积面积的比较
与正常组相比,模型组阳性面积显著增加(P<0.05)。与模型组相比,低剂量组、中剂量组和高剂量组阳性面积均减少,除低剂量组与模型组阳性面积差异无统计学意义外(P>0.05),其余两组与模型组组间差异具有统计学意义(P<0.05);西药组阳性面积较模型组减少(P<0.05)。与低剂量组相比,中剂量组、高剂量组及西药组阳性面积均减少(P<0.05)。与中剂量组相比,高剂量组阳性面积减少,但差异无统计学意义(P>0.05)。见图2-3。
3.3 各组肺组织PCNA表达水平的比较
与正常组相比,模型组PCNA表达明显增多(P<0.05)。与模型组相比,低剂量组、中剂量组、高剂量组及西药组PCNA表达均减少(P<0.05)。与低剂量组相比,中剂量组、高剂量组及西药组PCNA表达均减少(P<0.05)。与中剂量组相比,高剂量组和西药组PCNA表达均减少(P<0.05)。见图4-5。
3.4 各组肺组织中NLRP3、Caspase-1、GSDMD、IL-1β、IL-18的蛋白水平的比较
与正常组相比,模型组肺组织中NLRP3、Caspase-1、GSDMD、IL-1β、IL-18的蛋白水平均升高(P<0.05)。与模型组相比,低剂量组、中剂量组、高剂量组及西药组肺组织中NLRP3、Caspase-1、GSDMD、IL-1β、IL-18的蛋白水平均下降,除低剂量组中Caspase-1、IL-1β、IL-18和中剂量组中Caspase-1下降与模型组相比,差异无统计学意义外(P>0.05),其余组间差异均具有统计学意义(P<0.05)。与低剂量组相比,中剂量组、高剂量组及西药组肺组织中NLRP3、Caspase-1、GSDMD、IL-1β、IL-18的蛋白水平均下降,其中,高剂量组肺组织中NLRP3、Caspase-1、GSDMD、IL-1β、IL-18的蛋白下降与低剂量组相比,差异均有统计学意义(P<0.05)。与中剂量组相比,高剂量组和西药组肺组织中NLRP3、Caspase-1、GSDMD、IL-1β、IL-18的蛋白水平均下降,其中高剂量组肺组织中NLRP3、Caspase-1、GSDMD、IL-1β、IL-18的蛋白下降与中剂量组相比,差异均有统计学意义(P<0.05)。与高剂量组相比,西药组肺组织中NLRP3、Caspase-1、GSDMD、IL-1β、IL-18的蛋白水平均上升(P<0.05)。见图6-7。
4 讨论
COPD会出现血管结构(血管重塑)的改变,这种改变可能会发展并导致PAH,这种并发症可能会在50%以上的晚期患者中出现[19]。PAH的发生,增加了疾病的恶化频率,缩短了患者的生存期[20-21]。因此,探究COPD-PAH中肺血管重塑的机制,有利于寻找有效的治疗靶点,为临床患者带去福音。
本研究结果首次证实NLRP3炎症小体介导细胞焦亡参与COPD-PAH的血管重塑。最新研究发现,依赖于Cspase-1激活的细胞焦亡存在于PAH大鼠模型和缺氧的人类肺动脉平滑肌细胞中,且该研究指出,抑制Caspase-1的激活,可改善PAH[22]。NLRP3/Caspase-1/GSDMD信号通路是细胞焦亡关键机制之一[23]。NLRP3炎症小体与COPD、PAH的发生发展密切相关[6-7]。在本研究中,HE染色、Masson染色和免疫组化的结果充分证实COPD-PAH大鼠肺血管出现了血管重塑的病理表现。Western blot的结果显示,相比正常组,COPD-PAH大鼠肺组织中NLRP3、Caspase-1、GSDMD、IL-1β、IL-18的表达显著上调。综上所述,NLRP3炎症小体介导细胞焦亡存在于COPD-PAH大鼠中,与肺血管重塑密切相关。
痰饮、血瘀贯穿COPD-PAH疾病始终且影响预后。临床上,以“飲瘀同治”为治法的复方葶苈子汤可有效缓解和改善COPD-PAH患者症状[16-17]。复方葶苈子汤中葶苈子泻肺逐水、止咳平喘,为君药;黄芩清肺化痰,水蛭活血化瘀,矮地茶化痰止咳,共助君药宣通肺部壅滞,为臣药;桃仁、红花、川芎活血逐瘀,茯苓、桂枝、白术温脾化饮,以绝生痰之源,为佐药;甘草健脾和中,调和诸药,为使药。诸药合用,共奏泻肺逐瘀、温肺化痰、止咳平喘之效。
本研究结果显示,与模型组相比,中药组大鼠的肺血管重塑病理表现明显改善,肺组织中PCNA、NLRP3、Caspase-1、GSDMD、IL-1β、IL-18的表达均下调;且本研究通过设置低、中、高剂量组,明确复方葶苈子汤改善COPD-PAH的肺血管重塑是否存在剂量依赖,结果表明,随着复方葶苈子汤药物浓度的增加,肺血管重塑病理表现改善越明显,肺组织中PCNA、NLRP3、Caspase-1、GSDMD、IL-1β、IL-18下调越多。此外,本研究设置了西药组,采用辛伐他汀处理。文献研究已表明,辛伐他汀治疗COPD-PAH能有效改善肺功能,降低血清炎性因子,提高血管内皮功能等[24-25]。本研究结果显示,中、高剂量组改善COPD-PAH的血管重塑效果与西药组辛伐他汀改善效果相当;Masson染色结果显示,西药组阳性面积和中剂量组相当,而高剂量组阳性面积少于西药组;肺组织中PCNA免疫组化结果显示,西药组PCNA表达水平和高剂量组相当;Western blot结果显示,高剂量组的肺组织中PCNA、NLRP3、Caspase-1、GSDMD、IL-1β、IL-18的表达较西药组均显著下调。本研究结果提示,复方葶苈子汤高剂量组治疗COPD-PAH疗效与西药组辛伐他汀疗效相似。
综上所述,本研究首次表明,复方葶苈子汤通过抑制NLRP3炎症小体介导细胞焦亡能改善COPD-PAH的血管重塑,为临床上复方葶苈子汤能有效治疗COPD-PAH患者提供机制支持。
参考文献
[1] BLANCO I, TURA-CEIDE O, PEINADO V I, et al. Updated perspectives on pulmonary hypertension in COPD[J]. International Journal of Chronic Obstructive Pulmonary Disease, 2020,15:1315-1324.
[2] CAO N, TANG X, GAO R, et al. Galectin-3 participates in PASMC migration and proliferation by interacting with TGF-β1[J]. Life Sciences, 2021,274:119347.
[3] RONG B, LIU Y, LI M, et al. Correlation of serum levels of HIF-1α and IL-19 with the disease progression of COPD: a retrospective study[J]. International Journal of Chronic Obstructive Pulmonary Disease, 2018, 13:3791-3803.
[4] XIE Y, HUANG Y, LING X, et al. Chemerin/CMKLR1 axis promotes inflammation and pyroptosis by activating NLRP3 inflammasome in diabetic cardiomyopathy rat[J]. Frontiers in physiology, 2020,11:381.
[5] WALI J A, MASTERS S L, THOMAS H E. Linking metabolic abnormalities to apoptotic pathways in Beta cells in type 2 diabetes [J]. Cells, 2013, 2(2): 266-83.
[6] COLARUSSO C, TERLIZZI M, MOLINO A, et al. Role of the inflammasome in chronic obstructive pulmonary disease (COPD) [J]. Oncotarget, 2017, 8(47):81813.
[7] ZENG M, SANG W, CHEN S, et al. Inhibition of ER stress by 4-PBA protects MCT-induced pulmonary arterial hypertension via reducing NLRP3 inflammasome activation[J]. International Journal of Clinical and Experimental Pathology, 2017,10(4):4162-4172.
[8] 李竹英,王 婷,田春燕.参芪补肺方对慢性阻塞性肺疾病稳定期大鼠Nrf2和γ-GCS表达的影响[J].湖南中医药大学学报,2018, 255(12):36-40.
[9] 潘三改,苏南湘,王 哲,等.丰白散对COPD模型大鼠γ-谷氨酰半胱氨酸合成酶及超氧化物歧化酶的影响[J].湖南中医药大学学报,2009(6):36-39.
[10] 孙 宁,于文晓,袁 芳.基于网络药理学和分子对接技术探讨桑梅止咳颗粒治疗COPD的作用机制[J].湖南中医药大学学报,2021,41(12):1905-1913.
[11] WU X, ZHANG F, XIONG X, et al. Tetramethylpyrazine reduces inflammation in liver fibrosis and inhibits inflammatory cytokine expression in hepatic stellate cells by modulating NLRP3 inflammasome pathway[J]. IUBMB Life, 2015,67(4): 312-321.
[12] 刘富群,高 崎,王丹丹,等.银杏酮酯(GBE50)抑制NLRP3炎症小体活性改善大鼠抑郁样行为[J].中药药理与临床,2017(5):54-58.
[13] 蔡 琳,易小波,袁利邦,等.丹参酮ⅡA通过NLRP3炎症体信号通路对小胶质细胞糖氧剥夺/再灌注损伤的保护作用[J].四川大学学报(医学版),2016,47(5):660-664.
[14] 刘 敏,张才圣,柏正平.麻葶舒喘汤对哮喘小鼠气道黏液高分泌的影响及机制研究[J].湖南中医药大学学报,2020,40(12):1449-1455.
[15] 柏正平,郑 兵,卜献春,等.复方葶苈子胶囊对肺动脉高压和心肌收缩力影响的实验研究[J].湖南中医杂志,2000,16(1):57-58.
[16] 柏正平,卜献春,喻正科,谭光波,曾松林.复方葶苈子胶囊治疗肺心病心衰45例疗效观察[J].湖南中医药导报,2002,8(3):5-97.
[17] 柏正平,卜献春,谭光波,等.复方葶苈子胶囊治疗肺心病心衰疗效评价及机理探讨[J].中国中医药信息杂志,2003,10(10):20-23.
[18] 舒家泽,卢文菊,李德富,等.应用烟草烟雾口鼻暴露联合脂多糖方法建造慢性阻塞性肺疾病及相关肺动脉高压小鼠模型[J].中华结核和呼吸杂志,2015,38(12):907-911.
[19] THABUT G, DAURIAT G, STERN JB, et al. Pulmonary hemod⁃
ynamics in advanced COPD candidates for lung volume reduction surgery or lung transplantation[J]. Chest, 2005,127(5):1531-1536.
[20] OSWALD-MAMMOSSER M, WEITZENBLUM E, QUOIX E, et al. Prognostic factors in COPD patients receiving long-term oxygen therapy. Importance of pulmonary artery pressure[J]. Chest, 1995,107(5):1193-8.
[21] KESSLER R, FALLER M, FOURGAUT G, et al. Predictive factors of hospitalization for acute exacerbation in a series of 64 patients with chronic obstructive pulmonary disease[J]. American Journal of Respiratory & Critical Care Medicine, 1999, 159(1):158-64.
[22] ZHANG M, XIN W, YU Y, et al. Programmed death-ligand 1 triggers PASMCs pyroptosis and pulmonary vascular fibrosis in pulmonary hypertension[J]. Journal of Molecular and Cellular Cardiology, 2020, 138: 23-33.
[23] JIANG S, ZHANG H, LI X, et al. Vitamin D/VDR attenuate cisplatin-induced AKI by down-regulating NLRP3/Caspase-1/GSDMD pyroptosis pathway[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2021, 206: 105789.
[24] 胡志偉,朱建俊,陆洪国,等.辛伐他汀治疗慢性阻塞性肺疾病并发肺动脉高压的临床观察[J].浙江实用医学,2019,24(6):4.
[25] 唐 晨.辛伐他汀治疗对慢性阻塞性肺疾病合并肺动脉高压患者心肺功能及炎性细胞因子的影响[J].现代中西医结合杂志,2017(8):851-853.

