肺炎支原体脂质相关膜蛋白诱发THP-1细胞炎症反应研究
席 月,夏 雯
(1. 江苏大学 医学院,江苏 镇江 212013; 2. 镇江高等专科学校 医药技术学院,江苏 镇江 212028)
肺炎支原体(Mycoplasmapneumonia,Mp)是引起人类原发性非典型肺炎的主要病原体,也是诱发社区获得性肺炎(Community acquired pneumonia,CAP)的重要病原体,可以造成部分患者重症支原体肺炎甚至死亡[1]。研究表明,重症支原体肺炎患者体内存在着大量过度表达的各种促炎细胞因子,如IL-1β,TNF-α和IL-6等,类似于“细胞因子风暴”。但近年来研究发现支原体细胞膜表面含有丰富的脂质相关膜蛋白(Lipid-associated membrane proteins, LAMPs),LAMPs在支原体黏附和侵入宿主上皮细胞过程中发挥重要作用,并进一步导致宿主细胞受损[2-3]。LAMPs还可以影响巨噬细胞、单核细胞和脑星形胶质细胞功能,从而诱发上述细胞过度表达促炎细胞因子,并引起免疫细胞的坏死或凋亡,导致感染的恶化。但LAMPs诱发巨噬细胞炎症反应的具体机制尚不清楚。本研究纯化LAMPs并刺激人单核-巨噬(THP-1)细胞,通过分析THP-1细胞各种炎症因子表达以及NF-κB信号通路活化情况,初步揭示肺炎支原体诱发患者严重肺损伤机制,为寻找临床重症支原体肺炎治疗方案提供新思路。
1 材料与方法
1.1 细胞、试剂与仪器
1.1.1 细胞
人单核-巨噬(THP-1)细胞购自上海细胞库,由本实验室自行保种和培养。肺炎支原体(M129)标准株由南华大学朱翠明教授惠赠。
1.1.2 试剂
RPMI 1640细胞培养液和胎牛血清购自以色列BI公司。2×Taq PCR预混液、逆转录试剂盒、实时定量PCR试剂盒(SYBR Green染料法)、总RNA提取试剂盒均购自南京诺唯赞公司。RIPA裂解液、蛋白酶抑制剂(PMSF)、细胞浆蛋白和细胞核蛋白抽提试剂盒、活性氧检测试剂盒购自碧云天生物技术公司。ELISA试剂盒,兔组蛋白H1,NF-κB p65,鼠抗β-肌动蛋白抗体,HRP标记的山羊抗兔或鼠抗体购自美国ABclonal生物科技公司。ECL显色液购自美国Thermo Fisher公司。
1.1.3 仪器
恒温细胞培养箱购自美国Thermo Fisher公司。荧光定量PCR仪、免疫印迹系统及凝胶成像系统购自美国Bio-Rad公司。梯度PCR扩增仪购自美国ABI公司。
1.2 方法
1.2.1 细胞培养
THP-1细胞按常规方法培养于含10%胎牛血清的RPMI 1640培养基中,37 ℃,5% CO2稳定传代至第6代后用于本研究。取对数生长期细胞接种于6孔板(1×106个/孔),37 ℃,5% CO2培养过夜。
1.2.2 肺炎支原体脂质相关膜蛋白(LAMPs)提取
参照Hu等[4]方法培养Mp,并离心收集Mp沉淀置于-20 ℃保存备用。将Mp沉淀重悬于8 mL TBSE缓冲液(含50 mM Tris, 0.15 M NaCl, 1 mM EDTA, pH8.0),再加入终浓度为2 mL·L-1Triton X-114,4 ℃静置1 h,再置于37 ℃水浴中孵育10 min。弃上层水相,加入等体积的TBSE缓冲液,重复上述水相分离操作1次。第2次水相分离结束后弃去水相,再加入等体积TBSE使之恢复至最初体积,在整个体系中加入2.5倍体积的无水乙醇,于-20 ℃过夜沉淀LAMPs。次日以14 000 r·min-1离心20 min后弃去上清,沉淀经PBS缓冲液充分重悬即为LAMPs溶液。BCA法测定所抽提的LAMPs浓度,-70 ℃保存备用。
1.2.3 细胞分组及处理
实验分组包括正常对照组、0.5 μg·mL-1LAMPs组和5 μg·mL-1LAMPs组。不同浓度LAMPs刺激THP-1细胞24 h,收集细胞和培养液上清用于后续研究。
1.2.4 ELISA法测定细胞因子
收集各组细胞培养上清液各1 mL,4 ℃,1 000 r·min-1离心20 min除去沉淀。采用ELISA试剂盒检测上清液中IL-1β,IL-18和TNF-α表达水平,使用酶标仪在450 nm处测吸光度值,绘制出各种细胞因子检测的标准曲线,并计算各组细胞上清液中细胞因子含量。
1.2.5 qRT-PCR法检测THP-1细胞NLRP3炎症复合体炎性表达
使用Trizol试剂抽提THP-1细胞总RNA,以Oligo(dT)为引物经逆转录合成cDNA链,通过qRT-PCR技术测定细胞炎性相关因子mRNA表达水平。qRT-PCR反应总体系共20 μL,包括SYBR Green Master预混液10 μL,上、下游引物各0.4 μL(10 μmol·L-1),cDNA模板2 μL。反应程序:95 ℃预变性5 min,95 ℃变性3 s,58 ℃退火20 s,72 ℃延伸30 s,反应共计40个循环。以GAPDH作为内参,通过公式2-△△Ct计算mRNA相对表达量。所用引物序列见表1。

表1 引物序列
1.2.6 细胞核浆蛋白分离和免疫印迹法检测NF-κB p65蛋白表达
按上述细胞分组处理后收集细胞,弃上清,用4 ℃的PBS清洗2次。按照胞浆胞核蛋白提取试剂盒说明书提取胞浆蛋白及胞核蛋白,蛋白变性后采用Western blotting法进行检测。细胞浆蛋白以β-肌动蛋白为内参,核蛋白以组蛋白H1为内参,应用Image J软件分析条带灰度值。
1.2.7 流式细胞术检测细胞活性氧含量
采用2′,7′-二氯荧光黄双乙酸盐(DCFH-DA)探针法检测THP-1细胞中活性氧水平。无血清培养基按照1 ∶1000比例稀释DCFH-DA至终浓度为10 μmol·L-1。细胞重悬于稀释后的DCFH-DA探针溶液中,于37 ℃细胞培养箱内避光孵育20 min,隔5 min颠倒混匀,使探针和细胞充分接触。无血清细胞培养基洗涤3次,以去除未进入细胞内的DCFH-DA探针,再以无菌PBS缓冲液重悬细胞后进行检测。
1.3 统计学分析

2 结果
2.1 LAMPs诱导THP-1细胞促炎细胞因子表达
ELISA法检测培养液上清中IL-1β,IL-18和TNF-α含量,结果见图1。与正常对照组比较,终浓度0.5 μg·mL-1和5 μg·mL-1的LAMPs均可以显著提高THP-1细胞IL-1β,IL-18和TNF-α表达量(P<0.05),且5 μg·mL-1LAMPs组表达量明显高于0.5 μg·mL-1组(P<0.05)。
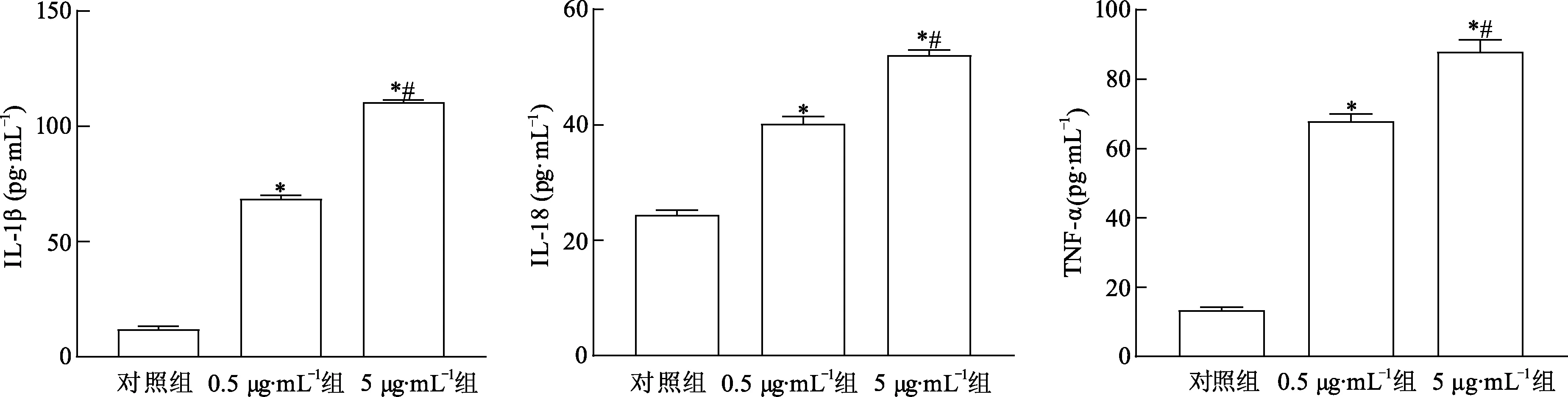
*: P<0.05,与对照组比较; #: P<0.05,与0.5 μg·mL-1组比较
2.2 LAMPs诱导THP-1细胞NLRP3炎症复合体活化
荧光定量PCR法检测THP-1细胞NLRP3和Caspase-1 的mRNA表达量,结果见图2。与正常对照组比较,0.5 μg·mL-1组和5 μg·mL-1组细胞NLRP3和Caspase-1 mRNA表达量均显著升高(P<0.05),且5 μg·mL-1组NLRP3的mRNA表达量显著高于0.5 μg·mL-1组(P<0.05),而Caspase-1的mRNA表达量差异无统计学意义(P>0.05)。
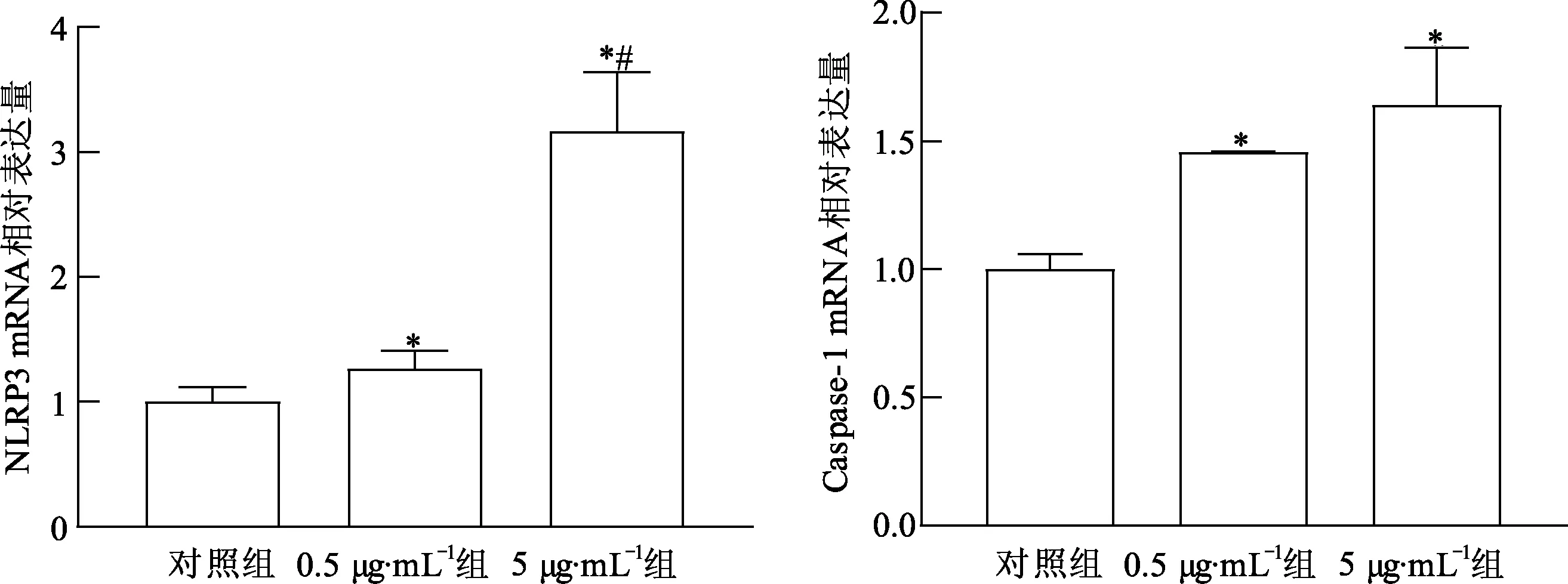
*:P<0.05,与对照组比较; #: P<0.05,与0.5 μg·mL-1组比较
2.3 LAMPs诱导THP-1细胞中NF-κB p65蛋白核转位
免疫印迹法检测THP-1细胞NF-κB信号通路活化水平,结果见图3。与正常对照组比较,0.5 μg·mL-1组和5 μg·mL-1组细胞核内NF-κB p65蛋白表达量均显著升高(P<0.05),且5 μg·mL-1组显著高于0.5 μg·mL-1组(P<0.05)。而0.5 μg·mL-1组和5 μg·mL-1组细胞胞浆中NF-κB p65蛋白表达量与对照组比较,差异无统计学意义(P>0.05)。
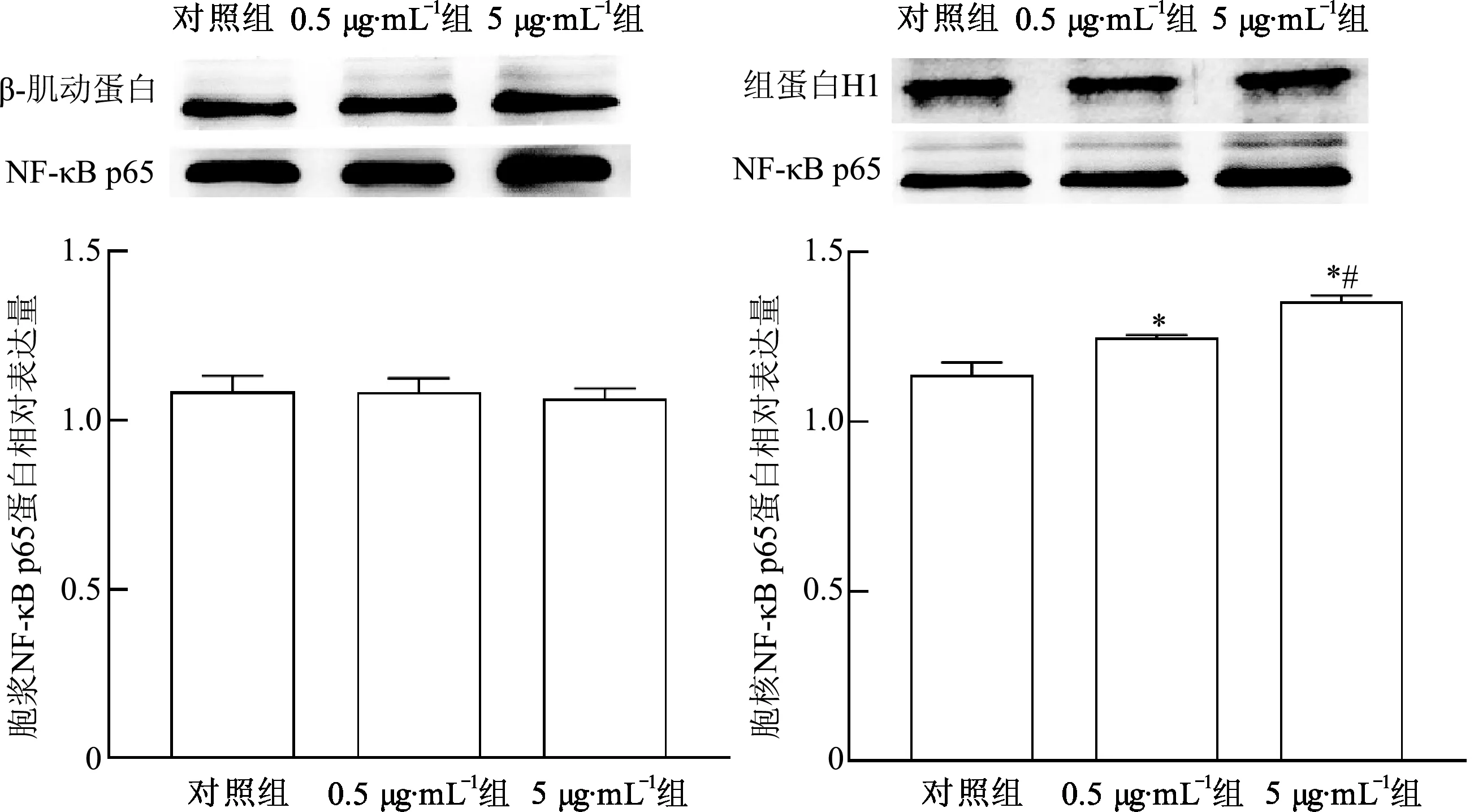
*:P<0.05,与对照组比较; #: P<0.05,与0.5 μg·mL-1组比较
2.4 LAMPs诱导THP-1细胞活性氧生成
采用流式细胞术检测细胞活性氧生成量,结果见图4。与正常对照组比较,0.5 μg·mL-1组和5 μg·mL-1组细胞活性氧生成量显著升高(P<0.05),且5 μg·mL-1组显著高于0.5 μg·mL-1组(P<0.05)。

*:P<0.05,与对照组比较; #: P<0.05,与0.5 μg·mL-1组比较
3 讨论
3.1 肺炎支原体及LAMPs的致病机制
肺炎支原体是呼吸道感染常见病原体,它可以引起人类肺炎、气管支气管炎、咽炎和哮喘。约25%的社区获得性肺炎由Mp所致,虽然大部分患者可自愈,但仍有少部分患者会发展为重症支原体肺炎[5-6]。有研究表明,支原体肺炎恶化的原因在于患者体内产生大量促炎细胞因子,如IL-1β,TNF-α和IL-6等,类似于严重细菌感染时发生的“细胞因子风暴”现象,患者体内发生过度免疫反应,进而造成正常组织和细胞炎症的损伤。由于肺炎支原体缺乏细胞壁,不产生类似革兰阴性菌的脂多糖,因此肺炎支原体诱发患者强烈炎症反应的机制目前仍不清楚[7-8]。
肺炎支原体细胞膜的主要成分为脂质双分子层和膜蛋白。膜蛋白包括膜本体蛋白和外周膜蛋白。其中膜本体蛋白能够不同程度地插入到脂质双分子层之间,可以通过去污剂(如Triton X-114)萃取,而主要靠次级键整合到细胞膜上的外周膜蛋白则易于释放。膜本体蛋白和外周膜蛋白统称为LAMPs。LAMPs大量暴露于肺炎支原体表面,可以直接刺激宿主免疫细胞活化并诱导炎症损伤。笔者研究纯化了LAMPs并将其体外刺激THP-1细胞,发现LAMPs可以使THP-1细胞NF-κB p65蛋白从细胞浆移位至细胞核,激活NF-κB信号通路,并且刺激细胞释放大量促炎细胞因子,从而加重炎症反应。
3.2 LAMPs对THP-1细胞NLRP3炎症小体的激活作用
NLRP3炎症体是一种细胞内感受器,由NOD样受体家族3、接头蛋白ASC和效应蛋白Caspase-1组成的大分子多蛋白复合体[9]。NLRP3炎症小体能被多种刺激物活化,包括微生物组分和内源性分子(如活性氧等)[10]。笔者发现,LAMPs可以诱导 THP-1细胞活性氧生成,且高浓度LAMPs诱导能力显著高于低浓度LAMPs。大量活性氧进一步诱导THP-1细胞NLRP3炎症小体的激活,活化的NLRP3炎症小体进而活化Caspase-1,促进IL-1β前体和IL-18前体的切割以产生成熟的 IL-1β和IL-18,导致严重的炎症反应。因此NLRP3炎症小体的激活和调控具有十分重要的生理和病理意义。通常认为,适量的促炎细胞因子有助于清除侵入的肺炎支原体;但当NLRP3炎症小体过度活化时,会诱发大量促炎细胞因子的过量表达,并造成大量正常细胞和组织损伤,进而严重威胁患者生命[11]。与低浓度LAMPs比较,高浓度LAMPs诱发THP-1细胞NLRP3炎症小体和各种促炎细胞因子表达能力更强,其造成的免疫损伤也更为严重。这一点与临床中肺炎支原体严重感染时诱发重症支原体肺炎相似,LAMPs可能是肺炎支原体的重要毒力因子。
4 结束语
综上所述,大量肺炎支原体所产生的高浓度LAMPs可能是诱发重症支原体肺炎的主要原因。高浓度LAMPs诱导巨噬细胞生成大量活性氧,诱导NF-κB信号通路活化,激活NLRP3炎症小体,进一步诱导巨噬细胞分泌大量促炎细胞因子,最终造成正常组织和细胞的严重炎症损伤。因此在肺炎支原体感染初期即应接受治疗,以免肺炎支原体大量增殖造成病情恶化。

