miR-124在卒中后脑缺血损伤与修复中的作用及机制研究进展
王 众,李可心,孙妍玉,吴 晋
南京医科大学第二附属医院神经内科,江苏 南京 210011
脑卒中是成人因病致死和致残的主要原因之一,缺血性卒中占70%以上[1]。目前临床针对该类疾病的有效治疗药物是使用组织型纤溶酶原激活剂对患者进行溶栓治疗,但是由于种种条件的限制,仅约6%的患者能够接受溶栓疗法[2]。随着机械取栓技术的成熟,更多的缺血性卒中患者得到救治,病死率逐年下降,大部分幸存者转化为慢性局灶性功能障碍[2],遗憾的是目前临床尚缺乏促进卒中后功能修复的药物。
微小RNA-124(microRNA-124,miR-124)是一种在大脑皮层和小脑中特异性表达最丰富的miRNA[3],在神经干细胞中表达水平较低,而在分化成熟的神经元中显著高表达,在神经元的突触联系和发育进程中发挥着不可或缺的作用。缺血性脑卒中后,miR-124 在体液和组织中的表达发生明显改变,广泛参与缺血性卒中后的多种病理生理过程,靶向调控分子水平和病理过程以减轻脑缺血损伤,促进功能修复[4-7]。本文就miR-124 对缺血性卒中的作用及机制研究进展做一综述,旨在为缺血性卒中提供新的标志物和可能的治疗思路。
1 miR-124作为治疗预后标志物
Sun等[8]选取急性缺血性卒中患者与健康人群,检测血清miR-124表达水平,结果提示在缺血后24 h内miR-124 迅速下降,48~72 h 内逐渐升高,这与既往在动物MACO模型中检测到的miR-124变化情况略有差异,但变化趋势完全相同。多项研究证明,卒中患者的血清、血浆、脑脊液以及死于卒中的患者大脑样本中miR-124的表达水平均显著升高[8-11],且miR-124表达水平与卒中后的梗死体积和脑损伤程度呈正相关[10-11]。缺血性卒中后血清miR-124水平升高是脑组织受损后释放miR-124 进入体液的结果,因而miR-124 水平与病变大小显著相关。同时,Rainer 等[12]发现缺血性卒中超早期(<6 h)血浆miR-124 的变化程度可以预测患者3个月的复发率和死亡率。这些研究证明miR-124有望成为缺血性卒中早期敏感的辅助诊断和评估治疗预后的生物标志物。
2 miR-124的作用机制
缺血性脑损伤后,组织中氧、糖获得障碍,触发原发和继发性损伤,包括多种类型的细胞反应、缺血再灌注损伤以及血脑屏障(blood-brain barrier,BBB)破坏等,最终导致局灶性神经功能缺陷,甚至死亡[9,13]。中风后根据时间分为3个不同的时期:急性期(2周内)、恢复期(2周~3个月)和后遗症期(3个月后)[14],miR-124有望治疗缺血性卒中的机制在于其发挥了减轻急性期脑缺血损伤和促进恢复期功能修复的作用(图1)[9]。
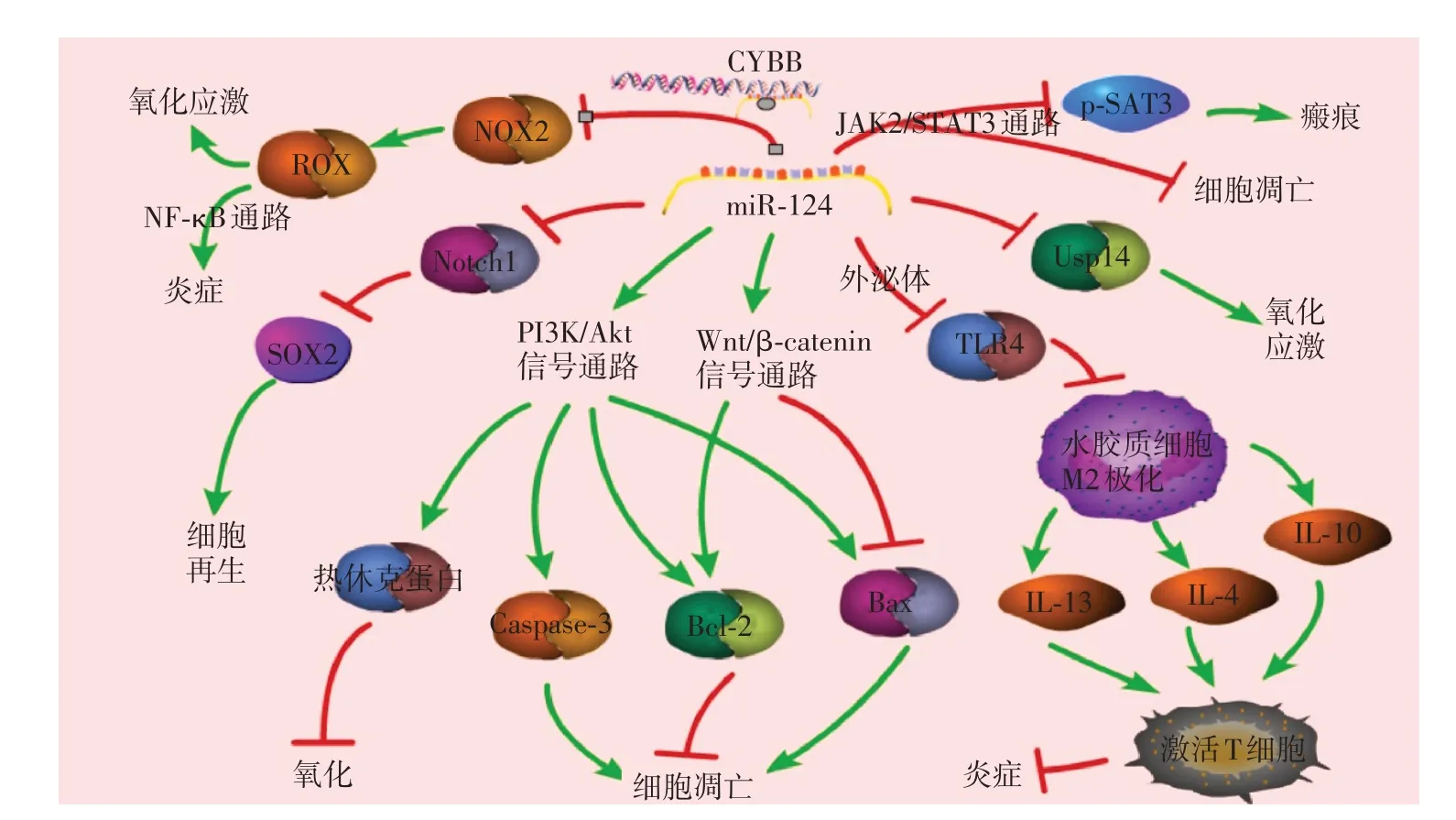
图1 miR-124调节氧化应激、神经炎症、细胞凋亡和功能修复的信号通路Figure 1 Signaling pathways underlying the roles of miR-124 in regulating oxidative stress,neuroinflammation,apoptosis and functional repair
2.1 miR-124与氧化应激
在血流缺失的超早期(<24 h),过多的活性氧(reactive oxygen species,ROS)产生介导了氧化应激过程并激活急性期神经内源性炎症反应,ROS 和炎症因子的释放破坏了细胞外基质和连接蛋白,产生广泛性细胞损伤,神经细胞进行性死亡[15]。ROS 主要由烟酰胺腺嘌呤二核苷酸磷酸氧化酶(nicotinamide adenine dinucleotide phosphate oxidase,NOX)作用生成,ROS 过量产生引起的氧化应激状态激活了NF-κB 通路,合成早期促炎细胞因子,增强神经炎症[13],在NOX 家族的7 个成员中,NOX2 和NOX4被认为是再灌注8~16 h内ROS的主要来源。体外、体内实验显示,神经元中的miR-124-5p 直接与CYBB(合成NOX2的基因)的3′UTR结合,负向调节NOX2水平[16],减少ROS的产生和脂质、核酸的过氧化,并抑制NF-κB 通路诱导的神经炎症,缩小梗死面积[6]。泛素特异性蛋白酶14(ubiquitin-specific proteases14,Usp14)是一种去泛素化的蛋白质,是蛋白酶体活性的主要调节因子,Min等[17]证实miR-124靶向抑制Usp14,改变细胞静息状态,增强蛋白酶体活性,从而减少氧化应激诱导的细胞死亡。miR-124平衡了自由基的产生和消除,避免了氧化应激导致的直接损伤。
2.2 miR-124与神经炎症
缺血后炎症反应是缺血性卒中急性期广泛性细胞死亡的关键病理生理机制,炎症反应早期小胶质细胞激活,向不同表型M1型和M2型极化[18]。早期小胶质细胞向M2型极化,清除细胞碎片,释放神经保护性营养因子和抗炎介质,卒中晚期具有促炎性的M1 型细胞释放促炎因子,对组织造成炎症损害。因此,抑制小胶质细胞的过度反应、调节M1/M2的极化有益于神经恢复。动物实验中,通过外泌体能靶向递送大量miR-124 至脑组织,直接抑制脑损伤后的Toll 样受体4(toll-like receptor 4,TLR4),促进其向M2 极化,改善功能恢复[5]。同样,缺血性卒中后脑内注射miR-124通过促使小胶质细胞转变为M2抗炎表型释放抗炎因子,如白介素(interleukin,IL)-10、IL-4和IL-13,并激活T细胞来抑制炎症的发展[19]。miR-124 显著降低炎症因子如TLR4、NF-κB和小胶质细胞激活标志物IBA1的表达,减轻小胶质细胞激活引起的炎症[20],改善缺血性中风后的抗炎作用和长期功能预后。上述研究提示miR-124可能作为一种新的抗炎调节剂。
2.3 miR-124与细胞凋亡
随着早期炎症反应的发生,细胞因子诱导免疫细胞激活,卒中后1 周迟发性神经细胞死亡(凋亡)启动,JAK2/STAT3 通路是神经细胞凋亡的典型调节通路[21],Hu 等[22]发现脑缺血再灌注损伤急性期miR-124 靶向抑制JAK2 的激活及下游STAT3 的磷酸化,发挥抗凋亡作用,提高神经细胞存活率。虽然缺血再灌注损伤后,miR-124的表达水平升高,但随着缺血再灌注损伤的加重,其代偿作用减弱。而注射外源性miR-124 直接抑制STAT3 蛋白,显著降低了细胞凋亡相关蛋白的表达[23]。同时,miR-124通过靶向激活Wnt/β-catenin 信号通路,上调抗凋亡蛋白Bcl-2 表达、抑制促凋亡蛋白Bax表达来减少大鼠脑缺血区的神经细胞凋亡,减轻神经细胞损伤,减少功能缺损[24]。miR-124 激活Wnt/β-catenin 通路后抑制脑缺血再灌注区神经元的凋亡而改善氧化应激的神经损伤,显著提高神经干细胞的再生水平[25]。这些结果证明了miR-124 具有早期抗凋亡作用,降低脑损伤体积。
不同研究者对miR-124调节PI3K/Akt途径调控细胞凋亡作用的认识有差异[4,26-27]。Wang 等[4]观察到miR-124 激活PI3K/Akt 发挥抗凋亡作用,通路激活后上调Bcl-2,减轻缺血性卒中细胞损伤和坏死。同时,miR-124 激活PI3K/Akt/Nrf2 途径增加热休克蛋白的表达,抑制氧化应激和凋亡过程,保护PC12细胞免受氧-糖剥夺复氧(OGD/R)损伤[26]。而另一个研究发现,梗死后升高的miR-124负向调控PI3K/Akt信号通路,促进Bax和炎症因子Caspase-3的表达,加重神经元活力下降和轴突损伤[27]。因此,miR-124调节细胞凋亡的机制尚需更多研究来证实。
2.4 miR-124与功能修复
卒中后仅通过损伤后代偿性激活的神经元前体向神经元分化来对受损脑组织进行修复是不够的,一个有希望的途径是优化卒中急性期至后遗症期的神经分化、增殖过程,以促进自我修复。miR-124可以通过靶向抑制DACT1 的表达来激活Wnt/βcatenin 通路,最终促进损伤后早期神经干细胞存活和向神经元分化[28]。在实施OGD/R 前预先抑制miR-124 表达,可显著激活PI3K/Akt/mTOR 通路,加强蛋白质合成和转录,促进损伤后轴突生长[29]。而Wang 等[30]也证实了miR-124 靶向调节脑源性神经营养因子的表达,持续调控神经元再生、发育和可塑性。Song等[31]应用miR-124抑制Usp14,调节突触活性,促进突触重塑、神经元连接和神经血管再生。这些研究提示miR-124是改善早期神经功能恢复的重要靶点。
急性期之后是炎症反应减弱和可塑性最大的恢复期,在啮齿类动物中持续大约1个月,在人类脑卒中后持续长达3个月,随着时间进展,可塑性逐渐降低,在后遗症期诱导康复的潜力有限[14]。卒中恢复期JAK2/STAT3 的激活促进星形胶质细胞生长,胶质纤维酸性蛋白表达增强,形成胶质瘢痕,阻碍神经元再生。miR-124 与STAT3 的3′UTR 结合,直接抑制STAT3 表达,在MCAO 小鼠模型中,注射外泌体搭载的miR-124 后,STAT3 和p-STAT3(STAT3的活化形式)水平较注射前明显降低,胶质纤维酸性蛋白表达明显下调,神经瘢痕形成减少[7,31]。Notch 通路是细胞增殖、分化和成熟组织的凋亡中的重要调节通路,同时也是维持神经系统发育功能的主要调节因子[32]。miR-124 通过调节Notch 通路来促进缺血损伤后的神经干细胞的定向增殖和分化,优化神经生发过程,以调节脑功能和促进视觉系统的再生,加快自我修复[28,33]。其中可能的机制是缺血诱导后,升高的miR-124 直接靶向和抑制Notch1 受体,增加下游转录因子Sox2 水平,触发星形胶质细胞中潜在的神经再分化程序,将星形胶质细胞逆转化为神经干细胞,进一步分化为功能完善的神经元,减少胶质瘢痕产生,直接参与卒中后神经网络的重建[7]。
3 miR-124治疗缺血性卒中临床转化的可能性
虽然有证据支持miR-124是治疗中枢神经系统疾病和损伤的一种有前途的治疗药物,但BBB限制了其进入大脑,如体外实验显示负载miR-124 的纳米颗粒增加了体外神经元细胞的存活和神经元分化,但在动物体内并没有改善中风预后[34]。因此在使用miR-124 治疗急性卒中之前,需要明确其给药方式。目前的问题是需要设计一种跨越BBB 的miR-124 递送系统,实现组织/细胞特异性靶向,已经开发了几种方法将miRNA 输送到中枢神经系统用于治疗炎症、脑卒中和帕金森病,包括外泌体、纳米颗粒、腺相关病毒[35]。装载miR-124的外泌体能被特异性递送至中枢神经系统,并促进神经发生[35]。
外泌体是30~100 nm 的囊泡,是细胞外小泡的主要类型[20]。外泌体颗粒的小尺寸和高脂成分有助于它们通过BBB 转运活性物质(胞浆蛋白、脂质和RNA 等),在细胞间高效穿梭或运送小分子到大脑中特定的靶细胞群,以介导疾病和损伤后的大脑重构,同时神经细胞分泌的外泌体被发现有助于缺血性中风后局部突触的重塑[36]。目前已经发现外泌体可将几种miRNA 模拟物和抑制剂有效输送到大脑,并可以保护中枢神经系统免受损伤[37]。而将携带miR-124 的外泌体注射到梗死区,可极大地促进前体细胞向神经元分化,减轻缺血性卒中后的皮层损伤[38]。miR-124 在M2 型小胶质细胞的外泌体中含量丰富,可靶向送至脑内被神经元摄取,促进神经生发,并下调Usp14来减轻神经元凋亡,保护神经元免受缺血再灌注损伤[31]。除了促进小胶质细胞向M2型极化,静脉注入外泌体miR-124还可以抑制神经细胞炎症和神经元自噬,促进神经发生,改善脑损伤后的认知和预后[5,39]。这些研究表明,外泌体可能成为外源性miRNA进入脑内的载体,外泌体搭载miR-124可能是治疗缺血性卒中的潜在方法。
4 总结与展望
缺血性脑损伤涉及的细胞和分子变化提供了大量潜在的生物标志物和治疗靶点。基于miRNA调控多种分子及信号通路表达的特性,miRNA 研究已经成为治疗缺血性脑损伤的热门领域。尽管miR-124 在缺血性卒中的治疗中仍有不同的结论,有待进一步研究,但miR-124 在中枢神经系统疾病中的生物学意义和治疗作用日益明显,同时外泌体有望作为药物载体和跨BBB 的输送载体。为了使miR-124更安全、有效地用于缺血性卒中的诊治,需要实现其组织/细胞特异性靶向,提供更高的稳定性和避免潜在的靶外效应,以及根据个体特征确定治疗窗口和治疗模式,基于miRNA药物的系统药代动力学也许能提供新的思路。总之,现有的研究表明miR-124为缺血性卒中的诊治提供了新思路。
——外泌体与老年慢性疾病相关性的研究进展

