KLF2在急性冠脉综合征中的作用研究
陈 亮,柏 洁,郑扣龙
南通大学第二附属医院心血管内科,江苏 南通 226001
急性冠状动脉综合征(acute coronary syndrome,ACS)是以冠状动脉粥样硬化斑块破裂或侵袭,继发完全或不完全闭塞性血栓形成为病理基础的一组临床综合征。包括急性ST 段抬高性心肌梗死(acute ST segment elevation myocardial infarction,STEMI)、急性非ST 段抬高性心肌梗死(non ST segment elevation myocardial infarction,NSTEMI)和不稳定型心绞痛(unstable angina,UA)。该组疾病发病急、病死率高,是心血管系统的急危重症之一。快速准确判断患者病情和预后,对ACS的治疗至关重要。
研究证明吸烟、大量饮酒、高血压、高脂血症及糖尿病是冠状动脉粥样硬化性心脏病的危险因子[1-4]。动脉粥样硬化不仅是大量脂质堆积在动脉壁的结果,从脂纹产生到复杂的动脉粥样斑块形成及其并发症的出现,白细胞浸润和内皮炎症因子表达改变贯穿于每个阶段,炎症反应在其中均起重要作用,因此抑制炎症反应,消除炎症因子诱导的免疫应答,可能成为治疗冠心病的新方法[5]。
Kruppel 样转录因子2(Kruppel-like factor 2,KLF2)属于锌指Kruppel 样转录因子家族成员之一,广泛表达于各种组织,编码转录激活剂和阻遏蛋白[6]。近年来的研究发现,KLF2在T淋巴细胞激活、分化、增殖、凋亡和迁移等方面扮演重要角色。特异性敲除KLF2 表达的小鼠T 细胞CD62L、CCR7下降,且T细胞KLF2表达与CD62L、CCR7表达正相关,而与趋化因子受体CCR5 等负相关[7]。此外,KLF2 表达缺失的T 细胞表面CXCR3 表达升高,导致T细胞归巢减少而异常聚集于外周靶器官[8]。因此转录因子KLF2可能是调控CD62L、CCR7和CXCR3等T细胞迁移相关分子的上游因子。
研究发现,常用于ACS 防治的他汀类药物,也可通过升高人类及小鼠T 细胞KLF2 表达,降低T细胞炎性效应,减轻T 细胞介导的组织病理损伤,且既往研究表明,他汀类药物可通过促使T 细胞向Th2 分化,减少Th1 及其效应因子产生,从而减轻炎性反应[9]。然而其减轻组织炎性反应的作用是否通过调控KLF2 表达实现尚未证实,其作用机制亦不清楚。
越来越多的研究表明,KLF2 与炎症的发生、发展有密切关系,而KLF2在ACS中的研究甚少,本研究拟通过检测KLF2基因及相关转录因子在ACS患者中的表达,探讨KLF2在ACS的发生、发展中的作用及潜在的临床意义;并研究KLF2 与Gensini 评分的相关性,可能成为ACS防治及检测的靶点。
1 对象和方法
1.1 对象
收集2020年1月—2021年5月收治于南通市第一人民医院心内科住院部确诊为ACS 患者123 例(ACS组),包括UA组45 例,NSTEMI组38例,STEMI组40 例。同时选取同时间段冠脉造影正常的患者45例为对照组,冠脉造影及手术报告由2名经验丰富的介入人员完成。ACS诊断参照2014年美国心脏病学会(American College of Cardiology,ACC)和美国心脏协会(American Heart Association,AHA)发布的心血管诊疗指南标准[10-11]。本研究经医院伦理委员会批准(2021KT138),所有患者均签署知情同意书。
1.2 方法
1.2.1 纳入标准与排除标准
纳入标准:UA 组,根据病史上出现典型的心绞痛症状、典型的缺血性心电图改变(新发或一过性ST 段压低≥0.1 mV,或T波倒置≥0.2 mV),实验室检查cTNI不升高。NSTEMI组,根据病史上出现典型的心绞痛症状、典型的缺血性心电图改变(新发或一过性ST段压低≥0.1 mV,或T波倒置≥0.2 mV),实验室检查心肌肌钙蛋白I(cardiac troponin I,cTNI)升高。STEMI组,根据典型的临床表现,特征性的心电图改变(T 波高尖、ST 段弓背向上抬高、新发的完全性左束支传导阻滞)以及实验室检查cTNI升高。对照组,行冠状动脉造影提示冠状动脉主支[左主干(left main,LM)、前降支(left anterior descending artery,LAD)、回旋支(left circumflex,LCX)或右冠状动脉(right coronary artery,RCA)]及其主要分支血管管腔直径无明显狭窄。既往无冠心病史,心电图无心肌缺血改变,心肌酶学正常。
排除标准:排除发热、急慢性感染、恶性肿瘤、严重肝肾功能不全、自身免疫性疾病、血液疾病、脑卒中、肌源性疾病、瓣膜性心脏病、心肌病、心力衰竭患者,B 超提示颈内动脉狭窄、肾动脉狭窄患者,其他重大疾病患者,不愿入组者和精神心理疾病、长期卧床不能自理者。
1.2.2 蛋白印迹(Western blot)试验
收集血液后提取总蛋白,SDS/PAGE 电泳,冰浴下80 V 转膜60 min。室温封闭2 h,一抗(KLF2 及GAPDH 均为1∶1 000 稀释),二抗(辣根过氧化物酶标记的IgG均为1∶10 000稀释),室温孵育1~2 h,化学发光法检测后分析结果。
1.2.3 实时荧光定量qRT-PCR实验
应用TRIzol 裂解细胞并提取各组细胞总RNA后,按试剂说明反转录成cDNA。qRT-PCR 检测表达水平。实验重复3 次。引物由Invitrogen 公司合成(表1)。
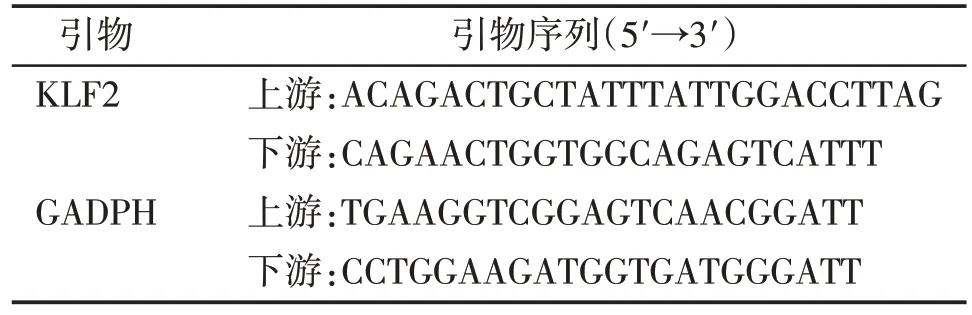
表1 PCR引物序列Table 1 The sequences of PCR primers
1.2.4 外周血单个核细胞(peripheral blood mononuclear cell,PBMC)提取
取ACS 组及对照组的外周血2 mL 于EDTA-Na抗凝管内,轻轻混匀,梯度密度离心,加入与管内剩余部分血浆相应体积的PBS缓冲液稀释,混匀,加入5倍体积的红细胞裂解液,适量PBS缓冲液洗涤2次,100 μL PBS缓冲液重悬细胞,即为PBMC悬液。
1.2.5 流式细胞术
在PBMC 悬液中,先加入Fc 受体阻断剂,抗-CD16/32,孵育10 min阻断非特异性结合后,再加入流式抗体,抗人CD3 及抗人CD8 标记T 细胞群,PE标记抗人CD62L、PE-Cyanine7标记抗人CCR7、APC标记抗人CXCR3、异硫氰酸荧光素(FITC)标记抗人CD44(eBioscience公司,美国)。避光孵育15 min后,加入1 mL PBS 洗细胞,400g离心5 min 后,400 μL PBS重悬,待上机检测。
1.2.6 Gensini评分
Gensini评分又称冠状动脉评分,是用于量化急性心肌梗死严重程度、制定治疗方案及评估预后的重要指标(表2)。

表2 Gensini评分表Table 2 Gensini Score
1.3 统计学方法
所有实验重复至少3 次。采用SPSS22.0 进行统计学分析,对服从正态或近似正态分布的计量资料采用均数±标准差()进行统计描述,多组间比较采用单因素方差分析;计数资料采用率(%)进行描述,多组间比较采用卡方检验,组间两两比较采用Bonferroni 法调整。P<0.05 为差异有统计学意义。
2 结果
2.1 基本特征
各组患者的临床特征如表3 所示。各组在年龄、性别、吸烟史、糖尿病、低密度脂蛋白(low density lipoprotein,LDL)、肾功能(creatinine,Cr)等临床指标上差异无统计学意义(表3)。
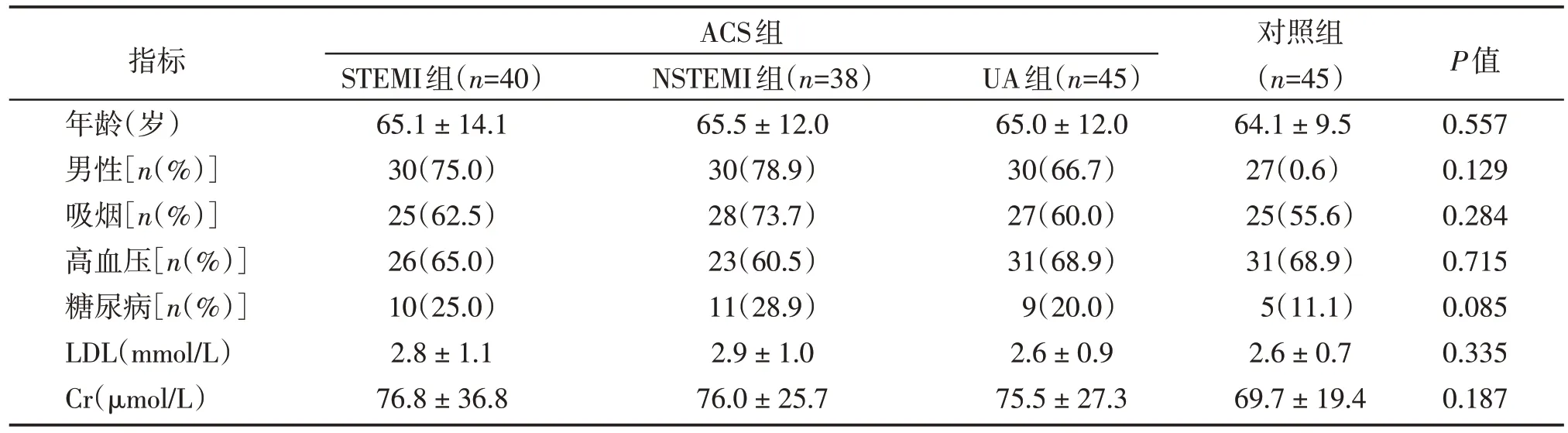
表3 各组临床资料比较Table 3 Comparison of clinical data in each group
2.2 KLF2基因在各组中的表达情况
为了探讨KLF2基因是否参与了ACS 的炎性反应过程,分别采用Western blot和qRT-PCR方法检测外周血中KLF2 蛋白(图1A)和mRNA(图1B)在各组的表达水平,结果见KLF2 mRNA 和蛋白水平在ACS 组中均显著减低,STEMI 组和NSTEMI 组KLF2基因的表达量明显低于UA 组及对照组,且STEMI组外周血中的KLF2水平低于NSTEMI组。
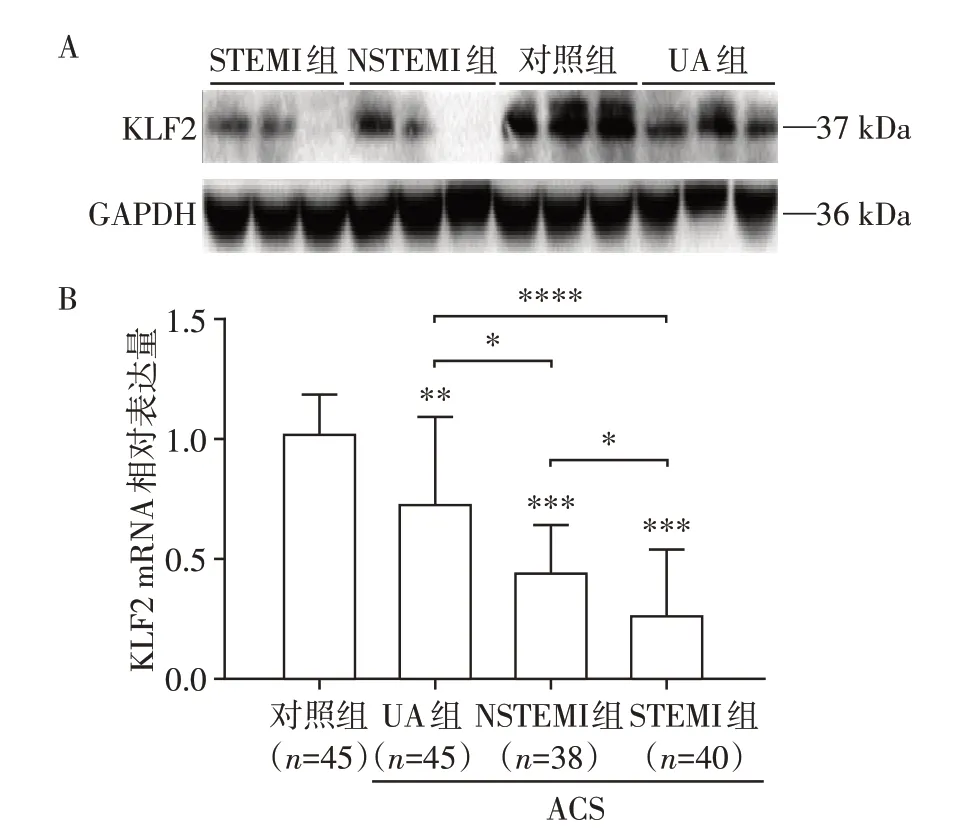
图1 各组KLF2 mRNA及蛋白表达情况Figure 1 The expressions of KLF2 protein and mRNA in each group
检测NSTEMI 组、STEMI 组治疗前后外周血中KLF2 蛋白(图2A)及mRNA(图2B)表达水平,发现NSTEMI 组及STEMI 组的患者外周血中KLF2 表达水平较治疗前明显增加,STEMI 组中KLF2 变化更大;上述结果表明KLF2 不仅在ACS 中发挥着重要作用,并且在急性心肌梗死中的作用更明显。
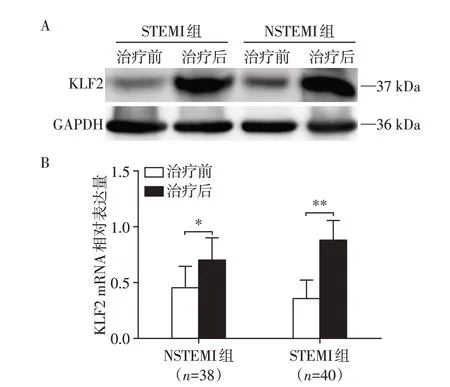
图2 STEMI 和NSTEMI 组治疗前后KLF2 蛋白和mRNA的表达情况Figure 2 The expressions of KLF2 protein and mRNA in STEMI and NSTEMI group before and after treatment
2.3 KLF2基因可减轻ACS的炎性反应
越来越多的研究发现,KLF2 广泛表达于各种组织,编码转录激活剂和阻遏蛋白[12],尤其在T 淋巴细胞激活、分化、增殖、凋亡和迁移等方面扮演重要角色。
研究表明CD62L是表达于T细胞表面的归巢受体,介导T 细胞归巢入外周淋巴组织,CCR7 亦是介导T细胞归巢的重要因素之一。因此分别检测各组CD62L(图3A)和CCR7(图3B)在T细胞中的阳性表达水平。实验结果表明,STEMI 组、NSTEMI、UA 组CD62L 和CCR7 表达水平均低于对照组,且表达量上,STEMI 组<NSTEMI<UA 组,提示发生ACS 后,KLF2的水平下降,可使T细胞归巢至淋巴组织的能力降低,增加炎性反应的可能。
虽然KLF2 的降低可使T 细胞表面的CD62L 和CCR7 表达降低,减少T 细胞归巢,但并不能证明效应T细胞随之增多,导致心脏炎性反应发生。因此,进一步检测ACS 组中CXCR3(图3C)和CD44(图3D)在T 细胞中的阳性表达水平,结果发现STEMI组、NSTEMI 组、UA 组CXCR3 和CD44 均高于对照组,且表达量上,STEMI组>NSTEMI组>UA组。由于初始T细胞不表达或低表达趋化因子受体CXCR3,炎性环境下细胞活化后CXCR3表达升高,介导T细胞向炎性部位迁移。活化因子CD44在一定程度上反映了T 细胞激活状态。因此上述实验结果证实,KLF2的减少直接下调了T细胞表面CD62L和CCR7的表达水平,增加了CXCR3和CD44表达,减少T细胞归巢及在外周循环定植,而向靶器官聚集增加,提示KLF2的降低可促使T细胞活化,增加效应T细胞的功能,加重ACS患者的炎症损伤。

图3 各组T细胞表面分子表达情况Figure 3 Expression of T cell surface molecules in each group
2.4 KLF2基因与Gensini评分的相关性研究
证实KLF2基因在ACS 炎性反应中发挥重要作用后,进一步探讨KLF2基因可否成为评估冠脉病变严重程度的有效指标。Gensini评分是临床上常用的评估冠脉狭窄严重程度的指标。因此运用Spearman相关分析比较ACS患者Gensini评分和KLF2 mRNA表达的相关性(图4)。经统计,Gensini 评分与KLF2 mRNA的表达呈负相关(r=-0.292,P=0.001)。
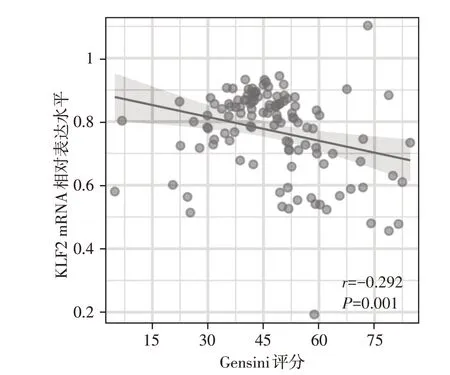
图4 Gensini评分与KLF2的mRNA表达的相关性Figure 4 The correlation of Gensini score and the mRNA expression of KLF2
3 讨论
ACS 不仅在发生、发展过程中与各种急慢性炎症密切相关,而且在治疗后也需要解决炎症反应及新生内膜增生等导致的再狭窄问题[13]。随着冠状动脉介入治疗(percutaneous coronary intervention,PCI)的快速发展和普及,PCI 术后的再狭窄问题愈来愈受到关注,目前普遍公认的机制为病变血管组织缺氧或低氧及反复球囊扩张及血管内支架置入术致血管内膜机械性损伤、局部组织坏死,产生的潜在致炎因子可引起血管壁的急性和慢性炎症反应。因此找到炎症反应的开关,从源头监控炎症反应的发生至关重要[14]。
KLF2 广泛表达于肺脏、脾脏、心脏、骨骼肌、胰腺和胎盘等组织,编码转录激活剂和阻遏蛋白[15]。因最初发现其主要在肺内表达,也称肺Kruppel 样转录因子(lung kruppel-like factor,LKLF)。KLF2 包含一个转录激活域、自抑制域和锌指结构域(即特定的DNA 结合域),通过转录激活或抑制在体内发挥重要的生物学功能。KLF2对于肺发育、血管形成是必不可少的[16]。KLF2 可通过抑制单核细胞炎症因子,如白细胞介素(interleukin,IL)-1β、IL-8、肿瘤坏死因子(tumor necrosis fuctor,TNF)-α和单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)等的表达发挥抗炎作用[17]。
本研究分别从mRNA 及蛋白水平检测了ACS患者外周血中KLF2 的表达水平,结果显示ACS 患者中KLF2 表达水平明显低于对照组,并且在AMI组中尤为明显。同时经手术及相应治疗后AMI 患者外周血中KLF2 的表达水平较治疗前明显升高,与对照组KLF2 表达水平相仿。初步证明KLF2 基因参与了ACS的发生发展。本研究发现4组LDL均不高,差异无统计学意义,可能与本研究中患者在怀疑疾病初期已预防性使用他汀类药物有关,而他汀类药物已被普遍证实可减轻机体部分炎症反应,但其是否通过调控KLF2的表达来发挥功能仍需进一步研究。
近年研究表明,转录因子KLF2 在T 细胞激活、分化、增殖及凋亡、迁移等方面扮演着重要角色。KLF2在CD4+CD8+双阳性T细胞中不表达,而在成熟的CD4+或CD8+单阳性初始T细胞中高表达。T细胞激活时,KLF2 mRNA 及蛋白水平均明显下降。此外,维持KLF2表达可保持T细胞静息状态[18-20]。研究显示,通过检测非淋巴组织,如肝、肾、骨骼肌等部位的T 细胞数量,发现KLF2-/-小鼠这些部位的T细胞数明显高于野生型对照组小鼠,且浸润的T 细胞表型发生改变,表达一些正常的初始T 细胞不表达的趋化因子受体,如CCR1、CCR3、CCR5、CCR6、CXCR1、CXCR2、CXCR3、和XCR1 等[21-22]。
推测在ACS中,KLF2表达缺失可导致T细胞表面分子表达异常,改变了T细胞迁移模式,导致T细胞在体内分布异常,可能表现为T 细胞在外周淋巴组织中减少,而在非淋巴组织中聚集增多,促使心肌炎症反应的爆发。KLF2 涉及多种T 细胞迁移相关表面分子的表达[21]。KLF2 可结合CD62L 启动子序列,通过转录激活直接促进CD62L 表达[23],在初始及效应T细胞中,KLF2与CD62L、CCR7的表达水平正相关,而与CCR5表达负相关[7]。
因此,进一步检测ACS 患者外周血中T 细胞表面CD62L、CCR7、CXCR3 和CD44 的表达水平,发现STEMI 组、NSTEMI 组、UA组CD62L和CCR7低于对照组,而CXCR3和CD44高于对照组,并且随着ACS病变程度的加重,差异越大。结果很好地证实了本研究的猜想,KLF2缺失导致T细胞表面分子表达异常,即CD62L和CCR7等减少,而炎性趋化因子受体,如CXCR3表达增加,引起T细胞迁移模式发生改变,导致T细胞归巢减少,同时CD44的增加说明处于激活状态的T 细胞增多,而向炎症反应区域的迁移增加,进一步说明KLF2可减轻ACS的炎性反应。
本研究发现,UA组、NSTEMI组、STEMI组、对照组KLF2的表达,各组间差异均有统计学意义,并且与Gensini 评分紧密相关,进一步体现了KLF2 基因在评估冠状动脉阻塞方面的优越性。
综上所述,KLF2基因在ACS患者中显著低表达,KLF2 可通过调控T 细胞表面CD62L、CCR7、CXCR3和CD44 等水平参与ACS 的炎症反应。KLF2 在诊断ACS方面可能比心肌标志物效能更高,对于监测病情可能有辅助价值,可能成为预防冠状动脉粥样硬化的新的炎症指标。尤为重要的是,KLF2有望作为ACS的治疗靶点,值得进一步深入研究。

