Zfp212基因敲除小鼠模型的建立和雌性生殖表型研究
白 雪,刘 露,胡 月,周 帅,霍 然
南京医科大学生殖医学国家重点实验室,组织胚胎学学系,江苏 南京 211166
生长阶段的卵母细胞胞质内细胞器大量复制,RNA、蛋白质及能量物质大量积累,当卵母细胞生长至接近成熟卵子大小时,卵母细胞中的转录活动将降至非常低的水平甚至停止,此时卵母细胞完成了母源物质的积累[1-2]。随后的卵母细胞成熟、胚胎基因组激活、早期胚胎发育和胚胎细胞谱系的建立均会受到这些积累的母源物质的调控[3-4]。近年来,随着基因编辑技术的广泛应用,对于母源物质的认识逐渐深入,一些关键母源因子的缺失或表达异常会严重影响雌性生育能力及胚胎正常发育。比如,小鼠卵母细胞中积累的yes-相关蛋白(yes-associated protein,YAP)对于胚胎合子基因组的激活至关重要,利用基因编辑技术特异性敲除母源Yap后,胚胎表现出二细胞阶段的延长并且胚胎发育至四细胞的速度明显减慢[5];合子阻滞因子1(zygotearrest 1,Zar1)缺失的雌性小鼠无法正常怀孕,同时Zar1缺失的胚胎大多阻滞在一细胞期,也有部分阻滞在二细胞时期[6];热休克转录因子1(heat shock transcription factor 1,Hsf1)是较早发现的母源效应基因,母源Hsf1 的缺失同样会导致雌性不孕及合子期胚胎发育的停滞[7]。因此,揭示关键母源因子的功能对研究和解释雌性不孕及早期胚胎发育障碍至关重要。
锌指蛋白212(Zinc finger protein 212,Zfp212)是Krüppel 相关盒型锌指蛋白(Krüppel-associated box domain zinc finger protein,KZFP)家族的一员,其N 端包含一个Krüppel 相关盒(Krüppel-associated box,KRAB),C 端排列着4 个半胱氨酸-组氨酸锌指结构域。研究报道,KZFP 参与胚胎发育、细胞增殖、分化、凋亡和癌症等多种生物学过程[8],但KZFP最为人们所熟知的作用是在早期胚胎发育过程中募集KRAB-相关蛋白1(KRAB-associated protein 1,KAP1)[9]。KAP1 是小鼠和人类的KRAB 结合辅因子,它与组蛋白甲基转移酶SETDB1(SET domain,bifurcated 1)、异染色质蛋白1(heterochromatin protein 1,HP-1)、核小体重塑和脱乙酰(nucleosome remodeling and deacetylase,NuRD)复合物和DNA 甲基转移酶1、3A、3B共同组成沉默复合体[10]。因此,KZFP 通过KAP1 介导的异染色质形成和DNA 甲基化抑制转录并在胚胎表观遗传重编程过程中发挥作用[9]。
最近,Zfp212 被证明与KAP1 之间存在相互作用[11],本研究利用CRISPR/Cas9 技术成功构建Zfp212 基因敲除小鼠,并对雌性小鼠生殖表型进行了分析,探索Zfp212 是否具有母源效应,以及其在雌性生育力建立过程中是否发挥重要作用。
1 材料和方法
1.1 材料
C57BL/6 小鼠饲养在无特定病原体(specific pathogen free,SPF)条件下,饲养室温度20~22 ℃,湿度50%~70%,光照时间遵循小鼠的昼夜节律。所有小鼠实验均经南京医科大学动物管理和伦理委员会(批准编号:IACUC-1908013-1)批准。
Rapid Taq master mix、pCE2 TA/Blunt-Zero vector、HiScript ⅡQ RT SuperMix、SYBR Qpcr Master Mix(南京Vazyme 公司),AxyPrep PCR Cleanup Kit(Axgen 公司,美国),孕马血清促性腺激素(pregnant mare serum gonadotropin,PMSG)、人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)(浙江三生药业),人输卵管液(human tubal fluid,HTF)(江苏易核公司),EmbryoMax Advanced KSOM Embryo Medium(KSOM)、二氟化树脂膜(polyvinylidene fluoride,PVDF membrane)(Millipore 公司,美国),RIPA lysis buffer、蛋白酶抑制剂、磷酸酶抑制剂(康为世纪公司),化学发光试剂盒(杭州弗德生物公司),多聚甲醛(PFA)、伊红(Sigma 公司,美国),TRIzol Reagent(Invitrogen 公司,美国),苏木素(武汉Servicebio 公司),Zfp212抗体(赛默飞世尔公司),β-TUBULIN 抗体(Abclonal 公司,美国),ACTIN 抗体(Santa Cruz 公司,美国),荧光二抗Alexa FluorTM555 donkey antirabbit IgG(Invitrogen 公司,美国),HRP 标记的Goat anti-Mouse IgG(H+L)secondary antibody、HRP 标记的Goat anti-Rabbit IgG(H+L)secondary antibody,(Invitrogen公司,美国)。
1.2 方法
1.2.1 Zfp212基因敲除小鼠模型的构建
利用CRISPR/Cas9技术构建Zfp212基因敲除小鼠[12],Cas9 mRNA 由南京医科大学生殖医学国家重点实验室沈彬教授课题组提供。sgRNA 设计在Zfp212基因的2号外显子上,两条sgRNA序列如下:5′-GCCCCTCCAGGCTCTGCAGTCGG-3′和5′-TGACTTCGAGAAGACAGCTGTGG-3′。将Cas9 mRNA和sgRNA同时注射到受精卵中,然后将受精卵移植到假孕小鼠子宫内,使之继续发育,获得F0代小鼠。
1.2.2 小鼠基因型鉴定及Zfp212 纯合型缺失小鼠的获得
从基因编辑小鼠脚趾中提取DNA,利用Rapid Taq master mix、引物、双蒸水配制PCR 体系,进行目的片段扩增。将PCR 扩增产物纯化并克隆到pCE2 TA/Blunt-Zero 载体中,然后进行Sanger 测序,使用Vector NTI(11.5版)比对测序结果,确定其基因型以筛选出符合要求的基因缺失小鼠。将选定的F0代小鼠与野生型小鼠杂交以纯化背景,然后将得到的F1 代小鼠杂交,最终获得Zfp212 基因2 号外显子62 对碱基对缺失的纯合型F2代小鼠。PCR所需Zfp212 基因引物序列如下:正向引物5′-CACTGGCCTTGTCTCCTCAATC-3′、反向引物5′-CAGACGAAGGACCCAGAAGTT-3′。
1.2.3 MⅡ期卵母细胞的收集
向8~10 周龄的雌性小鼠腹腔注射5 U PMSG,46~48 h后注射5 U HCG,进行超数排卵。HCG注射后13~16 h 将膨大的输卵管壶腹剪下,在体式显微镜下使用1 mL注射器针头戳破膨大部分,释放出卵丘-卵母细胞复合物(cumulus-oocytes complex,COC),并在37 ℃下用0.5 mg/mL 透明质酸酶消化COC以释放卵母细胞,每组收取50枚MⅡ期卵母细胞蛋白,用于Zfp212蛋白表达模式验证及Zfp212蛋白敲除效率验证,每组收取20枚用于提取RNA。
1.2.4 体外受精和胚胎培养
体外受精实验前准备好获能皿、受精皿和培养皿,放置在37 ℃、5%CO2的培养箱中平衡过夜。雌性小鼠准备工作如上所述,取卵前1 h从成年雄性小鼠附睾尾收集精子并在人输卵管液(human tubal fluid,HTF)中获能1 h,然后将获能精子加入已拨入COC的受精滴中,孵育4~5 h后,将受精卵在KSOM培养液中洗去多余精子并放入培养箱中培养至囊胚期。
1.2.5 生发泡期卵母细胞和各时期胚胎的收集
取3~4 周龄的小鼠卵巢,在体式显微镜下将卵巢组织完整地从包膜中剥离出,并用l mL注射器针头扎破透亮的大卵泡,使COC 溢出至培养液中,通过反复吹吸去掉颗粒细胞,得到干净裸露的生发泡(germinal vesicle,GV)期卵母细胞。一细胞期、二细胞期、四细胞期、桑葚胚期以及囊胚期的胚胎分别在受精后12~13 h、24~25 h、46~48 h、71~72 h和96~98 h收取,卵母细胞或胚胎样本每组收取50 枚,用于蛋白表达模式验证,每组20枚用于提取RNA。
通过各个维度特征的比较分析,我们大致勾勒出一幅《政府工作报告》英译本在语体特征上的框架:高信息性,高指代性、高说服性,低叙事性,书面色彩强烈,在维度1、2、3上更接近于政府文件,而只在维度五“抽象性”上更接近备稿演讲,文本理解和阅读难度较高。而作为对等文献的《美国国情咨文》书面色彩较弱,只在维度2叙事性上接近政府文件,在维度1、3、5更近似于备稿演讲,阅读和理解难度较低,听众和读者便于抓住主要信息。两篇文献除了在抽象性维度上较为接近以外,其余四个维度的差异都较为明显。弥补了前人试图仅依靠词汇层面揭示二者文体差异的不足。
1.2.6 Western blot检测
按上述时间点收集所需数目的卵母细胞或胚胎,加入8 μL添加了1%蛋白酶抑制剂和1%磷酸酶抑制剂的增强型RIPA裂解液,2 μL 5×loading buffer,100 ℃沸水浴5 min,提取卵母细胞和胚胎蛋白。在200 V 电压下使用10%的SDS 聚丙烯酰胺凝胶分离蛋白,在300 mA 条件下将蛋白转至PVDF 膜上,使用5%脱脂牛奶在室温下将膜封闭2 h后,进行一抗(Zfp212 抗体稀释比为1∶1 000,Actin、Tubulin 抗体稀释比为1∶10 000)孵育,4 ℃孵育过夜后用TBST洗膜10 min×3 次,相应二抗(1∶5 000)室温孵育2 h后重复上述洗膜步骤,然后滴加超敏型显影液,利用化学发光成像仪曝光观察。
1.2.7 免疫荧光(immunofluorescence staining,IF)
卵母细胞或胚胎在4%多聚甲醛中室温固定30 min,然后在0.5%Triton X-100中透膜30 min,1%牛血清白蛋白中室温封闭1 h,最后在4 ℃条件下孵育一抗(Zfp212 稀释比为1∶200)过夜。用PBS 洗涤3 次洗去多余一抗,然后将卵母细胞或胚胎在相应的二抗(稀释比1∶200)中室温孵育1 h,PBS洗涤3次后用Hoechst 33342(稀释比1∶500)染核10 min,洗涤、封片并通过激光扫描共聚焦显微镜成像。
1.2.8 实时荧光定量PCR(quantitative real-time PCR,RT-qPCR)
用TRIzol 提取组织、卵母细胞或胚胎中的总RNA,并使用HiScript ⅡQ RT SuperMix 将RNA 逆转录成cDNA,NanoDrop 2000C 测定cDNA 浓度后,将cDNA 稀释至100 ng/μL,使用ChamQ Universal SYBR Qpcr Master Mix进行实时荧光定量PCR,检测基因表达情况。根据公式2-△△CT计算Zfp212mRNA表达含量。2次重复实验验证Zfp212表达模式。RTqPCR扩增引物包含以下序列:Zfp212正向引物:5′-AGAAGCTGGCTGACTTCGAG-3′,反向引物:5′-GCAGACGAAGGACCCAGAAG-3′;18s正向引物:5′-GTAACCCGTTGAACCCCATT-3′,反向引物5′-CCATCCAATCGGTAGTAGCG-3′。
1.2.9 组织学分析
8 周小鼠的卵巢组织用4%的多聚甲醛室温固定4~6 h,然后转移到梯度乙醇溶液中脱水,最后进行石蜡包埋。将石蜡包埋的卵巢块切成5 μm 的连续切片,37 ℃温水中展片,捞起展好的切片置于载玻片上,脱蜡后进行HE 染色。制片完成后进行卵巢形态学分析和卵泡计数,为了避免对同一卵泡进行多次计数,采取每隔两张取一张卵巢切片进行计数的方式,除原始卵泡外,只计数具有可见卵母细胞核的卵泡。原始卵泡、初级卵泡、次级卵泡、窦前卵泡和窦卵泡区分标准如下:原始卵泡中含有1 个卵母细胞,被鳞状颗粒细胞所包围;初级卵泡包含1 层立方型颗粒细胞;次级卵泡有1 层以上颗粒细胞,无可见窦;早期的窦状卵泡一般只有1到2个小窦腔,而窦状卵泡具有1个大窦腔,且均被多层颗粒细胞包围。卵泡计数实验进行了3次生物学重复。
1.2.10 生育力测试
3只成年Zfp212纯合型缺失的雌性小鼠与生育力正常的Zfp212 杂合型缺失雄性小鼠交配6 个月,同时将3只Zfp212杂合型缺失雌性小鼠与Zfp212杂合型缺失雄性小鼠作为对照组进行配繁,记录并统计每窝幼崽的数量和出生日期。
1.3 统计学方法
实验数据利用GraphPad Prism 8.0.2 进行统计分析,除Zfp212 mRNA表达模式数据为均数外,其他定量数据均用均数±标准误(x±Sx)表示,使用t-检验进行组间数据比较,P<0.05为差异有统计学意义。
2 结果
2.1 Zfp212在卵母细胞及早期胚胎中的表达模式
为观察Zfp212的表达模式,提取小鼠不同组织和细胞的总RNA 并反转录为cDNA,调整cDNA 浓度至100 ng/μL后进行RT-qPCR。结果显示,Zfp212在生殖系统中高表达,特别是在雌性小鼠的卵巢和生殖细胞中。为了确定Zfp212 在卵母细胞成熟和早期胚胎发育中的时空表达情况,在生殖细胞及胚胎发育的多个时间点收样并进行RT-qRCR 定量,结果显示Zfp212 mRNA 在GV 期卵母细胞、MⅡ期卵母细胞和受精卵中均高表达,而在随后的二细胞期至囊胚阶段表达明显下降(图1A);Western blot 结果显示Zfp212 蛋白主要在MⅡ期卵母细胞中高表达(图1B);免疫荧光染色分析了Zfp212 在卵母细胞及各时期胚胎中的定位,结果显示,GV期卵母细胞中Zfp212 蛋白主要定位在细胞核和细胞质中,在MⅠ和MⅡ期卵母细胞中Zfp212 主要定位于纺锤体上,而在受精后至四细胞期几乎观察不到Zfp212 蛋白荧光定位,直至八细胞期,Zfp212蛋白重新表达并定位在胚胎的细胞质中(图1C、D)。综上所述,发现Zfp212的表达模式符合母源基因表达特性,因此推测Zfp212可能作为母源因子在卵母细胞成熟或早期胚胎发育过程中发挥作用。
2.2 构建Zfp212基因敲除小鼠
为进一步探究Zfp212 在体内是否发挥作用及其作用机制,以小鼠作为研究模型,借助CRISPR/Cas9 技术[13-14]构建了Zfp212 基因敲除小鼠(图2A、B)。利用核酸凝胶电泳和Sanger 测序方法鉴定Zfp212敲除小鼠的基因型(图2C),并提取了Zfp212纯合型缺失(Zfp212-/-)小鼠的卵母细胞蛋白,通过Western blot 检测ZFP212 蛋白的敲除效率(图2D),结果显示ZFP212 蛋白在Zfp212-/-小鼠中被成功清除,Zfp212基因敲除小鼠构建成功。
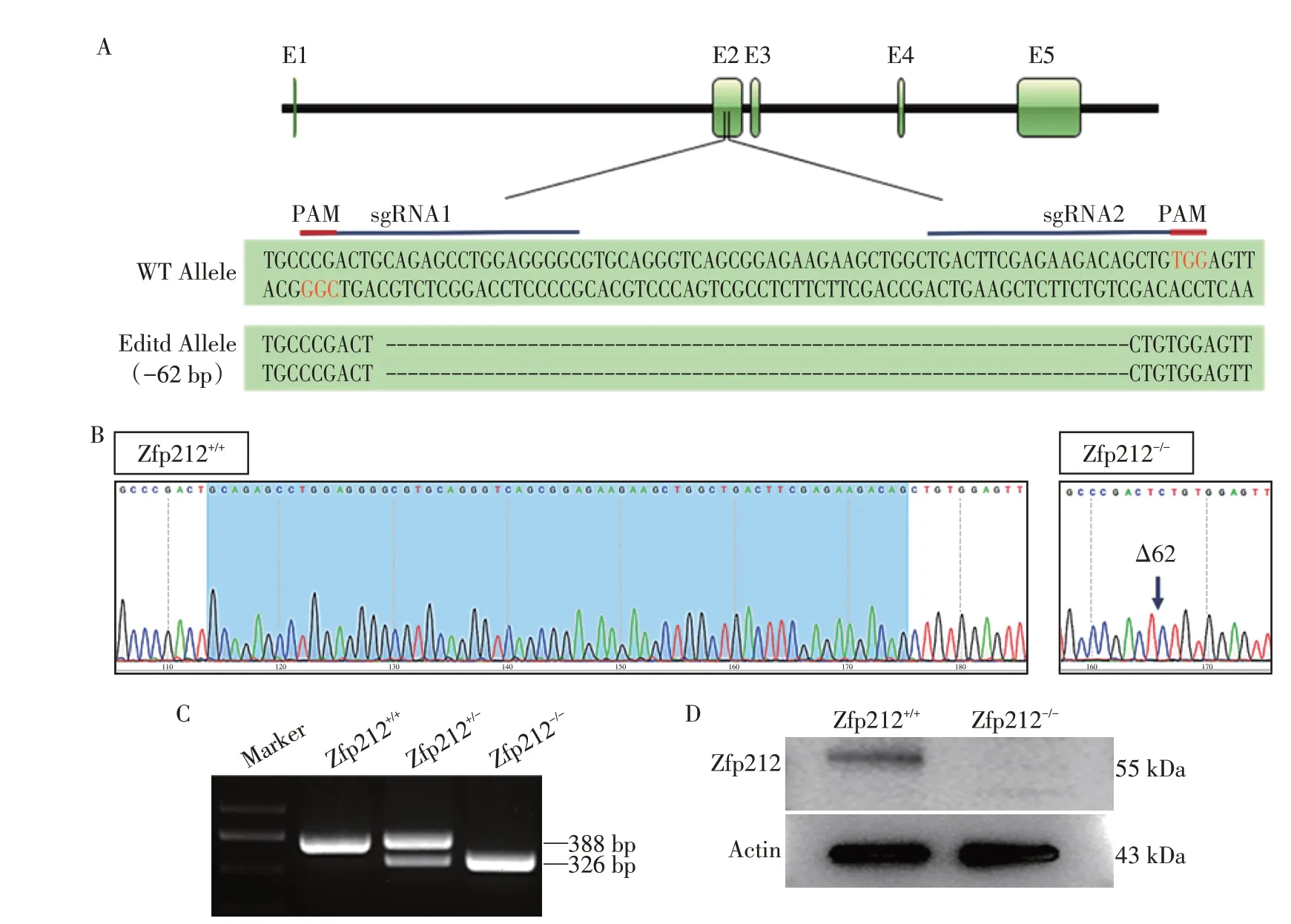
图2 Zfp212基因敲除小鼠模型的构建Figure 2 Generation of Zfp212 knockout mice
2.3 Zfp212-/-雌性小鼠生殖表型分析
2.3.1 卵巢及卵泡发育情况
为观察Zfp212 基因敲除雌性小鼠的卵泡发育情况,收取8 周龄雌性小鼠的卵巢进行形态学分析和卵泡计数。首先,通过形态学分析比对,发现8周龄Zfp212-/-雌性小鼠与对照组小鼠的卵巢形态、大小相比,差异无统计学意义(P>0.05,n=3,图3A、B);通过卵巢切片和HE 染色分析小鼠卵泡发育情况,卵泡计数结果显示Zfp212-/-小鼠各时期卵泡(原始卵泡、初级卵泡、次级卵泡、早窦和窦状卵泡)数量与对照组小鼠卵泡数量差异无统计学意义(P>0.05,n=3,图3C、D)。由此证实,Zfp212基因敲除不影响雌性小鼠的卵泡发育。
2.3.2 卵母细胞成熟及早期胚胎发育情况
为进一步观察Zfp212-/-雌性小鼠的卵母细胞能否正常成熟并排卵,利用8 周龄的雌性小鼠进行超数排卵实验,结果显示实验组和对照组小鼠均可排出成熟的卵母细胞(MⅡ期卵母细胞),统计超排卵的数量后发现,Zfp212-/-小鼠的排卵数量与对照组相比,差异无统计学意义(P>0.05,n=4,图3E);对排出的MⅡ期卵母细胞进行体外受精和植入前胚胎培养实验,进而观察其受精和早期胚胎发育情况,经统计,Zfp212 基因缺失不影响卵母细胞正常受精及植入前胚胎发育(P>0.05,n=3,图4A、B)。综上所述,Zfp212 基因敲除不影响小鼠的卵母细胞成熟和早期胚胎发育。
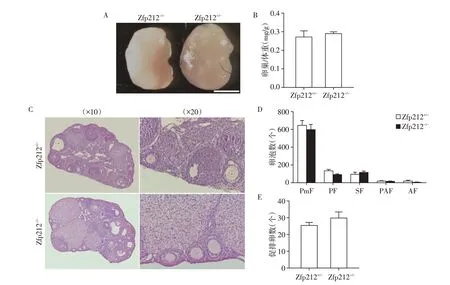
图3 Zfp212 敲除雌性小鼠生殖表型分析Figure 3 Analysis of the reproductive phenotype of Zfp212 knockout female mice
2.3.3 Zfp212-/-小鼠生育能力测试
将3 只8 周龄的Zfp212-/-雌性小鼠配繁6 个月,并取3 只Zfp212+/-雌性小鼠作为对照,统计其生仔情况。结果显示Zfp212-/-组与对照组的每窝产仔数相比,差异无统计学意义(P>0.05,n=3,图4C)。上述实验结果显示,Zfp212 敲除未影响雌性小鼠的生育能力。

图4 Zfp212敲除小鼠植入前胚胎发育及生育力测试Figure 4 Development of preimplantation embryos and fertility test in Zfp212 knockout mice
3 讨论
母源因子被证实在受精、表观遗传重编程、减数分裂到有丝分裂的过渡和早期胚胎发育等生物学事件中发挥着关键作用[3,15]。研究发现,部分KZFP 作为母源因子在早期胚胎发育和雌性生育力建立过程中扮演重要角色。哺乳动物母源效应基因锌指蛋白57(Zinc finger protein 57,Zfp57)是KZFP 家族成员之一,它通过识别、结合印记控制区(imprinting control regions,ICR),并招募KAP1 和其他的染色质诱导蛋白,驱动ICR 的甲基化[16],Zfp57缺失后导致多个ICR的DNA甲基化缺失,最终导致妊娠中期的胚胎死亡[17-18];但Zfp57 缺失后一些位点的甲基化水平并未受到影响,进一步探索后,研究人员发现另一KZFP——锌指蛋白445(Zinc finger protein 445,Zfp445),其与Zfp57 在维持部分ICR 甲基化中起协同作用,在Zfp57 缺失的情况下,Zfp445是维持这部分ICR 甲基化所必需的[19]。锌指蛋白708(Zinc finger protein 708,Zfp708)是一个母源性KZFP,其通过将抑制性KAP1 复合物募集到逆转录转座子RMER19B上,引起区域异染色质形成,虽然Zfp708敲除小鼠的生育能力未受影响,但却无法维持Zfp708靶位点的甲基化水平,并且会产生RMER19B相邻基因的激活现象[10]。此外,KAP1 在胚胎发育及雌性生育力建立中也发挥着重要作用,母源KAP1 的缺失会导致严重的表观遗传变异,从而导致胚胎致死[20],且已有研究表明,母源性表达的KZFP 可能是KAP1 的候选靶蛋白。因此本研究探究了以前未有过功能表征的KZFP——Zfp212,基于其母源表达模式以及既往已有的其与KAP1相互作用的研究报道,推测Zfp212 可能与KAP1 形成KZFP/KAP1复合体,在卵母细胞到早期胚胎发育中发挥特异性功能。
本研究首先通过RT-qPCR、Western blot和IF实验检测Zfp212在多组织或细胞中的表达情况,结果显示Zfp212 在生殖系统和雌性生殖细胞中优势表达,且其表达模式符合母源调控因子表达特征,据此,推测Zfp212 可能作为母源蛋白,在卵母细胞成熟或早期胚胎发育过程中发挥着重要作用。为探究其体内功能,利用CRISPR/Cas9技术,针对Zfp212基因的2 号外显子设计sgRNA,并利用DNA 测序和Western blot实验在不同分子水平上验证敲除效率,结果显示成功获得Zfp212 敲除小鼠。Zfp212-/-小鼠生长发育正常,同时,本研究对Zfp212-/-雌性小鼠的卵巢重量和形态进行观察测量,结果显示其与对照组相比没有明显差异;随后观察了对雌性生育力至关重要的几个生物学事件,包括卵泡发育、卵母细胞成熟和排卵、受精及早期胚胎发育,一系列实验结果显示在Zfp212-/-雌性小鼠体内,这些关键的生物学事件均可正常发生,并且与对照组相比无显著性差异;生育力测试结果显示Zfp212-/-雌性小鼠可正常生育后代,并且产仔数量与对照组无明显差异。因此得出结论,Zfp212 缺失不影响雌性小鼠的生育能力。
虽然Zfp212 在雌性生殖系统中高表达,但Zfp212 敲除小鼠呈现出可育表型,可能的解释是Zfp212 是一个功能冗余基因,基因冗余意味着两个或多个基因执行相同的功能,并且这些基因中的某个基因失活对生物表型影响很小或者没有影响。比如,NLR 家族pyrin 结构域蛋白9a/b/c(NLR family pyrin domain containing 9a/b/c,Nlrp9a/b/c)在卵母细胞内均有表达,在体外培养条件下,Nlrp9a/b/c 同时突变后胚胎阻滞在二细胞阶段,并且伴随细胞的不对称分裂,但任意两个Nlrp9基因突变不会发生二细胞阻滞现象,说明Nlrp9a/b/c间存在功能冗余[21]。由于KZFP 家族成员数量庞大,因此推测其家族成员间存在功能冗余;另一方面,如前所述,Zfp708缺失虽不影响雌性小鼠的生育能力,但其与KAP1 协同调节的表观遗传修饰受到严重影响[10],已有研究表明在体细胞中Zfp212与KAP1之间也存在相互作用[11],但目前尚未在卵细胞中验证Zfp212与KAP1是否相互作用,以及是否可能协同调控表观遗传修饰。因此,需要进一步探索Zfp212 与KAP1 是否存在相互作用,及其对表观遗传修饰的影响,并通过转录组及蛋白质组分析等手段,探索Zfp212 缺失是否导致其他KZFP 家族成员代偿性表达,或与其他KZFP 协同作用,并进一步探索是否存在其他功能未被揭示的KZFP 在卵母细胞成熟和早期胚胎发育中发挥作用。

