MiR-484通过靶向MAPK8抑制人前体脂肪细胞的增殖与分化
仲逢钰,秦振英,李 婧,田 甜,牟雨虹,田慧琴,胡幼芳
南京医科大学第一附属医院儿童保健科,江苏 南京 210029
世界卫生组织报道,自1975 年以来,全球肥胖人数几乎增加了两倍,现共有6 000 万5 岁以下儿童患上肥胖症,肥胖已成为一个严重的公共健康问题[1]。肥胖以脂肪大量堆积为特征,并可导致多种代谢紊乱相关疾病的发生,如2型糖尿病、非酒精性脂肪肝和心血管疾病[2-3]。脂肪组织不仅是储能器官,为人体的生命活动提供能量,也是人体重要的内分泌器官,可分泌多种细胞因子,具有重要生理功能[4-5]。然而,由于能量摄入与消耗的不平衡,大量能量以甘油三酯的形式储存,脂肪组织迅速膨胀,脂肪组织的扩张将导致炎性细胞因子分泌增加,并减少瘦素和脂联素等抗炎蛋白的分泌,从而导致代谢紊乱[6-7]。因此,深入研究脂肪组织的生成代谢对降低肥胖发生率具有重要意义。
脂肪生成是一个复杂的过程,与多种转录因子的动态表达有关。前体脂肪细胞的增殖和分化增加成熟脂肪细胞的数量,促进了甘油三酯的储存、代谢,并产生脂肪因子[8]。微小核糖核酸(microRNA,miRNA)是一类内源性非编码单链RNA(18~24核苷酸),通过与靶mRNA的3′非翻译区(3′UTR)特异性结合,在转录后水平负调控基因表达[9]。一些研究表明,miRNA 可能和脂肪细胞的分化增殖发生相关。例如,Chen等[10]发现miR-146b是人内脏前脂肪细胞增殖和分化的调节因子,其表达在人体内发生改变。miR-130b 可以靶向过氧化物酶体增殖物活化受体γ(peroxisome proliferator activated receptor γ,PPARγ)抑制猪脂肪沉积[11]。既往研究发现miR-484 在肥胖妇女或儿童的脂肪组织中差异表达[9,12],同时其表达与组织缺血再灌注损伤[13]、宫颈癌肿瘤发生[14]、肝硬化[15]等有关。然而,miR-484在肥胖中的作用仍不清楚。本研究通过在人前体脂肪细胞(human preadipocytes,HPA)中过表达及沉默miR-484,研究其对HPA细胞增殖及成脂分化的影响,在细胞层面揭示miR-484对肥胖的作用,并探讨了其下游作用的可能靶基因,以期为肥胖的防治提供一个新靶点。
1 材料和方法
1.1 材料
1.2 方法
1.2.1 细胞培养与质粒转染
培养板中按1×105个/mL接种HPA(Science Cell公司,美国),在37 ℃、5%CO2孵箱中,以含5%胎牛血清的人脂肪细胞培养基培养,每2 d换液1次,待细胞贴壁生长至完全融合并接触抑制2 d后(第0天)开始诱导分化。具体步骤为:培养基换用DMEM 高糖培养基,其中含0.5 mmol/L MIX、1 μmol/L地塞米松、5 μg/mL胰岛素和1 μmol/L罗格列酮,培养4 d。随后分化培养基中撤去MIX、地塞米松、罗格列酮,使DMEM高糖培养基中只含有5 μg/mL胰岛素。后每3 d 换液1 次,直至第15 天,约85%以上的细胞已分化为成熟人脂肪细胞。为了评价miR-484对HPA增殖和分化的影响,采用Lipofectamine 3000对细胞转染miR-484 mimic、miR-484 inhibitor、MAPK8 过表达质粒及其阴性对照。
1.2.2 CCK-8实验
为了研究HPA的增殖能力,使用CCK-8检测试剂盒在0 h、24 h、48 h 这3 个不同的时间点进行检测。使用10 μL CCK-8 溶液处理接种在96 孔板中(5×103个/mL)的脂肪细胞,孵育细胞2 h 后,使用分光光度仪测定其450 nm处吸光度值。
1.2.3 油红O染色
油红O 染色在室温下进行,取诱导分化成熟的人脂肪细胞(第15 天),用PBS 洗涤细胞3 次,后在10%多聚甲醛中固定1 h,吸取出固定液后晾干。油红O 溶解于异丙醇中,配成3 mg/mL的染液并过滤,随后加入晾干的细胞中染色1 h。最后,用PBS轻轻洗涤细胞,倒置显微镜观察,镜下脂滴应成亮红色。
1.2.4 细胞甘油三酯含量测定
细胞接种于6 孔板中,取分化成熟的人脂肪细胞(第15 天),PBS 轻柔洗涤细胞1 次后用胰酶消化细胞,收集细胞于离心管中,根据甘油三酯测定试剂盒说明书,加入100 μL裂解液,室温裂解10 min,留取20 μL 裂解液进行BCA 法蛋白定量,70 μL 裂解液70 ℃加热10 min后离心取上清,使用分光光度仪在510 nm处测量细胞裂解物中甘油三酯的含量,测定结果用总蛋白浓度校准。
1.2.5 靶基因测定与验证
(2)辅助材料成本。报废的动力电池需要用酸、碱、有机溶剂、沉淀剂等进行处理,回收的工艺不同以及最后产品的不同,所使用的辅助材料也有所不同。
利用在线数据库Targetscan7.2(http://www.targetscan.org/vert_72/)对miR-484 的靶基因及潜在的结合位点进行了预测。使用DAVID 6.7在线数据库(https://david.ncifcrf.gov/)进行基因本体(Gene Ontology,GO)分析、KEGG(Kyoto Encyclopedia of Genes and Genomes)富集分析。为了验证结合位点,构建了荧光素酶报告质粒MAPK8 的野生型和突变型。将293T 细胞接种到24 孔板中,以含10%胎牛血清的DMEM 培养基培养。当细胞密度达到70%时,将野生型或突变型质粒与miR-484 mimic 及miR-484 mimic NC 共转染到293T 细胞中。24 h 后使用双荧光素酶报告分析试剂盒测量荧光素酶活性。
1.2.6 RT-qPCR检测
使用TRIzol法提取细胞的总RNA,使用TaKaRa反转录试剂盒进行mRNA 和miRNA 的逆转录,用SYBR Premix Ex Taq试剂盒(TaKaRa)进行定量实时聚合酶链反应。使用2-ΔΔCT法计算mRNA和miRNA的相对表达水平。β-actin用作mRNA的内部标准化对照,U6用作miRNA的内部标准化对照。qRT-PCR检测中使用的引物序列见表1。

表1 实时定量PCR目的基因的引物Table 1 The sequences of the primers for RT-qPCR
1.2.7 Western blot实验
用RIPA法提取细胞蛋白,BCA法测定蛋白浓度后加入上样缓冲液,将蛋白样品的浓度定为20 ng/mL,在100 ℃金属浴煮沸10 min 变性。采用10%SDS/PAGE 凝胶和聚偏氟乙烯膜分离及转移蛋白,将膜在室温下用5%牛奶封闭1 h后,与适当稀释的特异性抗体(MAPK8、β-actin)一起4 ℃孵育过夜,TBST洗涤膜3 次,然后加入二抗,在摇床中孵育1 h。最后用超敏ECL化学发光试剂检测曝光蛋白条带。
1.3 统计学方法
采用SPSS 23.0 软件进行统计分析。定量资料以均数±标准差()表示,3组独立样本之间的差异采用重复测量方差分析检验,当3 组独立样本间的差异有统计学意义时,SNK 法进行组间两两比较。采用Graphpad Prism 绘制直条图、复式直条图、线图等。P<0.05为差异有统计学意义。
2 结果
2.1 miR-484 在HPA 分化过程中的表达及其过表达验证
为了验证HPA 分化过程中miR-484 的表达情况,分别取分化第0天、第4天、第8天、第15天的细胞,使用RT-qPCR 技术检测,结果与未分化的细胞(第0 天)相比,随着分化的进行,miR-484 表达量逐渐降低(P<0.05),表明miR-484可能参与HPA的分化(图1A)。此外,为了验证miR-484过表达体系的建立,在HPA中转染了miR-484及其空白质粒,通过RT-qPCR发现miR-484表达较对照组及mimic NC组增高(P<0.05,图1B)。
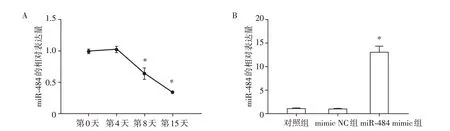
图1 miR-484在HPA分化过程中的表达及其过表达验证Figure 1 Relative expression of miR-484 in HPA and overexpression validation of miR-484
2.2 过表达miR-484抑制HPA增殖分化
为了进一步了解过表达miR-484对脂肪生成的作用,将miR-484 mimic及miR-484 mimic NC分别转染至HPA 中。CCK-8 实验检测转染后0 h、24 h 及48 h HPA的增殖能力,发现与对照组及mimic NC组相比,miR-484 mimic组在24 h及48 h的吸光度值降低(P<0.05,图2A)。同时对细胞周期相关基因Cyclin D1、Cyclin D3 和CDK4 的mRNA 相对表达量进行了检测,RT-qPCR 实验发现miR-484 mimic 组的细胞周期相关基因表达量均减少(P<0.05,图2B),由此可见,过表达miR-484可以抑制HPA的增殖。
为了研究miR-484 对HPA 成脂分化的影响,在HPA中过表达miR-484后,对分化第15天的成熟人脂肪细胞进行油红O染色,镜下观察发现,与对照组及mimic NC 组相比,miR-484 mimic 组脂肪细胞脂滴数量及体积明显减少(图2C),也对脂肪分化相关基因PPAR γ、C/EBP α和FABP4 的mRNA 相对表达量进行了检测,RT-qPCR 实验发现miR-484 mimic组的脂肪分化相关基因表达量均减少(P<0.05,图2D)。同时,甘油三酯定量测定发现与对照组及mimic NC组相比,miR-484 mimic组的甘油三酯含量减少(P<0.05,图2E)。这表明过表达miR-484可以抑制HPA向成熟脂肪细胞分化。
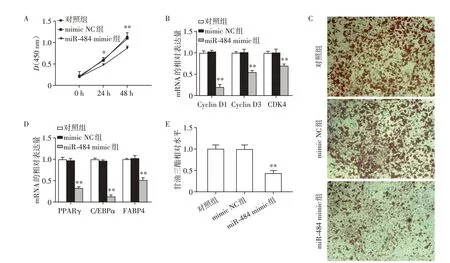
图2 miR-484抑制HPA的增殖分化Figure 2 miR-484 inhibits HPA proliferation and differentiation
2.3 沉默miR-484促进HPA的增殖分化
为了进一步了解沉默miR-484对脂肪生成的作用,将miR-484 inhibitor及miR-484 inhibitor NC分别转染至HPA中。CCK-8实验检测转染后0 h、24 h及48 h HPA的增殖能力发现,与对照组及inhibitor NC组相比,miR-484 inhibitor组在24 h及48 h的吸光值升高(P<0.05,图3A)。同时对细胞周期相关基因Cyclin D1、Cyclin D3 和CDK4 的mRNA 相对表达量进行了检测,RT-qPCR实验发现miR-484 inhibitor组的增殖相关基因表达量均升高(P<0.05,图3B),由此可见,沉默miR-484可以促进HPA的增殖。
为了研究沉默miR-484 对HPA 成脂分化的影响,在脂肪细胞中沉默miR-484 后,对分化第15 天的成熟人脂肪细胞进行油红O染色,镜下观察发现,与对照组及inhibitor NC组相比,miR-484 inhibitor组脂肪细胞脂滴数量及体积增加(图3C),也对脂肪分化相关基因PPAR γ、C/EBP α和FABP 4的mRNA相对表达量进行了检测,RT-qPCR 实验发现miR-484 inhibitor 组的脂肪分化相关基因表达量均升高(P<0.05,图3D)。同时甘油三酯定量测定发现与对照组及inhibitor NC组相比,miR-484 inhibitor组的甘油三酯含量增加(图3E,P<0.05)。这表明沉默miR-484可以促进HPA向成熟脂肪细胞分化。
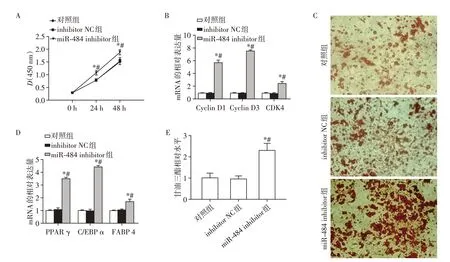
图3 沉默miR-484促进HPA的增殖分化Figure 3 miR-484 inhibitor promotes HPA proliferation and differentiation
2.4 miR-484靶向作用于MAPK8
miRNA 可以与mRNA 的3′UTR 区结合沉默靶基因的表达,从而发挥重要的生物学功能。通过在线生物信息学分析预测发现,MAPK8 可作为miR-484的靶基因(图4A)。为了进一步验证miR-484 是否可与MAPK8 的3′UTR 区结合,本研究构建了MAPK8 的突变型(MAPK MUT)与野生型(MAPK WT)质粒,并进行了双荧光素酶报告基因分析,结果表明,与mimic NC 组相比,miR-484 mimic 与MAPK8 WT 共转组的相对荧光活性降低(图4B,P<0.05),表明miR-484可与野生型MAPK8结合,由此可见,MAPK8可以与miR-484结合,可作为miR-484的靶基因。
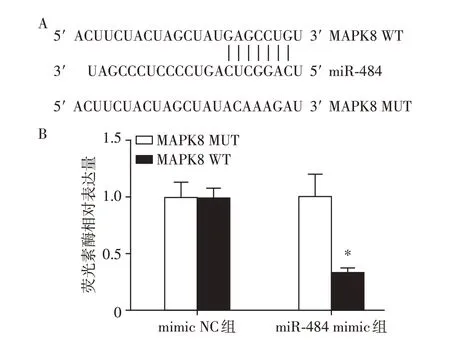
图4 miR-484 靶向作用于MAPK8Figure 4 miR-484 targets MAPK8
2.5 miR-484抑制MAPK8的mRNA及其蛋白表达
为了进一步验证miR-48对其靶基因MAPK8的作用,本研究在脂肪细胞中过表达miR-484,qRT-PCR和蛋白免疫印迹检测结果显示,与对照组及mimic NC 组相比,过表达miR-484 显著下调了脂肪细胞中MAPK8 的mRNA 和 蛋 白 水 平(图5,P<0.05)。这表明miR-484可以抑制MAPK8的表达。

图5 miR-484抑制MAPK8的mRNA及其蛋白表达Figure 5 The expression of MAPK8 was down-regulated by miR-484
2.6 过表达MAPK8部分挽救miR-484对HPA增殖分化的抑制作用
为了进一步研究miR-484 是否确实通过其靶标MAPK8 发挥功能,本研究将miR-484 mimic 与MAPK8 mimic 质粒共转染进HPA 细胞。通过CCK-8实验检测转染后0 h、24 h及48 h HPA细胞的增殖能力发现,与miR-484 mimic 相比,共转染组24 h 及48 h 吸光度升高(P<0.05,图6A)。对细胞周期相关基因Cyclin D1、Cyclin D3和CDK4的mRNA相对表达量进行检测,发现MAPK8 与miR-484 共转部分逆转了miR-484引起的相关基因表达量的下降(P<0.05,图6B)。由此可见,MAPK8 可以逆转miR-484抑制HPA细胞增殖的作用。对分化第15天的成熟人脂肪细胞进行油红O染色,镜下观察发现,MAPK8 逆转了过表达miR-484 引起的脂肪细胞脂滴数量及体积的减少(图6C),对脂肪分化相关基因PPAR γ、C/EBP α和FABP 4的mRNA 相对表达量进行检测,发现MAPK8 可以逆转miR-484 引起的脂肪分化相关基因表达量的下降(P<0.05,图6D)。甘油三酯定量测定,发现MAPK8 逆转了过表达miR-484 引起的甘油三酯含量下降(图6E,P<0.05)。这表明过表达MAPK8 可以逆转miR-484 抑制HPA增殖分化的作用。
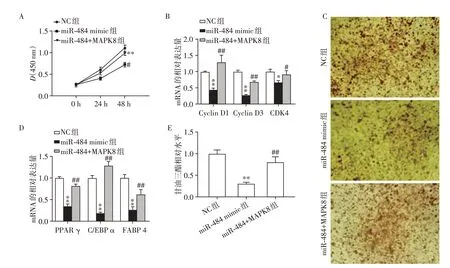
图6 过表达MAPK8部分挽救miR-484对HPA增殖分化的抑制作用Figure 6 Overexpression of MAPK8 partially rescued the function of miR-484 on HPA proliferation and differentiation
3 讨论
miRNA是调节基因表达的非编码小RNA,在不同组织或器官中都发挥重要作用,它在脂肪组织中的主要功能是调节脂肪细胞的增殖、分化、代谢和内分泌[16]。大量研究表明,肥胖与miRNA 的失调密切相关,miRNA表达的改变可能导致控制一系列生物功能的基因表达模式的改变,包括炎症、胰岛素敏感性和脂肪生成[17]。miR-484差异表达于肥胖人群,但是miR-484 对脂肪细胞的生物学功能的影响尚不清楚。本研究发现miR-484在HPA分化过程中表达逐渐降低,暗示了miR-484可能与肥胖发生相关,同时也可能是脂肪分化与形成过程的重要靶点。
抑制脂肪组织的脂肪生成是肥胖发生过程中的一个中心事件,而脂肪细胞增殖和分化是脂肪组织中脂质积累的基础,可由多种因素调节[18]。控制脂肪的分化及增殖可以抑制肥胖和肥胖相关疾病的发生。本研究表明miR-484与HPA细胞的增殖及细胞周期调节基因Cyclin D1、Cyclin D3 和CDK4 表达成负相关。细胞周期蛋白(Cyclin D1、Cyclin D3)和细胞周期蛋白依赖性激酶(CDK4)被认为是真核生物中细胞生长和增殖的关键调节因子,这是哺乳动物细胞中G1/S和G2/M转变所必需的。Liu等[19]研究表明miR-484通过靶向CCL-18抑制胃癌细胞的增殖。Xie等[20]发现lncRNA ZFAS1 通过沉默miR-484来促进结肠癌细胞的增殖。这些研究与本研究结果相一致。同时,本研究也发现miR-484 与脂肪分化基因PPARγ、C/EBPα 和FABP4 表达呈负相关。PPARγ和C/EBPα是脂肪分化过程中发挥核心作用的转录因子,FABP4 促进脂肪酸增溶、运输和新陈代谢。本研究进一步对HPA 进行了油红O染色和甘油三酯检测,发现miR-484 与脂滴生成负相关。因此认为miR-484 可以调控脂肪细胞的分化和增殖。
本研究中也对miR-484抑制HPA增殖与分化的机制进行了探讨。miRNA 是内源性小RNA,通过与蛋白质编码基因的mRNA 配对来指导其转录后抑制,从而发挥重要的基因调节作用。通过在线生信分析发现MAPK8可能是miR-484的靶基因,并通过双荧光素酶报告实验确认了miR-484 与MAPK8具有相应的结合位点,同时过表达miR-484 可以抑制MAPK8的表达。MAPK8 是蛋白丝裂激酶家族的成员,充当多种生物化学信号的集成点,如胰岛素信号通路,并且涉及各种细胞过程,例如增殖、分化、转录调控和发育[21-22]。Osawa 等[23]发现MAPK8与胰岛素抵抗相关,MAPK8 活性在肥胖的胰岛素抵抗小鼠中增加,而敲除MAPK8的小鼠显示肥胖减少和胰岛素敏感性提高。本研究过表达MAPK8,发现其可以逆转过表达miR-484抑制HPA细胞增殖及分化的作用。结合既往研究及本研究结果,MAPK8可能是miR-484的靶基因。
综上所述,本研究发现miR-484在HPA分化过程中低表达,并通过进一步的功能实验,证实了miR-484抑制HPA 的增殖与分化,该作用可能是通过靶向MAPK8 来实现。本研究也存在一些缺点,例如miR-484 预测的相关靶基因较多,我们只关注了MAPK8,因为其属于胰岛素信号通路,且相关研究表明其与肥胖相关,后期仍需采取转录组学等手段进一步研究相关机制。因此,本研究结果提示miR-484在肥胖中发挥关键作用,miR-484可能是肥胖诊断与治疗的一个靶点。

