右美托咪定对氧糖剥夺再复氧下Huvecs的保护机制*
姚浩旗,汪惠文,王公孝,杨天德,陈 建
(1.联勤保障部队第九四〇医院麻醉科,兰州 730050;2.重庆医科大学第三附属医院麻醉科 401120;3.陆军军医大学高原军事医学系,重庆400038)
右美托咪定(DEX)是高选择性的α2 受体激动剂[1],近期研究发现其有减轻器官缺血再灌注损伤的作用[2-3]。而本课题组前期实验研究发现DEX预处理可以减轻人脐静脉内皮细胞(Huvecs)在氧糖剥夺再复氧条件下的损伤[4],但具体的细胞内分子机制还有待于进一步深究。为此本研究拟在前期研究的基础上探究DEX预处理对Huvecs的保护机制。
1 材料与方法
1.1 细胞培养
人脐静脉内皮细胞株Huvecs(由陆军军医大学高原军事医学系赠)复苏后培养于含10%胎牛血清的高糖培养基内,置于37 ℃、5% CO2培养箱中贴壁培养。当细胞约80%融合时,用0.05%胰蛋白酶消化传代培养。
1.2 试剂药物
DEX:江苏恒瑞制药有限公司;高糖培养基 (DMEM)、胎牛血清:美国Gibico公司;α2 受体激动剂抑制剂育亨宾(YHB):上海阿拉丁生化科技股份有限公司;山羊抗兔IgG:上海碧云天生物科技公司。β-actin:上海贝博生物,BB-2101;AMP依赖的蛋白激酶α(AMPKα)、磷酸化AMPKα(p-AMPKα)一抗:德国CST公司。Seahorse能量分析试验材料:海马生物科技有限公司。
1.3 仪器设备
二氧化碳细胞培养箱(美国Themofisher Scientific公司);Seahorse细胞能量代谢实时测定仪(美国Agilent公司);电泳仪、全自动酶标仪化学发光曝光仪(美国Bio-Rad公司)。
1.4 分组
取对数生长期的细胞消化后接种于直径3.5 cm培养皿或 Seahorse检测板中培养。实验分2部分,氧糖剥夺前细胞分3组:对照组(NC组)、DEX组、DEX+YHB组。DEX+YHB组加入50 μmol/L的DEX和100 μmol/L YHB处理细胞2 h,DEX组加入50 μmol/L的DEX处理细胞2 h。氧糖剥夺再复氧后细胞分4组:对照组(NC组)、ogd/r组、DEX+ogd/r组、DEX+YHB+ogd/r组。DEX+ogd/r组加入50 μmol/L的DEX预处理2 h,DEX+YHB+ogd/r组加入50 μmol/L的DEX和100 μmol/L YHB处理2 h,ogd/r组加入等体积的PBS,随后将3组细胞置于Hank′s液中于缺氧恒温细胞培养箱内培养12 h,之后换正常培养基置于常氧恒温培养箱内培养4 h,NC组置于正常条件下培养18 h。
1.5 Western blot检测氧糖剥夺再复氧处理前、后各组AMPKα磷酸化水平
每组设置3个复孔,将对数生长期细胞接种于直径3.5 cm的培养皿内,实验处理后提取各组细胞蛋白进行Western blot检测。
1.6 细胞线粒体呼吸功能的Seahorse检测
每组设置5个复孔,将对数生长期的细胞用胰蛋白酶消化后,接种于Seahorse检测板中,进行线粒体呼吸功能检测,具体方法参考胡洸瑜等[5]研究。
1.7 统计学处理
2 结 果
2.1 DEX提高常氧条件下Huvecs AMPKα磷酸化水平
用Western blot检测氧糖剥夺前Huvecs p-AMPKα水平。与NC组相比,DEX组AMPKα磷酸化水平升高(NC组:2.762 5±0.929 0;DEX组:4.542 6±0.718 5;n=3,P<0.05);与DEX组相比,DEX+YHB组AMPKα磷酸水平降低(DEX组:4.542 6±0.718 5;DEX+YHB组:2.827 7±0.054 5;n=3,P<0.05),见图1。

图1 DEX提高常氧条件下Huvecs AMPKα磷酸化水平
2.2 DEX预处理提高Huvecs常氧条件下线粒体呼吸功能
通过Seahorse 实验检测各处理组线粒体的呼吸能力。与NC组相比,DEX组线粒体基础氧气消耗速率、三磷酸腺苷(ATP)生成水平和最大氧气消耗速率升高(NC组:60.770 2±11.393 8、36.806 8±6.127 1、95.914 3±17.298 9;DEX组:78.780 7±19.516 3、48.533 1±14.164 3、128.474 5±9.469 5;n=5,P<0.05);与DEX组相比,DEX+YHB组Huvecs线粒体基础氧气消耗速率、ATP生成水平和最大氧气消耗速率均下降(DEX组:78.780 7±19.516 3、48.533 1±14.164 3、128.474 5±9.469 5;DEX+YHB组:72.629 6±8.288 1、42.727 9±10.884 8、114.085 0±10.886 5;n=5,P<0.05),见图2~4。

图2 DEX预处理提高Huvecs的最大呼吸速率

图3 DEX预处理提高Huvecs的基础呼吸速率
2.3 各组AMPKα分子的磷酸化水平
与NC组相比,12 h的氧糖剥夺,4 h的再复氧可以使Huvecs内部p-AMPKα水平升高(NC组:10.503 9±2.479 6,ogd/r组:16.216 9±0.883 2,n=3,P<0.05);与ogd/r组相比,DEX+ogd/r组AMPKα水平显著升高(ogd/r组:16.216 9±0.883 2,DEX+ogd/r组:33.435 7±8.866 6,n=3,P<0.05);与DEX+ogd/r组相比,DEX+YHB+ogd/r组p-AMPKα水平降低(DEX+ogd/r组:33.435 7±8.866 6,DEX+YHB+ogd/r组:21.729 6±7.406 5,n=3,P<0.05),见图5。

图4 DEX预处理提高Huvecs ATP的生成水平
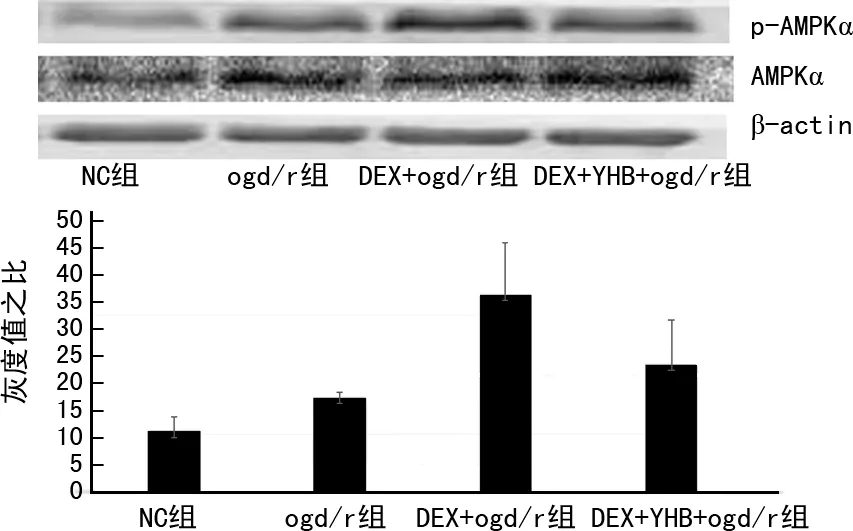
图5 DEX提高氧糖剥夺再复氧条件下Huvecs AMPKα 磷酸化水平
3 讨 论
目前的研究证实DEX预处理对Huvecs具有保护作用[4],而在体实验结果发现DEX可以激活AMPK发挥其在心肌缺血再灌注损伤中的抗氧化应激作用[6],本研究在这些研究基础上,进一步发现了其对Huvecs的保护机制。本研究发现,相对于ogd/r组来说,DEX+ogd/r组Huvecs的p-AMPKα水平上升;相对于DEX+ogd/r组来说,DEX+YHB+ogd/r组p-AMPKα水平降低,这说明DEX预处可能通过激活AMPKα发挥其对Huvecs的保护作用,而该作用可以被YHB拮抗。本研究发现在氧糖剥夺再复氧前给予DEX预处理2 h既能明显提高p-AMPKα水平,而YHB使DEX的效应有所逆转。近期有研究发现DEX对心肌缺血再灌注损伤的保护作用可能与AMPKα依赖的自噬有关[7],DEX也有可能通过自噬发挥对Huvecs的保护作用,这个推论需要进一步证实。AMPKα分子被认为是细胞内部能量与代谢调节的关键分子之一,其在糖尿病、高脂血症、肥胖症等多种与代谢相关的疾病中均有重要作用[8]。 在大鼠糖尿病模型中,DEX可以通过激活AMPKα减轻氧化应激损伤[9],同时在过氧化氢诱导的Huvecs损伤模型中,AMPKα分子的激活对Huvecs有保护作用[10-11],而缺氧复氧过程中氧化应激也是细胞损伤的主要机制之一。据此,作者推论:DEX通过激活AMPKα减轻氧糖剥夺再复氧时Huvecs的氧化应激损伤,而其对血管内皮细胞通透性和死亡形式的影响,需要进一步探究。
DEX作为一种麻醉辅助药,能显著降低全麻手术患者应激和炎性反应水平,有助于改善患者的临床疗效[12],动物实验如在脓毒症小鼠身上也证实其有抗炎作用[13],而血管内皮细胞作为组织与血液的第一屏障,其在机体应激和炎症等病理生理过程中发挥着重要作用,血管内皮细胞也许是DEX发挥围术期器官保护作用的靶点之一。现有研究证实AMPKα不仅对缺氧复氧条件下血管内皮细胞的功能有影响,并且参与了Huvecs炎性反应[14];据此认为DEX可能会通过AMPKα分子发挥其对Huvecs的抗炎作用,需要进一步的实验证实这个猜想并寻找该通路的下游靶分子。
AMPKα分子被认为是细胞内部能量与代谢调节的关键分子之一,该分子的激活可以提高细胞对葡萄糖的摄取,抑制蛋白质、糖原和脂类的合成,促进糖类有氧氧化和脂类的分解代谢,从而为细胞提供更多能量[15]。现有研究认为DEX可以提高293细胞的线粒体呼吸功能[16],据此推测DEX可能是通过激活该分子改善了Huvecs的内部能量代谢,所以本研究还进行了线粒体呼吸功能检测。结果发现,相对于NC组来说,50 mol/L DEX明显提高了线粒体的有氧呼吸能力,同样用α2肾上腺素受体的拮抗剂YHB之后,该作用被削弱。
综上所述,DEX在提高了p-AMPKα水平后,会进一步影响线粒体的生物合成能力,线粒体的氧气消耗速率间接地反映了线粒体的有氧氧化水平和生物合成能力。在氧糖剥夺条件下,细胞是处于一种无氧无能量来源的状态,此时的细胞要适应这种极端环境需要一定的能量储备。在本研究中发现DEX预处理可以提高线粒体的有氧呼吸能力,使细胞在氧糖剥夺处理前细胞内部能量储备量升高,以满足Huvecs在氧糖剥夺状态下的能量需求。结合本课题组前期的实验结果,可以得出以下结论:DEX预处理通过激活α2受体提高p-AMPKα水平,p-AMPKα可通过促进细胞对葡萄糖的摄取,促进生成能量的生物化学反应,抑制消耗能量的物质合成反应,提高线粒体的呼吸功能,增加细胞内部能量储备,这有利于Huvecs细胞适应氧糖剥夺的极端环境,利于细胞的生存,减轻细胞损伤,而DEX对Huvecs的通透性和死亡形式及炎性反应的影响,需要进一步探索。

