基于超声成像提取影像组学特征构建Rad-score评估肝脏占位性病变良恶性的研究
杨 颖,胡小玲
(重庆市急救医疗中心超声科 400010)
我国乙型肝炎病毒感染患者基数较大,由乙型肝炎患者继发肝硬化患者基数也不断提高,因此,肝脏占位性病变患者的发病率不断升高[1]。临床上肝脏占位性病变患者的良恶性评估对于患者是否接受肝脏穿刺活检及患者接受何种治疗方案具有重要临床意义[2]。目前临床上诊断肝脏占位性病变常用磁共振成像(MRI)、计算机断层扫描(CT)及超声成像。MRI具有高组织分辨率成像,然而成像时间较长,且成像过程中要求患者进行呼吸训练,患者依从性较差[3]。CT 成像时间较短,灵敏度较高,但具有辐射性等问题[4]。超声作为目前肝脏占位性病变检测的首选影像方案,成像简易,图像对比度较好,可反映病灶部位的异质性[5]。美国放射学会2017年提出肝脏超声影像报告和数据管理系统(LI-RADS for US)[6],用于肝脏疾病的超声分类,然而对于病灶的良恶性鉴别无法提供定量评估。近年来广大学者尝试构建影像定量模型评估肿瘤异质性,其准确性和可重复性目前不断提升[7-9]。本研究对79例肝脏占位性病变患者基于超声影像组学方法构建影像组学标签(Rad-score),以探讨其对评估肝脏占位性病变良恶性的可行性。
1 资料与方法
1.1 一般资料
选择本院2016年5月至2020年7月肝脏占位性病变患者,患者入组标准:(1)最大直径小于或等于5.0 cm的病灶;(2)Child-Pugh A级功能良好;(3)患者接受穿刺活检或手术切组病理检测确定病例类型及是否良恶性。患者筛除标准:(1)典型含液性病变或囊肿;(2)患者病灶超声图像模糊,无法完整观测病灶位置及边界等特征信息;(3)患者病理结果无法确定良恶性[10]。
1.2 方法
1.2.1超声扫描与病灶分割方法
采用PHILIPS EPIQ 5,探头频率2.5~5.0 MHz。由本科室高年资医师对病灶进行感兴趣区域(ROI)勾画,将原始图像(DICOM格式)导入ITK-SNAP软件,医师对肿瘤进行大概边界的勾画即可。分别用ITK-SNAP(www.itksnap.org)的标记点勾画ROI的方法,标记肿瘤的顶部、底部、左侧和右侧的边界点,最后构建边界框,确保病灶位于该方框内[11]。将DICOM图像和分割后的ROI导入影像组学软件Artificial Intelligence Kit,version 3.6.3(GE Healthcare),自动提取影像组学特征。
1.2.2影像组学特征筛选
将入组患者按照随机原则以7∶3比例分为训练集和验证集,以训练集患者是否肝脏恶性肿瘤为研究目的进行影像组学特征去冗除杂,采用最小冗余最大相关(mRMR)进行特征去冗除杂,并采用套索算法(LASSO)进行影像组学标签Rad-score构建,采用受试者工作特征(ROC)曲线评估Rad-score对训练集和测试集中患者的良恶性的诊断效能[11]。
1.3 统计学处理
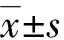
2 结 果
2.1 患者一般资料
本研究共纳入79例肝脏肿瘤患者,其中男57例,女22例,年龄(58.0±26.8)岁。其中25例患者通过手术穿刺获得病理结果,54例患者通过手术肝脏组织切除获得病理结果。病理结果显示:40例患者为恶性肿瘤(包括23例肝细胞癌,2例胆管细胞癌,15例转移癌);39例患者为良性肿瘤(包括1例胆管错构瘤,2例肉芽肿性炎,4例血管平滑肌瘤,4例非均匀性脂肪肝,28例肝脓肿)。
2.2 Rad-score构建
共计提取943个影像组学特征基于训练集mRMR特征降维后,共计保留30个特征,继而采用LASSO进行Rad-score构建(图1),最终获得6个特征分别为ShortRunEmphasis_angle90_offset1,GLCMEntropy_AllDirection_offset7_SD,LowIntensitySmallAreaEmphasis,GLCMEntropy_angle135_offset1,ClusterShade_angle135_offset7,VoxelValueSum。基于这些特征和其相应的回归系数构建Rad-score。
Rad-score公式如下:Rad-score=-0.181×ShortRunEmphasis_angle90_offset1-0.207×GLCMEntropy_AllDirection_offset7_SD-0.071×LowIntensitySmallAreaEmphasis-0.072×GLCMEntropy_angle135_offset1-0.204×ClusterShade_angle135_offset7-0.209×VoxelValueSum+0.002。
2.3 Rad-score在肝脏良恶性患者间的差异
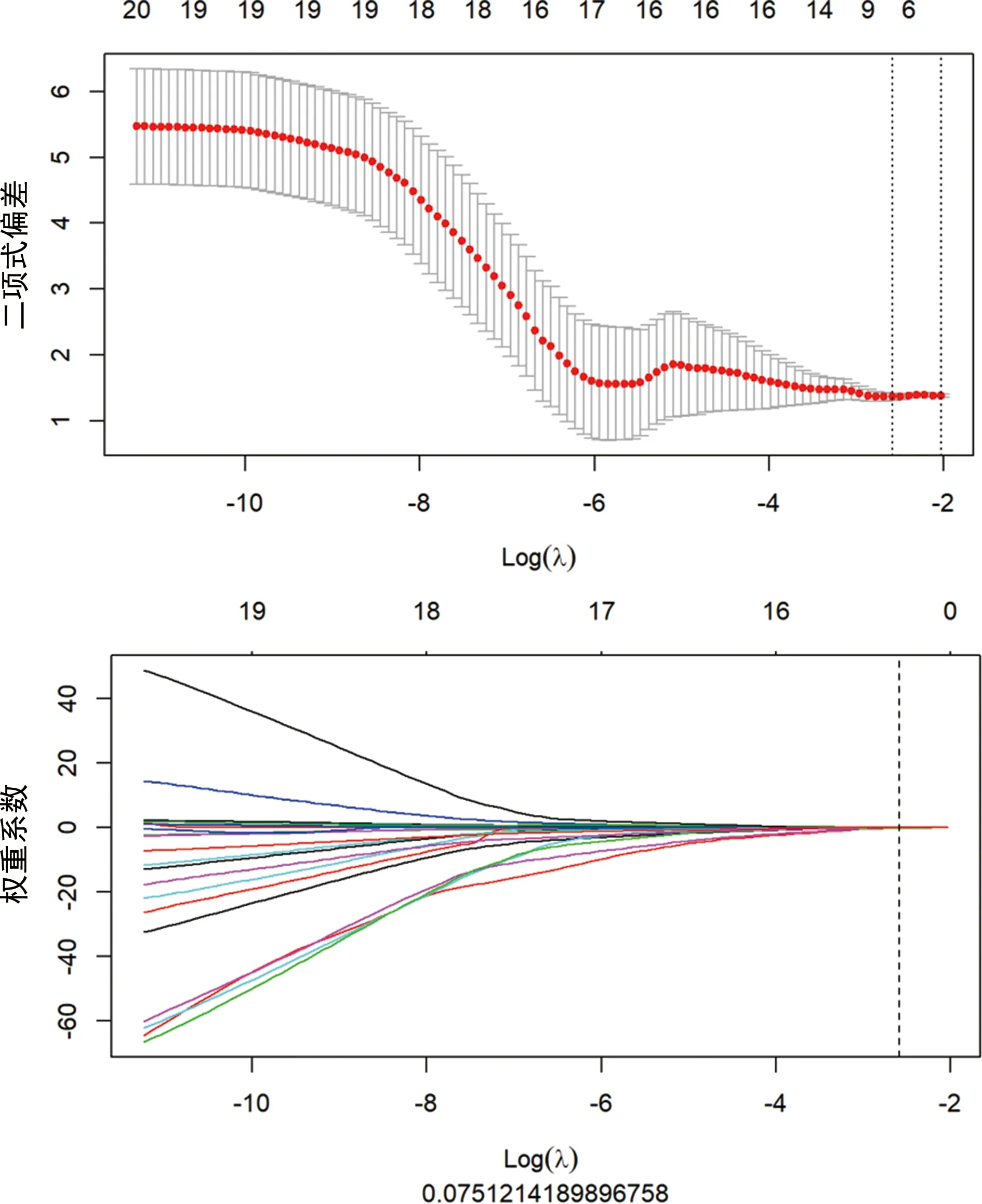
根据以上Rad-score公式计算训练集和验证集患者的Rad-score值,采用Mann-Whitney分析训练集和验证集患者的Rad-score的差异,结果显示训练集中良性肿瘤患者的Rad-score低于恶性肿瘤患者的Rad-score(P<0.000 1,图2A),测试集良性肿瘤患者的Rad-score低于恶性肿瘤患者的Rad-score(P=0.016,图2B)。Rad-score评估良恶性的截断值为-0.11。
上图Y轴为二项式偏差,X下轴为惩罚系数值λ,X上轴为惩罚系数值对应的特征数;下图Y轴为构建Rad-score时,特征的权重系数值,X轴下轴为惩罚系数值λ,X上轴为惩罚系数值对应的特征数。
A:训练集中良恶性患者的Rad-score值分布图;B:测试集中良恶性患者的Rad-score值分布图。
2.4 Rad-score鉴别肝脏良恶性的诊断效能
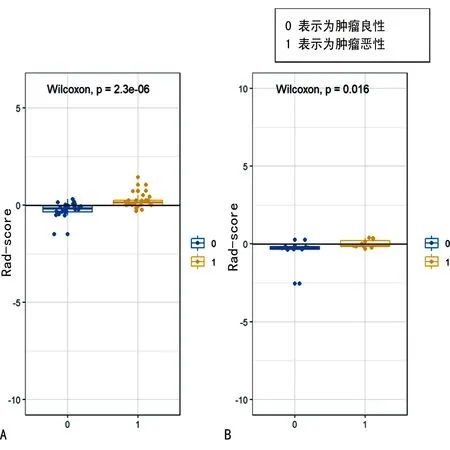
Rad-score预测肝脏良恶性的ROC分析结果显示,Rad-score在训练集中预测肝脏恶性肿瘤的AUC为0.854,灵敏度为0.785,特异度为0.821,95%CI为0.751~0.952;Rad-score在测试集中预测肝脏恶性肿瘤的AUC为0.841,灵敏度为0.818,特异度为0.750,95%CI:0.681~1.000,见图3。
A:训练集;B:测试集。
3 讨 论
本组研究中基于超声影像提取了943个影像组学特征,将患者随机按照7∶3比例分为训练集和测试集,以训练集患者是否为恶性肝占位性病变为研究目的,对影像组学特征进行特征去冗除杂,经mRMR及LASSO回归降维后获得6个影像组学特征,分别为:ShortRunEmphasis_angle90_offset1,GLCMEntropy_AllDirection_offset7_SD,LowIntensitySmallAreaEmphasis,GLCMEntropy_angle135_offset1,ClusterShade_angle135_offset7,VoxelValueSum,基于这些特征和其相应的回归系数构建Rad-score,Rad-score在评估训练集和测试集肝脏恶性病变具有较好的诊断效能(AUC分别为0.854、0.841)。
肿瘤异质性指在肿瘤发展过程中,由于病灶部位基因发生突变,从而导致病灶部位的蛋白表达发生改变,导致细胞排布发生改变,从而引发肿瘤病灶不同位置的细胞生长速度、细胞迁徙能力及肿瘤细胞对于药物的耐药性、敏感性的差异[12]。肿瘤异质性在超声成像中也具有丰富的表现,例如肝血管瘤的超声造影成像表现为向心性增强[13],典型肝细胞癌(HCC)的超声造影表现为快进快出[14],这是由于HCC主要由肝动脉供血,而肝实质75%由门脉供血,造影剂动脉期迅速进入肿瘤微血管内,使肿瘤呈“快进”表现,在动脉期增强后,由于肿瘤内存在动脉-静脉瘘,血管迂曲扩张,肿瘤周围及中心有大量异常增生的血管,使肿瘤内造影剂的循环时间较正常肝组织短,呈现“快出”表现。超声在造影成像的基础上可根据病灶的增强形状,增强时间提示临床肝脏占位性病变的良恶性。然而本组研究显示在基于常规超声图像构建Rad-score可用于无侵袭性预测肝脏占位性病变的良恶性。
本研究共提取943个影像组学特征,包括形态学特征、一阶灰度亮度特征、纹理特征、灰度共生矩阵特征、游程矩阵特征、小波变换特征。最终,基于6个影像组学特征构建Rad-score,其预测能力在训练集中为0.854,验证集中为0.841,均具有较好的诊断效能。YAO等[15]基于超声提取影像组学特征构建模型评估良恶性的诊断效能AUC为0.97,高于本研究结果。可能是由于本组研究中主要讨论了无临床信息下仅凭借影像组学构建Rad-score评估肝脏肿瘤良恶性,而YAO等[15]的研究中纳入了多模态参数,从而极大地提高了模型的诊断效能。XUE等[16]基于灰度超声及弹性超声提取影像组学特征对肝纤维化进行分级。因此,基于超声提取影像组学有助于有效评估肝占位性病变的良恶性。
本研究中仍存在一定的局限性:(1)本研究中基于常规超声成像提取影像组学特征构建Rad-score进行肝脏占位性病变的良恶性评估,未联合临床参数,例如血清学参数,前期有研究联合临床参数和Rad-score构建联合模型评估肝细胞癌[11]。(2)本研究中样本数量偏少,共计纳入79例,且均为本医院数据,后期应考虑扩大样本量,获取多中心数据。
综上所述,本研究基于超声成像提取影像组学特征构建影像组学标签Rad-score评估肝脏肿瘤良恶性,具有良好的诊断效能,可协助临床评估肝脏占位性病变的良恶性。

