sgf73基因敲除对粟酒裂殖酵母细胞有丝分裂的影响
袁荣美, 丁 祥, 谭秀梅, 鲁 艳, 周丽倩, 刘欣岚, 侯怡铃*
(1.西华师范大学生命科学学院 西南野生动植物资源保护教育部重点实验室,四川 南充 637009;2.四川省疾病预防控制中心,四川 成都 610044;3.西华师范大学 环境科学与工程学院,四川 南充 637009;4.四川宜宾南溪经济开发区管理委员会,四川 南溪 644100)
1 材料与方法
1.1 材料
1.1.1 实验材料 本研究所用粟酒裂殖酵母(Schizosaccharomycespombe)野生型(WT)以及构建的菌株均保存于四川省南充市西华师范大学生命科学学院西南野生动植物资源保护教育部重点实验室(表1)。

表1 实验菌株及编号Table 1 Experimental strains and numbers
1.1.2 培养基 ①YE5S培养基(g/L):葡萄糖 30,酵母提取物 5,腺嘌呤 0.225,尿嘧啶 0.225,赖氨酸 0.225,亮氨酸0.225,组氨酸0.225,琼脂 20(固体培养基添加);②YE5S-G418培养基:YE5S培养基+遗传霉素G418 0.225 g;③EMM-N培养基(g/L):EMM-N粉末 7.32,葡萄糖30,琼脂20。
1.1.3 主要试剂与仪器设备 葡萄糖、酵母提取物、遗传霉素(G418)、脱水EMM-N培养基粉末、腺嘌呤、尿嘧啶、赖氨酸、亮氨酸、组氨酸、蜗牛酶。II级生物安全柜(MSC-AdvantageTM,赛默飞世尔科技公司);恒温培养箱(IGS60,赛默飞世尔科技公司);激光共聚焦显微镜(TCS-SP8,莱卡);荧光显微镜(DMI3000B,莱卡);奥林巴斯显微镜(BX51,奥林巴斯(中国)有限公司);恒温摇床(THZ-Q,上海百典仪器设备有限公司);全自动压力蒸汽灭菌锅(LDZX-30FA,上海申安医疗器械厂);冷冻离心机(5418R,上海艾本德国际贸易有限公司);酶标仪(Epoch,美国基因有限公司)。
1.2 方法
1.2.1 生长曲线测定 将活化后的野生型(wt)和sgf73Δ菌株接入YE5S培养液,置于25 ℃、200 r/min的恒温摇床中培养,OD595达到0.5~0.8时稀释至0.1,每隔2 h测1次OD595,连续12 h,收集数据绘制生长曲线图。
1.2.2 产孢实验 将菌株HY 1003-1和HY 1003-2在YE5S固体培养基上活化后,分别刮取适量菌体,混和均匀后涂布在EMM-N固体培养基上,24 h后镜检,观察产孢情况并收集数据。
1.2.3 荧光蛋白构建 将菌株PT4436与HY 1003-1混合均匀,菌株PT3850与HY 1003-2混合均匀,涂布于EMM-N固体培养基上,25 ℃恒温培养24 h 后观察到有孢子产生,48 h后观察到有大量孢子产生。将产生孢子的混合菌体悬浮于蜗牛酶工作液中,室温静置至子囊壁破裂,收集孢子。用无菌水洗涤孢子后稀释孢子,取10 μL均匀涂布于YE5S-G418固体培养基,25 ℃恒温培养3~4 d。待长出单菌落后,挑取单菌落至YE5S-G418固体培养基扩大培养,菌株长出后通过荧光显微镜镜检,选择同时带有绿色微管和红色染色体的敲除株[19-20]。
1.2.4 活细胞成像 将菌株HY 1003-3和HY 1003-4经YE5S固体培养基活化后接入YE5S液体培养基,待OD595达到0.5~0.8时收集菌体制片,用莱卡SP8激光共聚焦进行延时扫描。参数为7个切面,间距1 μm,时间间隔60 s,总时间90 min。
1.2.5 统计学分析 使用SPSS 23.0软件对实验数据(mean±SD)进行单因素方差分析和t-test检验。*P<0.05代表差异显著,**P<0.01代表差异极显著。使用Fiji图像处理软件对孢子图像和活细胞成像的图像数据进行统计和分析。孢子统计500个/次,生物学重复3次,共计1 500个,按照公式计算产孢率。采用GraphPad Prism 8和Office 2019版Excel做图。
[7]http://blog.sina.com.cn/s/blog_64e e90340100zjtf.html.
式中:P为产孢率;B为不同孢子数量的子囊孢子个数。
2 结果与分析
2.1 sgf73基因缺失对裂殖酵母生长和产孢的影响
将野生型(wt)和sgf73Δ菌株在25 ℃、200 r/min的条件下培养12 h,进行生长曲线测定。实验结果显示,0~6 h野生型菌株与sgf73Δ菌株均处于缓慢生长期,野生型菌株在0~6 h的OD595分别为(0.13±0.01)、(0.17±0.02)、(0.21±0.03)、(0.26±0.03);sgf73Δ菌株0~6 h的OD595分别为(0.12±0.01)、(0.13±0.01)、(0.15±0.01)、(0.21±0.01),其中在2~6 h内sgf73Δ菌株与野生型菌株具有显著差异(P<0.05)。6 h后,野生型菌株进入对数生长期,在8~12 h的OD595分别为(0.36±0.03)、(0.50±0.03)、(0.66±0.03);sgf73Δ菌株依然处于缓慢生长期,8~12 h的OD595分别为(0.26±0.02)、(0.33±0.02)、(0.37±0.03),均与野生型菌株有极显著差异(P<0.01)(图1A、1B)。以上生长曲线结果提示,sgf73基因敲除极显著地影响了裂殖酵母的生长。
接合生殖实验结果显示(图1C~1E),野生型(wt)菌株99.2%产生4个子囊孢子,(0.53±0.31)%产生3个子囊孢子,(0.27±0.31)%产生2个子囊孢子。与野生型(wt)菌株相比,sgf73Δ菌株(95.13±1.72)%产生4个子囊孢子,与野生型具有显著差异(P<0.05),(2.8±0.6)%产生3个子囊孢子,与野生型具有极显著差异(P<0.01),(0.47±0.46)%产生2个子囊孢子,(0.47±0.46)%产生5个子囊孢子,(0.6±0.53)%产生6个子囊孢子。值得注意的是,有(0.33±0.23)%的sgf73Δ菌株产生8个子囊孢子。

图1 野生型(wt)和sgf73Δ菌株生长和产孢结果Fig.1 Results of growth and spores of wild type (wt) and sgf73Δ strainsA:野生型(wt)和sgf73Δ菌株生长曲线图; B:野生型(wt)和sgf73Δ菌株OD595值差异性分析图;C:野生型(wt)子囊孢子形态图;D:sgf73Δ菌株子囊孢子形态图;E:野生型(wt)与sgf73Δ菌株子囊孢子数据统计(n=1 500,n是细胞数);*:P<0.05表示差异显著,**:P<0.01表示差异极显著A: Growth curves of wild type (wt) and sgf73Δ strains; B: The results of OD595 value between wild type (wt) and sgf73Δ strains; C: Ascospores morphology of wild type (wt); D: Ascospores morphology of sgf73Δ strains; E: Statistical analysis of spore number of wild type (wt) and sgf73Δ strains (n=1 500, n is the number of cells); *P<0.05 means a significant difference, and **P<0.01 means a very significant difference, respectively
2.2 sgf73基因敲除对裂殖酵母有丝分裂间期微管的影响
微管是真核细胞中普遍存在的一种纤维结构,是细胞骨架的重要组成部分,参与神经细胞内递质的传递,小泡以及色素的运输,对细胞器(如线粒体、核糖体)定位有一定的支持作用,对细胞生理形态的维持也具有重要作用[21]。以GFP-Atb2作为检测信号,研究了野生型(wt)和sgf73Δ菌株微管在有丝分裂间期的数量、长度和形态(图2A)。实验结果显示,野生型菌株微管平均长度为(6.19±2.00) μm,其中(11.67±2.89)%的野生型菌株在有丝分裂间期有3条微管,(70±5)%的菌株有4条微管,(18.33±2.89)%野生型菌株有5条微管。sgf73Δ菌株微管平均长度为(6.26±2.27) μm(图2B),其中(43.33±10.41)%的sgf73Δ菌株有4条微管,与野生型菌株具有显著差异(P<0.05),(56.67±10.41)%的sgf73Δ菌株有5条微管,与野生型菌株具有极显著差异(P<0.01)(图2C)。

图2 野生型(wt)和sgf73Δ菌株有丝分裂间期微管结果Fig.2 Results of microtubules in wild type (wt) and sgf73Δ strains at the mitotic interphaseA:野生型(wt)和sgf73Δ菌株微管形态;B:野生型和sgf73Δ菌株微管长度(n=80,n是微管数);C:野生型和sgf73Δ菌株微管数目(n=60,n是细胞数);*:P<0.05表示差异显著,**:P<0.01表示差异极显著A: Morphology of microtubules in wild type (wt) and sgf73Δ strains; B: Statistical analysis of the length of microtubules in wild type (wt) and sgf73Δ strains (n=80, n is the number of microtubules); C: Statistical analysis of the number of microtubules in wild type (wt) and sgf73Δ strains (n=60, n is the number of cells); *P<0.05 means a significant difference, **P<0.01 means a very significant difference, respectively
2.3 sgf73基因敲除对裂殖酵母中染色体纺锤体动力学的影响
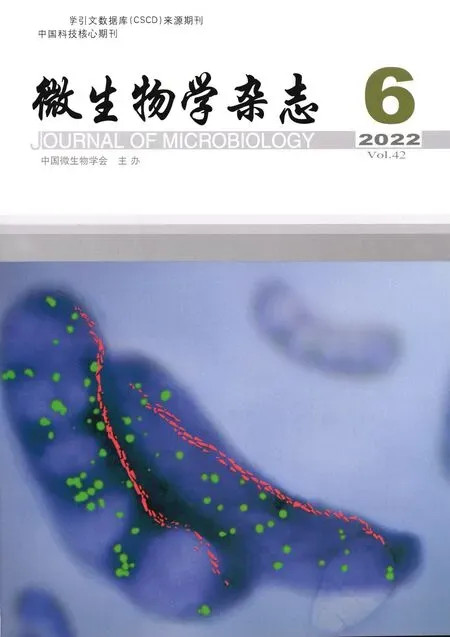
荧光蛋白标记和活细胞成像相结合的实验方法是研究细胞有丝分裂的重要手段之一,其优势是对相关蛋白进行荧光标记后即可在特定波长下进行检测。将GFP-Atb2和Hht1-RFP作为检测信号,观察纺锤体和染色体在有丝分裂中的行为。由图3可知,进入有丝分裂的分裂期后,分裂间期的微管消失并形成纺锤体;在中期纺锤体维持一定的长度;后期纺锤体伸长,染色体分离,将染色体拉向细胞两极。值得注意的是,sgf73Δ菌株在sgf73基因敲除后出现图3中sgf73Δ(b)的现象,在分裂期纺锤体没有伸长,长时间处于单极纺锤体的状态,没有进入有丝分裂中后期,并且处于细胞两极的染色体大小不均。以上结果提示,sgf73基因敲除导致菌株纺锤体组装和染色体分离不均的缺陷。
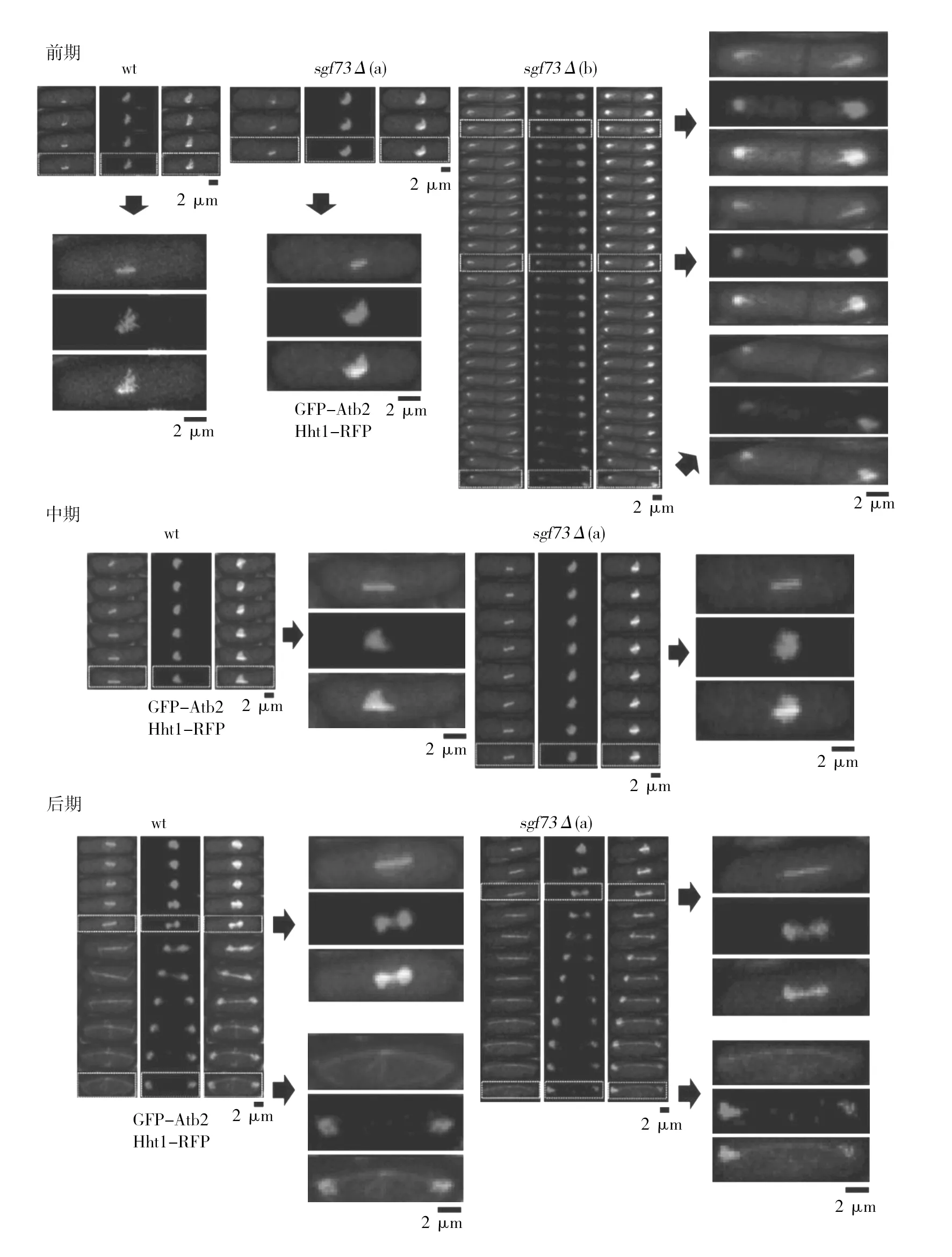
图3 野生型(wt)和sgf73Δ菌株有丝分裂期细胞动力学成像结果Fig.3 Imaging results of dynamics of wild type (wt) and sgf73Δ strains during mitosiswt为野生型菌株细胞动力学成像结果;sgf73Δ(a)-sgf73Δ(b)为sgf73Δ菌株细胞动力学成像结果(荧光标记为GFP-Atb2(tubulin)和Hht1-RFP (chromosome));箭头所指从左至右是虚线部分的放大图片wt is the imaging results of dynamics of wild type during mitosis, sgf73Δ(a)-sgf73Δ (b) is the imaging results of dynamics of sgf73Δ strains during mitosis (fluorescent protein markers were GFP-Atb2(tubulin) and Hht1-RFP (chromosome)). The picture of the arrow refers to the enlarged picture of the dashed part from left to right
2.4 sgf73基因敲除对裂殖酵母有丝分裂纺锤体总时间及长度的影响
对有丝分裂中纺锤体长度的变化进行分析,统计结果显示(图4),野生型(wt)菌株有丝分裂中纺锤体从形成到断裂的总时间为(30.15±2.48)min,总长度为(12.30±0.71)μm;sgf73Δ菌株有丝分裂中纺锤体总长度为(13.0±1.52)μm,总时间为(38.78±8.03)min,与野生型(wt)菌株具有极显著差异(P<0.01)。结果提示,sgf73基因缺失后有丝分裂时间极显著延长(P<0.01)。

图4 有丝分裂中野生型(wt)和sgf73Δ菌株纺锤体伸长结果Fig.4 Spindle results in wild type (wt) and sgf73Δ strains during mitosisA:野生型(wt)菌株纺锤体伸长统计图(n=20,n是细胞数);B:sgf73Δ菌株纺锤体伸长统计图(n=20,n是细胞数);C: 野生型(wt)和sgf73Δ菌株纺锤体伸长时间统计图;D:野生型(wt)和sgf73Δ菌株纺锤体终长度统计图(n=20,n是细胞数);**:P<0.01表示差异极显著A: Statistical analysis of spindle elongation in wild type (wt) during mitosis (n=20, n is number of cells); B: Statistical analysis of spindle elongation in sgf73Δ strains during mitosis (n=20, n is number of cells); C: Statistical analysis of spindle elongation time in wild type (wt) and sgf73Δ strains during mitosis; D: Statistical analysis of spindle length in wild type (wt) and sgf73Δ strains during mitosis (n=20, n is the number of cells); **P<0.01 means a very significant difference
2.5 sgf73基因敲除对裂殖酵母有丝分裂不同时期纺锤体的影响
进一步对野生型(wt)和sgf73Δ菌株有丝分裂各时期时间和纺锤体伸长速率的分析见图5,野生型(wt)菌株有丝分裂前期时间为(4.28±1.22) min,纺锤体伸长速率为(0.27±0.05) μm/min;sgf73Δ菌株有丝分裂前期的时间为(4.88±1.53) min,纺锤体伸长速率为(0.23±0.07) μm/min,sgf73Δ前期纺锤体伸长速率显著慢于野生型(P<0.01)。有丝分裂中期,野生型(wt)菌株的时间为(9.83±1.91) min,纺锤体伸长速率为(0.12±0.05) μm/min;sgf73Δ菌株的时间为(12.98±5.23) min,纺锤体伸长速率为(0.08±0.04) μm/min,与野生型(wt)相比均有显著差异(P<0.05)。有丝分裂后期,野生型菌株的时间为(16.05±1.76) min,纺锤体伸长速率为(0.65±0.06) μm/min;sgf73Δ菌株的时间为(20.91±4.20) min,纺锤体伸长速率为(0.54±0.12) μm/min,均具有极显著差异(P<0.01)。


图5 野生型(wt)和sgf73Δ菌株中有丝分裂各时期分裂时间和速率Fig.5 Time and velocity during mitosis prophase, metaphase and anaphase in wild type (wt) and sgf73Δ strainsA:有丝分裂前期时间;B:有丝分裂前期速率;C:有丝分裂中期时间;D:有丝分裂中期速率;E:有丝分裂周期时间;F:有丝分裂后期速率(n=20,n是细胞数);*:P<0.05表示差异显著,**:P<0.01表示差异极显著A: Time of prophase in mitosis; B: Velocity of prophase in mitosis; C: Time of metaphase in mitosis; D: Velocity of prophase in msitosis; E: Time of anaphase in mitosis; F: Velocity of prophase in mitosis (n=20, n is the number of cells); *P<0.05 means a significant difference, **P<0.01 means a very significant difference, respectively
2.6 sgf73基因敲除对裂殖酵母细胞周期中细胞形态的影响
细胞长度统计结果显示(图6),在有丝分裂纺锤体形成点、前期和中期过渡点、中期和后期过渡点、纺锤体断裂点和分裂末期野生型(wt)菌株的细胞长度分别为(12.79±1.20)、(12.96±1.21)、(13.09±1.23)、(13.26±1.30)和(6.98±0.75) μm;sgf73Δ菌株的细胞长度分别为(14.04±1.71)、(14.25±1.80)、(14.52±1.81)、(14.68±1.86)和(8.78±0.95) μm,在有丝分裂每个时期都与野生型具有显著差异(P<0.05),其中在中期和后期过渡点、纺锤体断裂点和分裂末期具有极显著差异(P<0.01)。

图6 野生型(wt)和sgf73Δ菌株中有丝分裂各时期细胞形态和长度Fig.6 Cell morphology and length of different phases during mitosis in wild type (wt) and sgf73Δ strainsA:野生型(wt)和sgf73Δ菌株中有丝分裂各时期细胞形态;B:纺锤体形成点的细胞长度;C:前期和中期过渡点的细胞长度;D:中期和后期过渡点的细胞长度;E:纺锤体断裂点的细胞长度;F:分裂末期的细胞长度(n=20,n是细胞数);*:P<0.05表示差异显著,**:P<0.01表示差异极显著A: Cell morphology of different phases during mitosis in wild type (wt) and sgf73Δ strains; B: Cell length in spindle formation; C: Cell length in prophase-metaphase transition; D: Cell length in metaphase-anaphase transition; E: Cell length in anaphase-spindle breakage transition; F: Cell length in the end point of mitosis (n=20, n is the number of cells); *P<0.05 means a significant difference, **P<0.01 means a very significant difference, respectively
细胞宽度统计结果显示(图7),在有丝分裂纺锤体形成点、前期和中期过渡点、中期和后期过渡点、纺锤体断裂点和分裂末期野生型(wt)菌株的细胞宽度分别为(3.45±0.24)、(3.46±0.24)、(3.49±0.24)、(3.51±0.25)和(3.48±0.22) μm;sgf73Δ菌株的细胞宽度分别为(3.69±0.38)、(3.72±0.37)、(3.75±0.36)、(3.78±0.37)、(3.51±0.30) μm,在纺锤体形成点、前期和中期过渡点、中期和后期过渡点sgf73Δ菌株与野生型菌株相比具有显著差异(P<0.05),在纺锤体断裂点与野生型相比具有极显著差异(P<0.01)。

图7 野生型(wt)和sgf73Δ菌株有丝分裂各时期细胞的宽度Fig.7 Cell width of different phases during mitosis in wild type (wt) and sgf73Δ strainsA:纺锤体形成点的细胞宽度;B:前期和中期过渡点的细胞宽度;C:中期和后期过渡点的细胞宽度;D:纺锤体断裂点的细胞宽度;E:分裂末期的细胞宽度(n=20,n是细胞数);*:P<0.05表示差异显著,**:P<0.01表示差异极显著A: Cell width in spindle formation; B: Cell width in prophase-metaphase transition; C: Cell width in metaphase-anaphase transition; D: Cell width in anaphase-spindle breakage transition; E: Cell width in the end point of mitosis (n=20, n is the number of cells); *P<0.05 means a significant difference, **P<0.01 means a very significant difference, respectively
在有丝分裂的纺锤体形成点、前期和中期过渡点、中期和后期过渡点、纺锤体断裂点和分裂末期野生型(wt)菌株的细胞长宽比分别为(3.77±0.41)、(3.76±0.40)、(3.77±0.41)、(3.80±0.42)和(2.02±0.30),sgf73Δ菌株的细胞长宽比分别为(3.84±0.59)、(3.87±0.61)、(3.90±0.56)、(3.91±0.55)、(2.53±0.40),在前期和中期过渡点以及分裂末期sgf73Δ菌株的细胞长宽比与野生型相比具有极显著差异(P<0.01)(图8)。
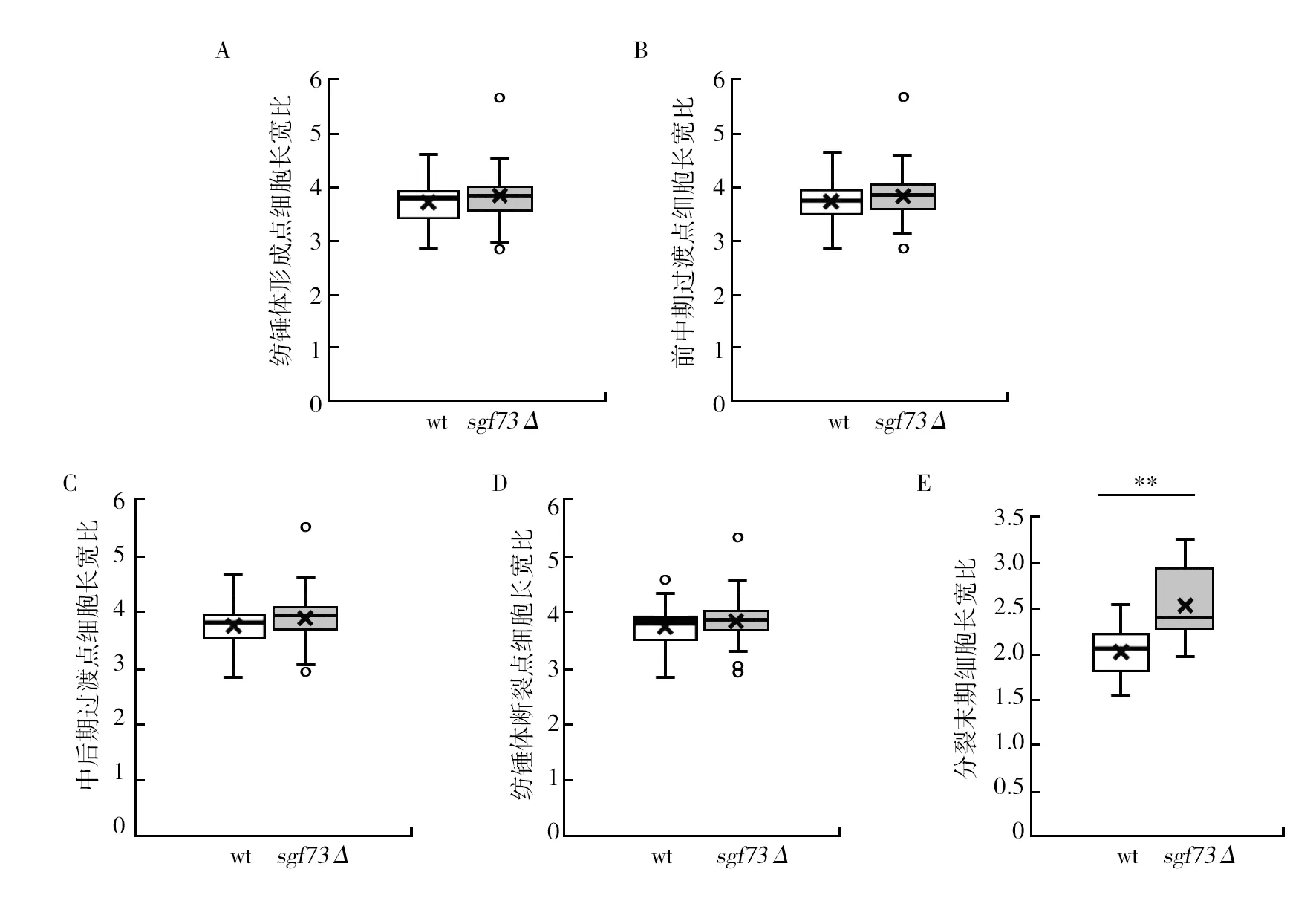
图8 野生型(wt)和sgf73Δ菌株有丝分裂各时期细胞长宽比Fig.8 Cell length-width ratio of different phases during mitosis in wild type (wt) and sgf73Δ strainsA:纺锤体形成点的细胞长宽比;B:前期和中期过渡点的细胞长宽比;C:中期和后期过渡点的细胞长宽比;D:纺锤体断裂点的细胞长宽比;E:分裂末期的细胞长宽比(n=20,n是细胞数);**:P<0.01表示差异极显著A: Cell length-width ratio in spindle formation; B: Cell length-width ratio in prophase-metaphase transition; C: Cell length-width ratio in metaphase-anaphase transition; D:Cell length-width ratio in anaphase-spindle breakage transition; E: Cell length-width ratio in the end point of mitosis (n=20, n is the number of cells); **P<0.01 means a very significant difference
2.7 sgf73基因敲除对裂殖酵母有丝分裂中纺锤体形成及断裂的影响
通过活细胞成像观察到野生型(wt)菌株(81.67±2.89)%在有丝分裂开始时微管形成棒状(Bar)纺锤体,10%先形成点状(Dot)纺锤体再形成棒状纺锤体,(8.33±2.89)%微管形成单极纺锤体(Mono);sgf73Δ菌株(56.67±5.77)%菌株形成棒状纺锤体,(16.67±2.89)%形成点状纺锤体,(26.66±2.89)%形成单极纺锤体。以上结果中,sgf73Δ菌株形成棒状和单极纺锤体的菌株与野生型菌株具有极显著差异(P<0.01),形成点状纺锤体的具有显著差异(P<0.05)(图9A、9B)。实验结果表明,sgf73基因敲除导致纺锤体形成缺陷,单极纺锤体增加,不利于有丝分裂中染色体的正确分离,提示sgf73基因可能参与双极纺锤体的组装。
在有丝分裂后期,纺锤体将染色体拉向细胞两极后会发生断裂,分裂完成后重新在子细胞中以微管的形式存在[22]。据统计,野生型(wt)菌株中(21.67±7.64)%纺锤体是直线型(Linear-type)断裂,(66.67±2.89)%是拱型(Arch-type)断裂,(11.66±5.77)%是S型断裂;sgf73Δ菌株中(20±8.66)%为直线型断裂,(80±8.66)%为拱型断裂(图9C、9D)。结果提示,sgf73基因缺失不会显著影响纺锤体断裂形式。

图9 野生型(wt)和sgf73Δ菌株有丝分裂中纺锤体形成及断裂分析结果Fig.9 Analysis results of formation and fracture of spindle results in wild type (wt) and sgf73Δ strains during mitosisA:野生型(wt)和sgf73Δ菌株有丝分裂纺锤体形成方式形态图;B:野生型(wt)和sgf73Δ菌株有丝分裂纺锤体形成方式统计结果(n=60,n是细胞数);C:野生型(wt)和sgf73Δ菌株有丝分裂纺锤体断裂方式统计结果(n=60,n是细胞数);D:野生型(wt)和sgf73Δ菌株有丝分裂纺锤体断裂方式形态图;*:P<0.05表示差异显著,**:P<0.01表示差异极显著A: Morphology of spindle formation types in wild type (wt) and sgf73Δ strains during mitosis; B: Statistical results of spindle formation types in wild type (wt) and sgf73Δ strains during mitosis (n=60, n is the number of cells); C: Statistical results of spindle breakage types in wild type (wt) and sgf73Δ strains during mitosis (n=60, n is the number of cells); D: Morphology of spindle breakage types during mitosis in wild type (wt) and sgf73Δ strains; *P<0.05 means a significant difference, **P<0.01 means a very significant difference, respectively
2.8 sgf73基因敲除对裂殖酵母有丝分裂中肌动蛋白动力学的影响
肌动蛋白是真核细胞的细胞骨架中重要组成部分,在各种基本细胞过程中起重要作用,包括维持细胞形状、极性、分裂、迁移、内吞和囊泡运输等[23-34],在有丝分裂时形成分裂环,将两个细胞分开。对sgf73Δ菌株肌动蛋白进行荧光标记,通过活细胞成像,观察野生型(wt)以及sgf73Δ菌株有丝分裂中肌动蛋白的形态和行为(图10A、10B)。经统计,野生型菌株在有丝分裂中肌动蛋白的收缩环直径为(3.70±0.27) μm,从形成到消失的时间为(29.6±3.07) min,速率为(0.10±0.01) μm/min;sgf73Δ菌株收缩环的直径为(3.56±0.31) μm,从形成到消失的时间为(21.95±3.55) min,速率为(0.08±0.01) μm/min,在时间与速率上与野生型具有极显著差异(P<0.01)(图11A~C)。

图10 野生型(wt)和sgf73Δ菌株有丝分裂中肌动蛋白动力学结果Fig.10 Kinetic results of actin during mitosis in wild type (wt) and sgf73Δ strainsA:有丝分裂中野生型和sgf73Δ菌株肌动蛋白形态图;B:有丝分裂中野生型和sgf73Δ菌株肌动蛋白动力学;C:野生型菌株肌动蛋白收缩统计结果(n=30,n是细胞数);D:sgf73Δ菌株肌动蛋白收缩统计结果(n=30,n是细胞数)A: Actin morphology in wild type (wt) and sgf73Δ strains during mitosis; B: Actin dynamics in wild type (wt) and sgf73Δ strains during mitosis;C: Statistical results of actin contraction during mitosis in wt (n=30, n is number of cells); D: Statistical results of actin contraction during mitosis in sgf73Δ strains (n=30, n is number of cells)
分裂环在有丝分裂期间会维持一段时间后进入收缩期,有丝分裂结束后将细胞一分为二[25]。统计结果显示,野生型维持时间为(12.90±2.66) min,sgf73Δ菌株分裂环维持时间为(16.8±2.88) min,与野生型具有显著差异(P<0.01)。在分裂环收缩过程中,野生型收缩时间为(16.80±3.19) min,收缩速率为(0.18±0.04) μm/min,sgf73Δ菌株收缩时间为(15.15±1.98) min,收缩速率为(0.18±0.03) μm/min,sgf73Δ菌株收缩时间显著长于野生型(P<0.05)(图11D~E)。结果提示,sgf73基因敲除导致分裂环在有丝分裂中从形成到消失的总时间极显著延长,总速率显著降低,维持时间极显著延长,收缩时间显著延长。
图11 野生型(wt)和sgf73Δ菌株有丝分裂肌动蛋白收缩数据统计Fig.11 Statistical results of actin contraction in wild type (wt) and sgf73Δ strains during mitosisA:有丝分裂野生型和sgf73Δ菌株肌动蛋白长度;B:有丝分裂野生型和sgf73Δ菌株肌动蛋白动力学总时间;C:有丝分裂野生型和sgf73Δ菌株肌动蛋白从形成到消失的总速率;D:有丝分裂野生型和sgf73Δ菌株肌动蛋白长度维持不变的时间;E:有丝分裂野生型和sgf73Δ菌株肌动蛋白收缩时间;F:有丝分裂野生型和sgf73Δ菌株肌动蛋白收缩速率(n=30,n是细胞数)*:P<0.05表示差异显著,**:P<0.01表示差异极显著A: Actin length in wild type (wt) and sgf73Δ strains during mitosis; B: Total actin kinetic time in wild type (wt) and sgf73Δ strains during mitosis; C: Actin dwell velocity in wild type (wt) and sgf73Δ strains during mitosis; D: Actin dwell time in wild type (wt) and sgf73Δ strains during mitosis; E: Actin shrinkage time in wild type (wt) and sgf73Δ strains during mitosis; F: Actin shrinkage velocity in wild type (wt) and sgf73Δ strains during mitosis (n=30, n is number of cells); *P<0.05 means a significant difference, and **P<0.01 means a very significant difference, respectively
3 讨 论
微管和肌动蛋白作为细胞骨架,在细胞中具有重要作用。在分裂间期,微管蛋白组成微管,帮助细胞内的细胞器定位和物质运输;在分裂期,微管蛋白形成纺锤体,帮助染色体分离。Kapitein等[26]研究发现,微管缺陷会导致广泛的神经系统异常,并且已经发现几种人类神经发育障碍与微管介导的过程改变有关。在细胞分裂中纺锤体的组装是一个复杂但精确调节的过程,与中心体周期相关。Wang等[27]发现,在脊椎动物中,有丝分裂激酶异常导致的中心体功能异常通常会诱导中心体周期异常,并伴随有丝分裂纺锤体的形成异常,包括单极和多极纺锤体,这将导致染色体不稳定并可能导致肿瘤的发生。Olmsted等研究发现,在人类,果蝇,非洲爪蟾卵和裂殖酵母中,抑制驱动蛋白5会导致单极纺锤体的产生[28-30],驱动蛋白5的缺失、失活或错误定位会导致持久的单极纺锤体。Blackwell等[28]发现,驱动蛋白14数量多也会导致纺锤体持久的单极性状态,敲除驱动蛋白14或动力蛋白可以消除单极纺锤体。持久的单极纺锤体导致染色体的不分离或不均分,Cooper等[31]证明,染色体的不均分会导致有丝分裂末期两个子细胞中的遗传物质不等,引发疾病,如癌症等。sgf73基因除了参与染色质的组装、转录调控,在细胞有丝分裂中还参与中心粒周期、双极纺锤体的组装和染色体的分离。本研究结果显示,sgf73Δ菌株形成棒状和单极纺锤体的菌株与野生型菌株具有极显著差异(P<0.01),形成点状纺锤体的具有显著差异(P<0.05)。实验结果表明,sgf73基因敲除导致纺锤体形成缺陷,单极纺锤体增加,不利于有丝分裂中染色体的正确分离,提示sgf73基因编码的蛋白可能参与双极纺锤体的组装。
肌动蛋白除了作为细胞骨架,在分裂中还会形成分裂环,在分裂结束后将两个细胞分离。Asadi等[32]发现了影响胞质分裂和肌动蛋白细胞骨架的基因ain1、acp2、acp1等,其中ain1基因编码α-actin,缺失后导致细胞收缩环装配、形态、收缩异常[33];acp2基因编码F-肌动蛋白帽β亚基Acp2,缺失导致acp2Δ菌株出现肌动蛋白减少、组织和融合异常、收缩环形成延迟、收缩速率降低、收缩环形态异常、在细胞中呈分散的斑块状等缺陷[34-35];acp1基因编码F-肌动蛋白帽α亚基,缺失导致肌动蛋白丝解聚速率降低[36]。本研究结果显示,sgf73基因缺失后导致肌动蛋白形成的分裂环在有丝分裂中从形成到消失的总时间极显著延长,总速率显著降低,维持时间极显著延长,收缩时间显著延长,提示sgf73基因编码的蛋白可能参与肌动蛋白形成分裂环及分裂环收缩的系列过程。
sgf73基因缺失后菌株的缺陷一方面可通过活细胞成像进行观察,另一方面,也会表现在菌株的宏观生长情况上。有研究表明,red1Δ、gls1Δ、bub1Δfin1Δ、dcr1Δreb1Δ、fin1Δmad2Δ菌株在基因敲除后均生长缓慢[37-41],sgf73Δ基因敲除后造成了菌株纺锤体组装缺陷和染色体分离缺陷,并且肌动蛋白分裂环的收缩速率受到影响,从而极显著的延长了sgf73菌株有丝分裂时间,在生长曲线测定时表现为生长缓慢。有性生殖是裂殖酵母另一种生殖方式,Sun等[42]和Nielsen[43]发现与裂殖酵母有性生殖相关的基因有数十个,其中byr1/ste1、ste4、ras1/ste5、ste6、ste7、byr2/ste8、ste20、ral2、scd2/ral3基因敲除株会导致菌株产孢异常;klp5Δ、klp6Δ、mug1Δ、mug5Δ菌株在氮缺乏条件下产生少于或多于4个的孢子;Kovar等[35]发现acp1Δ和acp2Δ菌株仅有58%、61%产生了4个孢子,且孵育时间越长,形成的孢子越少;Dudin等[44]研究发现SAGA复合物中Ubp8缺失导致菌株产孢效率低。本研究结果显示,sgf73基因敲除极显著影响裂殖酵母的生长,并导致子囊孢子数目显著减少,提示sgf73基因还可能与裂殖酵母有性生殖相关。
本研究为探究sgf73基因缺失后导致微管、染色体和肌动蛋白动力学缺陷的影响及相关疾病提供了一定参考。但影响细胞动力学变化的上下游互作蛋白的研究还需进一步探究。