金属离子胁迫对Sphingomonas sp. Y2降解壬基酚聚氧乙烯醚特性的影响
白娜玲, 何 宇, 李双喜, 张翰林, 张娟琴, 郑宪清, 张海韵, 刘善良, 吕卫光,5*
(1.上海市农业科学院 生态环境保护研究所,上海 201403;2.时科生物科技(上海)有限公司,上海 201108;3.上海海洋大学 海洋生态与环境学院,上海 201306;4.农业农村部 上海农业环境与耕地保育科学观测试验站,上海 201403;5.上海市农业环境保护监测站,上海 201403)
烷基酚聚氧乙烯醚(APEOs)是全球第二大商用非离子型表面活性剂,其中壬基酚聚氧乙烯醚(NPEOs)占APEOs总产量的80%~85%[1]。市场上的NPEOs是含同分异构体与同系物的混合物,聚合度由平均乙氧基(EO)数目(n=1~50)来表征。NPEOs具有良好的润湿、乳化、起泡、增溶、渗透等功能,被广泛用于洗涤、纺织、橡胶、医药、塑料、农药等领域,可通过各种途径释放到环境中。NPEOs及其一系列降解产物在污水排放口、污泥沉积物、土壤等样品中被广泛检测到[2-3]。NPEOs或其产物进入生物体后,对激素代谢过程产生干扰,威胁生物体的免疫系统、神经系统及生存和繁殖[4-6]。由于NPEOs及其代谢产物具有雌激素毒性与难降解特性,各国对NPEOs类物质的使用进行了严格规定。2011年,《中国严格限制进出口的有毒化学品目录》中首次将壬基酚(NP)和NPEOs列为禁止进出口物质。2012年,国际生态纺织标准将辛基酚(OP)、NP、辛基酚聚氧乙烯醚(OPEOs)、NPEOs列于其中并对其限量[7]。欧盟委员会的2016年第26号法规,要求纺织制品中NPEOs含量不得高于0.01%。由于微生物种类复杂及环境因素的影响,导致NPEOs代谢产物多样,如短链NPEOs、NP、羧酸衍生物(烷基链末端被酸性氧化的CAPEs、EO链末端被酸性氧化的壬基酚聚氧乙烯酸NPECs、烷基链和EO链末端均被酸性氧化的CAPECs)等,难以在原有基础上进一步降解或降解速率极低[8]。NPEOs的主要降解途径:①末端羟基直接氧化,生成NPECs和/或CAPECs,无EO链减少或其他产物生成。②羟基非氧化位移逐步去除EO基,释放乙醛,生成短链NPEOs[9]。③羟基氧化生成NPECs,脱去乙醛/乙醛酸,这种途径多见于中短链NPEOs的降解。例如,Ensifersp.AS08和Pseudomonassp.AS90通过氧化末端EO基的方式降解NP1-4EO,但不能利用长链NPEOs(如NP10EO)[10]。需要指出的是,有机污染物的降解途径及产物可能会随环境变化而不同[11-12]。例如一些雌激素药剂在无观测效应浓度时会协同作用产生明显的雌激素毒性[13]。Montgomery-Brown等[14]发现短链NPEOs在厌氧条件下被转化成NPs,在好养条件下被氧化为NPECs。有研究则强调外源物质对NPEOs降解产物的重要影响,甲醇、葡萄糖、酵母抽提物等有机物有助于EO链氧化,NP10EO只氧化生成NP10EC,随后生成极难降解的CAPECs;但当无外加有机物时,NP10EO的主要产物为NP2EO和NP3EO[11]。Hotta等[15]发现,Mg2+和Ca2+存在的前提下,Fe3+能够显著促进菌株BSN22降解OPEOs并提高OP1EC产物比例。诸多因素均可影响微生物对NPEOs的降解趋势,这更加反映出NPEOs在原位环境中降解方式的复杂性。印染纺织废水中经常含有表面活性剂、金属离子等成分,例如在染料中添加大量CuSO4用于固色,印花工艺中利用铅作为着色剂,锰配合物用于棉针织物的双氧水低温浸渍催化漂白等[16]。据报道,NPEOs的质量浓度可高达0.45~5.68 mg/L,经生化处理后废水雌激素活性显著升高;NP为雌激素活性的关键致癌物,对废水雌激素活性的平均贡献率可达70%[17]。已往研究多针对NPEOs降解菌筛选、代谢途径分析、雌激素毒性变化等方面,但鲜少关注常见金属离子胁迫对微生物降解NPEOs的影响。本研究以前期筛选到的NPEOs高效降解菌Sphingomonassp. Y2为研究对象,重点解析了菌株Y2对不同金属离子的耐受性及在金属离子胁迫下NPEOs的代谢规律变化,以期为环境中APEOs类污染物降解及产物毒性评价提供理论和实践参考。
1 材料与方法
1.1 材料
1.1.1 菌种来源 NPEOs高效降解菌Shingomonassp. Y2(GenBank No. KT957299)分离自污水处理厂,保存于上海市农业科学院生态环境保护研究所菌保中心。
1.1.2 培养基 ①重金属培养基(TMM)(g/L)[18]:MOPS(pH=7.0)20 mmol/L,β-甘油磷酸 0.95 mmol/L,KCl 1.49,NH4Cl 1.07,Na2SO40.43,MgCl2·6H2O 0.2,NaCl 4.68,CaCl2·H2O 0.03,Fe(Ⅲ)NH4·柠檬酸 0.005,微量元素1 mL,115 ℃灭菌30 min;②微量元素配方(mg/L):25% HCl 10 mL,FeCl2·4H2O 1.5,CoCl2·6H2O 190,MnCl2·4H2O 100,ZnCl270,H3BO362,Na2MoO4·2H2O 36,NiCl2·6H2O 24,CuCl2·2H2O 17,115 ℃灭菌30 min;③0.5×LB培养基(g/L):酵母抽提物 2.5,胰蛋白胨5,NaCl 5,pH调至7.0~7.2,121 ℃灭菌15 min。
1.1.3 主要试剂与仪器设备 NPEOs(平均EO数目为9,CAS:9016-45-9,浓度约为10%)购自上海阿拉丁生化科技股份有限公司;金属盐CoCl2、ZnSO4、K2Cr2O7、CrCl3、NiCl2、CuSO4、CdCl2、HgCl2、MnCl2、Pb(NO3)2等,购自国药集团药业股份有限公司;有机溶剂(如三氯甲烷、乙酸乙酯、色谱级甲醇等),购自天津四友有限公司。超净工作台(SW-CJ-1F,上海博迅);恒温振荡培养箱(SKY-2012,上海苏坤);紫外可见分光光度计(T6,北京普析);台式离心机(3K15,默克SIGMA生物公司);场发射扫描电镜(SIRON,荷兰FEI);高效液相色谱(HPLC)仪(Waters1525,美国Waters);气质联用(GC-MS/MS)仪(Aglient7900,美国Aglient);旋转蒸发仪(N-1300,东京理化)。
1.2 方法
1.2.1 菌株Sphingomonassp. Y2对不同金属离子耐受性分析 ①菌株Y2在0.5×LB中对金属离子的耐受性分析:设置1~1 000 mg/L(质量分数,下同)不同梯度的Cd2+、Cr3+、Co2+、Mn2+、Ni2+、Cr6+、Pb2+、Cu2+、Zn2+等金属离子,按照1%(体积分数,下同)接种量接种活化好的目标菌株Y2于0.5×LB中。置于水平摇床200 r/min,30 ℃培养5 d。期间观察菌株Y2生长情况,记录不同金属离子对菌株Y2的最低抑菌浓度(MIC)。MIC值越大,金属离子对菌体的毒性越小,反之,对菌体的毒性越大。② 菌株Y2在TMM中对金属离子的耐受性分析:金属离子在营养培养基(0.5×LB)中可能会与其中的有机成分或磷酸根发生相互作用,导致真正发挥作用的金属离子浓度低于添加浓度[18]。因此,进一步选择TMM培养基进行金属离子耐受性分析与验证。活化好的菌株Y2按1%接种量接种到TMM中,以葡萄糖为碳源,同时分别加入1~1 000 mg/L不同梯度的金属离子Cd2+、Cr3+、Co2+、Mn2+、Ni2+、Cr6+、Pb2+、Cu2+、Zn2+。置于水平摇床200 r/min,30 ℃培养5 d。期间观察菌株Y2生长情况,记录金属离子在TMM中的MIC值。
1.2.2 菌株Y2在金属离子胁迫下降解NPEOs分析 菌株Y2以1%接种量接种到TMM培养基中,NPEOs、Mn2+、Zn2+添加浓度分别为1 000、500、90 mg/L。实验分组:无菌空白对照、无金属离子添加、只添加Mn2+、只添加Zn2+、添加Mn2+和Zn2+。置于水平摇床200 r/min,30 ℃培养5 d。定时取样测定菌株Y2于600 nm处的光密度值(OD600)。同时HPLC分析NPEOs降解情况。HPLC的分离柱为Eclipse C18柱(250 mm×4.6 mm×5 μm),流动相为甲醇∶水=95∶5,流速1 mL/min,紫外检测器波长 λ=225 nm,柱温30 ℃。
1.2.3 金属离子胁迫对菌株Y2细胞形态的影响 菌株Y2以1%接种量接种至TMM培养基中,其中碳源NPEOs质量浓度为1 000 mg/L,Mn2+质量浓度为500 mg/L。置于水平摇床200 r/min,30 ℃培养2 d时收集菌体。具体操作步骤:7 000 r/min离心3~5 min,PBS缓冲液清洗3~5次,加入2.5%戊二醛后4 ℃固定过夜。PBS缓冲液再次清洗3次,加入1%锇酸进行后固定。随后用PBS缓冲液清洗3次,乙醇梯度脱水并用乙酸异戊酯置换2次。将样品通过CO2临界点干燥和真空喷金处理后,进行SEM观察。
1.2.4 金属离子对NPEOs降解产物的影响 将活化好的菌株Y2按1%接种量接种至TMM中,碳源NPEOs质量浓度为1 000 mg/L,Mn2+质量浓度为500 mg/L。置于水平摇床200 r/min,30 ℃培养5 d。每12 h取样,采用破坏性取样法萃取NPEOs中间代谢产物。等体积三氯甲烷萃取2次后,HCl调节水相pH值至2.0~3.0,等体积乙酸乙酯再萃取1次。合并的有机相真空旋蒸,甲醇定容至5 mL,0.22 μm PVDF膜过滤至液相瓶中GC-MS/MS待测。GC-MS/MS程序:初始温度80 ℃,10 ℃/min升至280 ℃维持5 min,检测器温度280 ℃。进样量10 μL,不分流模式,氦气流速1 mL/min,m/z 范围40~600。
2 结果与分析
2.1 菌株Y2对不同金属离子的耐受性
由表1可知,培养基成分对细菌的金属离子耐受性有显著影响。在0.5×LB中,菌株Y2对Cr3+、Cu2+、Pb2+、Zn2+、Mn2+均具有较高耐受性,MIC范围为160~900 mg/L,对Cr6+最敏感(20 mg/L)。在TMM培养基中,则表现为对Cr3+、Co2+、Pb2+、Zn2+、Mn2+的MIC值为12~500 mg/L;Cu2+和Ni2+仅3、6 mg/L即可明显抑制菌株Y2生长。在营养培养基0.5×LB中表现的MIC普遍高于TMM,说明营养培养基中不同物质间的相互作用导致了过高的MIC0.5×LB值[19]。在TMM培养条件下,菌株Y2对Mn2+、Zn2+有较高的耐受性(500、90 mg/L)。

表1 不同金属离子对菌株Y2的MIC值(mg/L)Table 1 The MIC values of strain Y2 against different metal ions (mg/L)
2.2 金属离子胁迫对菌株Y2降解NPEOs的影响
菌株Y2在TMM培养基中的生长与NPEOs降解呈良好的相关关系(图1),R2为0.944。无金属离子胁迫条件下,菌株Y2生物量在2 d时快速达到最高值(OD600=1.28),随后下降,直至5 d时OD600仅为0.85。此外,NPEOs降解率在2 d时达到100.00%。菌株Y2在500 mg/L Mn2+胁迫条件下生长趋势与对照相似,最大降解率及最大生物量较对照延后1 d(3 d时,OD600=1.28,降解率为100.00%),表明菌株Y2可较好地耐受此浓度的金属离子。但是在Zn2+、Mn2++Zn2+胁迫的培养基中菌株Y2生长被显著抑制,说明90 mg/L Zn2+对菌株Y2的毒害作用显著高于Mn2+。5 d时,Zn2+、Mn2++Zn2+处理组对NPEOs的降解率分别为20.62%、15.65%,可见两种金属离子共存的情况下毒性加强。

图1 菌株Y2在Mn2+和Zn2+胁迫下降解NPEOs和生长情况(n=3)Fig.1 Performance of NPEOs biodegradation and growth curve of strain Y2 in presence of Mn2+ and/or Zn2+ ions(n=3)
2.3 金属离子胁迫对菌株Y2细胞形态的影响
对微生物在复合污染胁迫下的细胞表面形态变化进行了分析,复合污染(NPEOs+Mn2+)显著影响了菌株Y2的细胞超微结构(图2)。菌株Y2在仅有NPEOs条件下的形态,长0.5~1.1 μm,宽0.27~0.42 μm,杆状,细胞整体完整且表面较光滑(图2A)。但在NPEOs和Mn2+双重胁迫下,菌株Y2细胞形貌变化较大,有的细胞结构产生了中部塌陷,表面变得多褶皱甚至破损(图2B、2C)。细胞形貌除了杆状外,有的呈现不规则状,有的则发生了聚集粘结,细胞长0.6~2.1 μm,宽0.25~0.47 μm。有研究指出,在锰氧化细菌胞外可观察到无定形态生物氧化锰[20-21];但本研究中菌株Y2菌体外层并未发现明显的物质膜包裹。

图2 TMM中培养Sphingomonas sp. Y2的SEM图Fig.2 SEM images of Sphingomonas sp. Y2 cultured in TMM唯一碳源为NPEOs。A:无金属离子;B: Mn2+;C:Mn2+With NPEOs as the only carbon source. A:No metal ion stress in TMM; B:Mn2+ stress in TMM;C:Mn2+ stress in TMM
2.4 金属离子对NPEOs降解产物的影响
已有研究表明,环境中的营养物质及微量元素均可显著影响污染物的降解速率、降解效果以及生态毒性[15]。菌株Y2降解NPEOs的代谢产物经HPLC分析表现为两个主要流出峰,分别为产物a(保留时间为2.3~2.5 min)和产物b(保留时间为4.6 min)(图3)。GC-MS/MS分析表明,产物a主要为短链NPECs(NP1EC、NP2EC),产物b主要为短链NPEOs(NP、NP1EO、NP2EO、NP3EO)(图4)。随着培养时间的延长,短链NPEOs(产物b)可被氧化生成短链NPECs(产物a)。有趣的是,Mn2+胁迫显著影响了产物a/b比例,在仅有NPEOs条件下,产物a/b比例由0.18增加至3.05,而在NPEOs和Mn2+复合污染条件下,产物a/b比例由0.14增加至0.68,说明Mn2+离子胁迫抑制/减缓了短链NPEOs的羧化反应,从而减少了羧酸化产物(即NPECs)的生成。
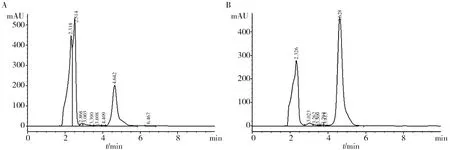
图3 Sphingomonas sp. Y2降解NPEOs的代谢产物Fig.3 The metabolites of NPEOs biodegradation by Sphingomonas sp. Y2A:5 d时,无Mn2+胁迫NPEOs降解产物;B:5 d时,Mn2+胁迫下NPEOs降解产物A:The intermediates of NPEOs without metal ion stress at 5 d; B:The intermediates of NPEOs in presence of Mn2+ stress at 5 d



图4 在TMM培养基中NPEOs降解产物的质谱图Fig.4 The mass spectra of the metabolites of NPEOs biodegradation in TMM
3 讨 论
NPEOs在生活、农业、印染工业中应用广泛,也常用于去除水相、土壤中金属离子[22],因此研究金属离子对NPEOs降解的影响十分必要。影响污染物生物降解的因素主要有微生物活性、基质以及环境因子,其中环境因子主要包括外源添加物、溶解氧、金属离子、温度以及pH等。例如,Kamari等[23]发现Zn2+对壳聚糖生物降解的抑制作用明显高于Cu2+和Pb2+。也有一些研究表明,金属离子对低分子量多环芳烃(如蒽、菲)降解具有促进作用[24]。本研究通过营养培养基(0.5×LB)和重金属培养基(TMM)发现Sphingomonassp. Y2对多种金属离子具有耐受性,在TMM中对Cr3+、Co2+、Pb2+、Zn2+、Mn2+的MIC为12~500 mg/L。500 mg/L Mn2+并未显著影响NPEOs降解效率和菌株Y2生物量,只是将其最佳效果时间由2 d延长为3 d;但90 mg/L Zn2+则对菌株Y2生长和NPEOs代谢产生了显著抑制,5 d时的降解效率仅为20.62%;当Mn2+和Zn2+联合添加时,由于毒性增强导致NPEOs降解效率甚至不足16%,同时考虑到萃取效率、试验操作误差等因素,说明菌株Y2对Mn2+的耐受性显著高于Zn2+。因此,菌株Y2应用于Mn2+/Zn2+污染废水中去除NPEOs类污染物具有潜在价值。
金属离子主要通过影响功能菌的生理机能和生态活动进而影响污染物的生物降解[25]。本研究以Mn2+为代表分析了金属离子胁迫对菌株Y2细胞表面结构的影响,结果显示Mn2+显著改变了菌株Y2的形貌及大小(图2)。推测细胞壁表面呈多孔状的表面层官能团与金属离子发生键合作用,使其表面结构变得更加粗糙,加之细胞在溶液中因渗透作用等原因发生溶胀与塌陷,导致部分细胞结构发生破损[26]。Y2菌体聚集则是因为细胞自身分泌的一些物质使得发生了黏连(图2C)[27]。实际上,当菌株Y2培养在添加有Mn2+的0.5×LB中发现有褐色物质产生,这是典型的氧化现象,与以往报道一致[28]。但是在NPEOs和Mn2+复合污染的情况下,并未在菌株Y2细胞表面发现锰氧化物膜,推测可能是由于无机盐培养基中碳源单一,营养不足,导致氧化还原力受限[29]。微生物抵抗高浓度金属离子的毒害,通常有以下机制:通过酶促或化学反应,将有毒物质还原成无毒/低毒物质;通过阳离子外流系统促进金属离子外排;通过合成螯合物质或结合因子将有毒金属离子络合成复合物[30]。例如,杨楠等[31]指出,菌株C14通过分泌大量胞外多糖(黏液多糖、荚膜多糖等)结合部分重金属,从而提高其对重金属的耐受性。Ralstoniasp. CH34有多种金属离子抗性基因,同时存在于质粒和基因组上[19]。本研究中并未涉及Sphingomonassp. Y2耐受多种金属离子的分子机制研究,后续将结合菌株Y2表观结构动态监测及基因组学、转录组学信息进行深入分析。
Mn2+可作为酶的辅基或激活剂参与生命代谢活动,在真菌代谢中报道较多。糙皮侧耳中的漆酶和锰过氧化物酶活性随Mn2+浓度增加呈现“先升后降”趋势,而木质素过氧化物酶则随着Mn2+浓度增加而降低[32]。但本研究中,Mn2+是否影响了NPEOs代谢过程中关键酶活性有待进一步阐明。Mn2+虽然对NPEOs降解效率无显著影响,但是明显改变了代谢产物的组分组成(图3~4)。Hotta等[15]发现,Mg2+、Ca2+、Fe3+则同时影响了OPEO的降解效率及产物组成。对于菲的降解,Pb2+和Cd2+表现出抑制作用,但只影响中间产物浓度,不影响其组分组成[33]。因此,推测本研究中,该现象可能与金属离子及污染物本身特性有关。本研究中,在Mn2+胁迫下,更多的中间代谢产物以短链NPEOs(而非短链NPECs)形式存在,对照组中短链NPECs含量约为短链NPEOs的3.05倍。与此相反的是,Shibata等[34]研究发现,Ca2+使得OPEOs降解菌PseudomonasputidaS-5积累生成更多的OPECs。OPECs、NPECs等羧酸化合物水溶性强,且更难降解,易释放到地表水和地下水中并长期存在[35]。因此,根据目前结果推测,Mn2+倾向于减少水溶性更强、危害更大的短链NPECs的生成。本研究将为环境中表面活性剂类污染物的生物降解及代谢产物毒性评估提供参考,后续应进一步揭示菌株Y2耐受复合污染的潜在机理并加强微生物菌剂的研发与实践应用。