基于UPLC-MS/MS成分分析结合网络药理学预测新会陈皮黄酮类成分质量标志物
陈超 缪艳燕 李慧君 李卫岗 张文生
陈皮分“陈皮”和“广陈皮”,为中医药临床常用药,具有理气健脾,燥湿和胃的作用。陈皮用药载于《广州府志》:“入药以广陈皮为贵,出新会者最良。”茶枝柑是新会陈皮的品种来源[1],又名新会柑。明代刘文泰在《本草品汇精要》中提到橘皮“谨按青橘、黄橘”,“功用既殊,性味亦异”,但在采摘时间上提及黄橘“十月取实”,在《中华本草》中,规定陈皮十至十二月果实成熟时取下。《中药大词典》注解橘皮来源于“10月以后采摘成熟果实”,其所含的挥发油、多糖、多酚、黄酮等成分具有较强的药理活性作用[2]。从陈皮中分离并鉴定的140种化学成分中,除挥发油外,黄酮类化合物是主要的生物活性和特征成分[3]。现代药理研究表明,黄酮类化合物具有较强的抗氧化、抗菌、抗肿瘤及心脑血管保护作用[4],其中又以橙皮苷[5]、川陈皮素[6-7]、橘皮素[8]及多甲氧基黄酮[9]等成分的药理研究较多。基于此,全面解析新会陈皮黄酮类成分的质量标志物(quality marker,Q-marker)[10]对提高新会陈皮的临床应用具有重要意义。
本研究首先通过新会陈皮代谢组学鉴定出黄酮类化合物,查找主要作用靶点,构建从分子到蛋白,从蛋白到疾病的分子网络;之后利用基因本体注释(gene ontology,GO)[11]和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)[12]等生物信息富集分析,从信息学角度探索主要黄酮类化合物与其药用价值的关联性;最后采用分子对接技术,以核心靶点蛋白的配体作为对照,评估黄酮化合物与靶点蛋白结合的可能性,并耦合文献检索证据为黄酮类化合物作为新会陈皮Q-marker提供理论依据。
1 材料与方法
1.1 仪器
超高效液相色谱(SHIMADZU Nexera X2)串联质谱(Applied Biosystems 4500 QTRAP),美国安捷伦公司;烘箱(UF160plus),Memmert;离心机(5425 R),Eppendor;超低温冰箱(902GP-ults),Thermo Fisher。
1.2 试药
茶枝柑果皮经干燥后作为样品,采样时间为2020年11月中旬,地点为新会东甲村果园(新会站北200米)。甲醇(色谱纯,Merck),乙醇(色谱纯,Merck),标准品(色谱纯,BioBioPha/Sigma-Aldrich)。
1.3 陈皮成分UPLC-MS/MS前处理
新会陈皮样品干燥后用研磨仪研磨至粉末状。精确称取粉末0.1 g,溶于含70%甲醇的提取液1.2 mL中。涡旋6次,每次30秒,间隔时间30分钟,并放置4°C过夜萃取。使用时,12000 r/分钟离心10分钟,取上清,用0.22 μm微孔滤膜过滤后,存于进样瓶。
1.4 陈皮成分UPLC-MS/MS分析
液相色谱条件:色谱柱:AgilentSB-C18 1.8 μm,2.1 mm×100 mm;流动相:A相为0.1%的甲酸的超纯水,B相为含0.1%的甲酸的乙腈;洗脱梯度为5%~95%,9分钟。10~11分钟时,B相比例降为5%,并以5%平衡至14分钟;流速0.35 mL/分钟,柱温40°C。
质谱条件(迈特维尔生物科技有限公司,武汉):由Analyst 1.6.3软件(AB Sciex)控制运行正负两种离子模式。电喷雾电离源(ESI)操作参数如下:离子源,涡轮喷雾;源温度550°C;离子喷雾电压(IS)5500 V(正离子模式)/-4500 V(负离子模式)。离子源气体I(GSI),气体II(GSII)和帘气(CUR)分别设置为50、60和25.0 psi,碰撞诱导电离参数设置为高。在三重四级杆和线性离子阱模式下分别用10 μmol/L和100 μmol/L聚丙二醇溶液进行仪器调谐和质量校准。三重四级杆扫描使用多反应检测扫描模式,并将碰撞气体(氮气)设置为中等。
1.5 陈皮化学成分鉴定
质控样本由样本混合制备而成,在测样时混入确保仪器检测时的稳定性。用MultiaQuant 2.0软件进行色谱峰的积分和校正工作(去除杂峰),用色谱峰的峰面积代表陈皮中化合物的相对含量,并通过本地数据库鉴定所测黄酮类化合物的相对含量。
1.6 成分—靶点网络图构建
在中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)[13]和SwissTargetPrediction数据库[14]中检索新会陈皮候选化合物靶点,合并数据后,规范靶点基因名,得到有美国化学文摘服务社(chemical abstracts service, CAS)登记号的化合物和靶点蛋白,用Cytoscape 3.9.0软件构建成分—靶点网络图。
1.7 蛋白互作(protein-protein interaction,PPI)网络构建
将预测的化合物靶向蛋白导入STRING数据库[15],物种参数设置为人,互作评分参数大于0.9,去除网络图谱中的单一节点后,用Cytoscape重构靶向蛋白互作网络。
1.8 GO与KEGG富集分析
运用R包clusterProfiler[16]对靶点蛋白进行GO分析,包括生物过程(biological process, BP)、细胞组成(cellular component, CC)和分子功能(molecular function, MF),用多重假设检验(Benjaminiand hochberg,BH)方法控制假阳性(BH<0.001)。KEGG通路富集分析时使用BH<0.001。
1.9 核心成分—靶点—通路网络构建
将关注的陈皮重要成分、预测的重要蛋白靶点及其相应的关键KEGG通路在Cytoscape中构建成分—靶点—通路网络图。
1.10 核心靶点组织分布
从人类蛋白质图谱(The Human Protein Atlas)数据库[17]下载基于免疫组化的组织微阵列的人类组织蛋白质的表达谱数据,筛选核心靶点蛋白组织表达数据后,用Cytoscape整理核心靶点组织表达数据,构建核心靶点组织分布网络图。
1.11 分子对接分析
从蛋白质结构数据库(protein data bank,PDB)[18]中选择辨析度较高的晶体结构作为候选靶点蛋白的3-D结构,下载PDB格式文件后,用Autodock分离蛋白中的配体,作为对照结合化合物。配体分子结构(Mol2格式)从ZINC数据库[19]下载。
用AutoDockTools 4.2.6对蛋白结构进行去水分子、加氢、加电荷预处理。通过AutoDockVina实现配体与受体的分子对接计算,获得结合能。
2 结果
2.1 陈皮黄酮类化合物鉴定及其靶点互作网络分析
2.1.1 陈皮主要黄酮类化合物鉴定 图1中每个不同颜色的质谱峰代表一种化学物质(只展示QC的负离子模式),通过UPLC-MS/MS本地数据库鉴定所测黄酮类化合物的相对含量,共获得新会陈皮黄酮化合物197种,取相对含量前25%作为候选标志物。

图1 MRM代谢物检测多峰图(负离子模式)
2.1.2 候选化合物靶点预测 新会陈皮候选化合物中有50种相对含量较高(相对含量前25%),包括5-羟基-3,7,3′,4′-四甲氧基黄酮,7,8-二羟基-5,6,4′-三甲氧基黄酮,高车前素-7-O-葡萄糖苷,金圣草黄素-8-C-葡萄糖苷(金雀花素),山奈酚-3-O-新橙皮糖苷等。用CAS号在TCMSP和SwissTargetPrediction数据库中检索化合物靶点,去重合并数据后,规范靶点基因名,得到有CAS号的39个化合物及其相关蛋白492个。导入Cytoscape 3.9.0后,使用CentiScaPe 2.2插件计算网络图的中心“度”,见图2。其中CAS 478-01-3(川陈皮素)、10236-47-2(柚皮素-7-O-新橙皮糖苷)、1245-15-4(5-羟基-3,7,3′,4′-四甲氧基黄酮)的度值较大分别为129、127、125。

注:蓝色圆形代表化合物,大小代表度值大小;其中CAS 478-01-3(川陈皮素)、10236-47-2(柚皮素-7-O-新橙皮糖苷/柚皮苷)、1245-15-4(5-羟基-3,7,3′,4′-四甲氧基黄酮)的度值分别为129、127、125。
2.1.3 候选化合物靶点蛋白互作网络分析 将预测的化合物靶向蛋白共492个导入STRING数据库[15],去除网络图谱中的单一节点后,用Cytoscape重构靶向蛋白互作网络,结果见图3。选取压力中心度前10(压力大小表明这个分子参与细胞过程的重要性)的靶点作为关键分子,分别为细胞肿瘤抗原(cellular tumor antigen p53,TP53,压力144524.0)、原癌基因酪氨酸—蛋白激酶(proto-oncogene tyrosine-protein kinase,SRC,压力126236.0)、热休克蛋白(heat shock protein HSP90-alpha,HSP90-α,压力113134.0)、有丝分裂原激活蛋白激酶3(mitogen-activated protein kinase 3,MAPK3,压力80444.0)、有丝分裂原激活蛋白激酶1(MAPK1,压力78814.0)、转录因子-1(transcription factor AP-1,JUN,压力73930.0)、视黄酸受体(retinoic acid receptor RXR-alpha,RXRα,压力72566.0)、RAC-α丝氨酸/苏氨酸蛋白激酶(RAC-α serine/threonine-protein kinase,AKT1,压力64714.0)、雌激素受体(estrogen receptor 1,ESR1,压力62910.0)、细胞周期蛋白依赖性激酶1(cyclin-dependent kinase 1,CDK1,压力58386.0)。
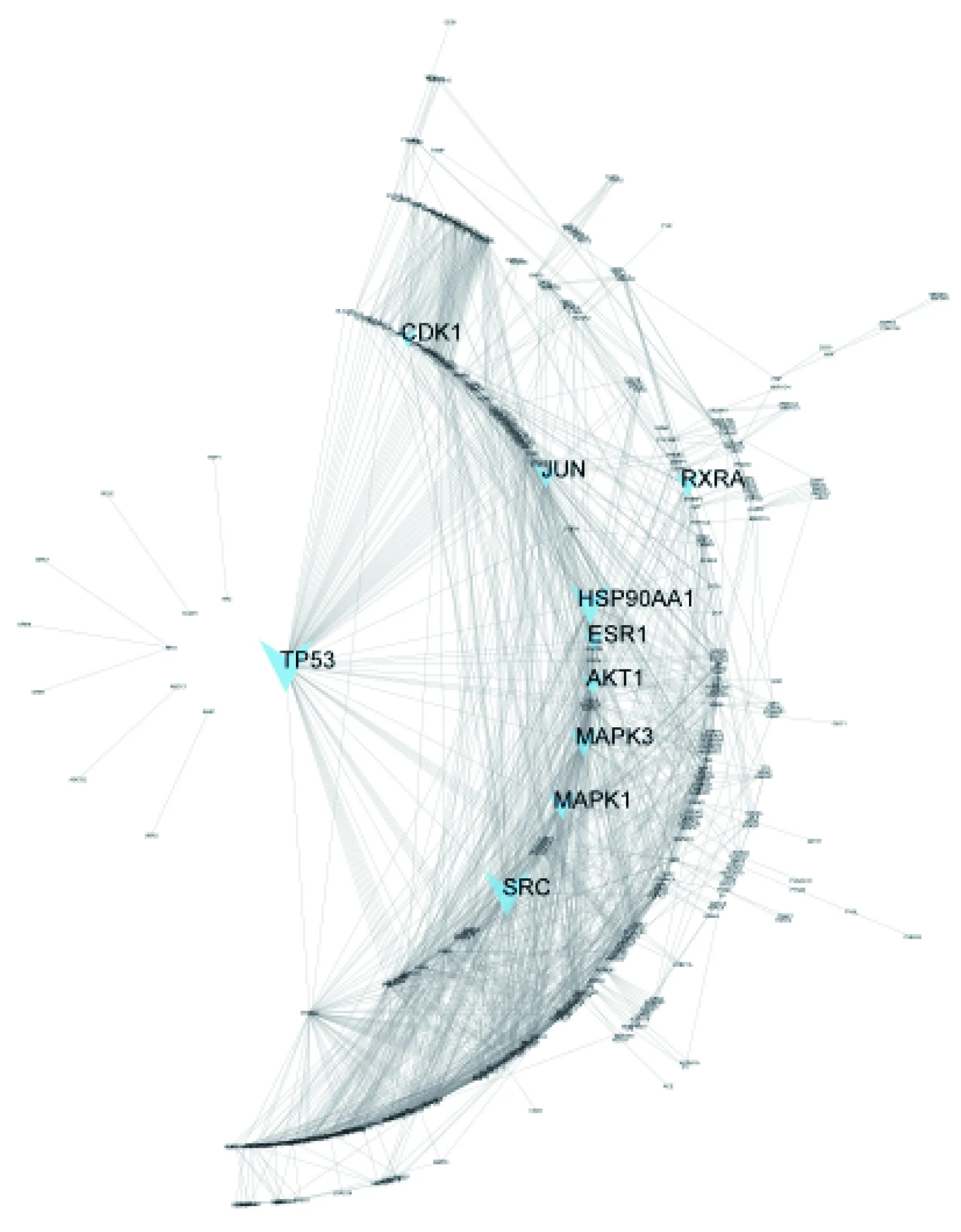
注:蓝色箭头代表在该蛋白互作网络中压力中心度较大的10种蛋白。
2.2 陈皮黄酮类化合物网络药理学分析
2.2.1 GO与KEGG富集分析 运用R包clusterProfiler对10个靶点进行GO分析,包括生物过程(biological process, BP)、细胞组成(cellular component, CC)和分子功能(molecular function, MF),用BH方法控制假阳性(BH<0.001),共获得BP 207个,CC 4个,MF 13个,将各自的前5个条目绘制于表1。生物过程富集最显著的是对DNA代谢过程的正调控、端粒酶活性的调节、细胞对氧化应激的反应、镉离子反应,细胞组成为小窝、质膜筏、核染色质、伪基质,分子功能包含蛋白丝氨酸/苏氨酸/酪氨酸激酶活性、磷酸酶结合、支架蛋白结合、磷蛋白结合、泛素蛋白连接酶结合。

表1 GO注释功能富集分析
KEGG分析(BH<0.001)共获得92条通路,前10条KEGG通路为内分泌抵抗、化学致癌—受体激活、脂质和动脉硬化、甲状腺激素信号传导途径、雌激素信号传导途径、乳腺癌、催乳素信号通路、乙型肝炎、非小细胞肺癌、ErbB信号传导途径。说明筛选出的10个靶点蛋白可能通过这些通路发挥药理活性,改善疾病病理变化。见表2。

表2 KEGG信号通路富集结果
2.2.2 核心成分—靶点—通路网络构建 将3个重要成分,10个预测蛋白靶点和10个KEGG通路在Cytoscape中构建网络关系图,详见图4。
以Centiscape插件计算网络图的中心“度”值为参考,成分柚皮苷(Naringin)、川陈皮素 (Nobiletin)较5-羟基-3,7,3′,4′-四甲氧基黄酮(Retusin)有更高的“中心”度,AKT1、MAPK3、MAPK1、SRC 四个基因的度值均大于10(10~13),对网络的节点联通的贡献度较其它基因更高。KEGG通路中化学致癌—受体激活通路(chemical carcinogenesis-receptor activation)和脂质和动脉硬化通路(lipid and atherosclerosis)的度值均为8,较其它通路高。

注:蓝色V形代表化学成分、青色矩形代表关键靶点、绿色椭圆代表KEGG通路,节点大小代表度值大小。Nobiletin:川陈皮素;Naringin:柚皮苷;Retusin :5-羟基-3,7,3′,4′-四甲氧基黄酮。
2.2.3 核心靶点组织分布 从The Human Protein Atlas数据库[17]下载基于免疫组化的组织微阵列的人类组织蛋白质的表达谱数据,筛选AKT1、MAPK3、MAPK1、SRC四种蛋白组织表达数据,共获取277项表达数据。用Cytoscape整理核心靶点组织表达数据,见图5。AKT1在85种组织中检测到,MAPK3在81种组织中检测到,MAPK1在81种组织中检测到,SRC在30种组织中检测到。度值最大的分别为大脑皮层(cerebral cortex)的神经胶质细胞中(glial cells)、皮肤1(skin 1)中的黑色素细胞(melanocytes)、睾丸(testis)精管中的细胞(cells in seminiferous ducts)。
2.3 陈皮黄酮类化合物分子对接靶点分析及文献检索
2.3.1 黄酮类化合物分子关键靶点及其配体结构获取 从PDB数据库中选择辨析度较高的晶体结构作为AKT1、MAPK3、MAPK1、SRC四种蛋白的3-D结构,依次为1h10、4qtb、6slg、2hb8。下载PDB格式文件后,用Autodock分离蛋白中的配体,作为对照化合物,见表3。柚皮苷(Naringin)、川陈皮素(Nobiletin)的分子结构(Mol2格式)从ZINC数据库下载。
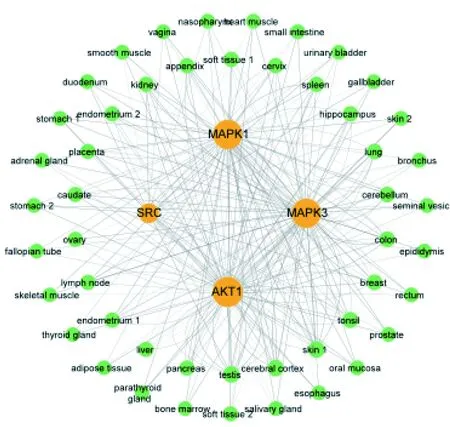
注:黄色圆形代表核心基因、绿色圆形代表人体组织或器官,节点大小代表度值大小,连线的粗细表示蛋白表达在组织中的高、中、低3个层次。AKT1:RAC-α丝氨酸/苏氨酸蛋白激酶;MAPK3:有丝分裂原激活的蛋白激酶3;MAPK1:有丝分裂原激活的蛋白激酶1;SRC:原癌基因酪氨酸蛋白激酶。

表3 靶点—对照化合物信息
2.3.2 分子对接 用AutoDock Tools 4.2.6对蛋白结构进行去水分子、加氢、加电荷预处理。通过AutoDock Vina实现配体与受体的分子对接计算,获得结合能后,将配体各构象与蛋白的最低结合能数据列于表4。

表4 受体与配体结合的吉布斯自由能
“广陈皮”已被列入《中华人民共和国药典(一部)》,橙皮苷、川陈皮素和橘皮素作为质量检测物质用于控制药材与饮片质量。因此,本文只用Pymol 2.5软件展示柚皮苷分子对接结果,结合位点用笼型球体标注可能的氢键位置,见图6。

图6 柚皮苷与靶点蛋白的结合
柚皮苷、川陈皮素与AKT1、MAPK3、MAPK1的结合能均较与蛋白相结合的原有化合物的结合能更低,而与SRC的结合能较标准物高。柚皮苷与SRC的结合能是-7.7 kcal/mol,川陈皮素与SRC的结合能是-7.4 kcal/mol。一般而言,结合能值小于-4.0 kcal/mol时,表明配体有较强的生物活性[20-21]。因此柚皮苷、川陈皮素和AKT1、MAPK3、MAPK1及SRC的结合在自由能预测上效果较好。
2.3.3 柚皮苷、川陈皮素有效性佐证 新会陈皮中黄酮类化合物的药效作用可以通过文献佐证(见表5)。文献中柚皮苷在呼吸道、神经细胞、肺部、心血管、皮肤、睾丸等组织中均有发挥作用,川陈皮素在肠、卵巢、胎膜和子宫、皮肤、心脏、神经和睾丸等组织中发挥作用,与柚皮苷、川陈皮素的活性作用的4个主要靶点的组织分布相一致。
AKT1调控途径的破坏与癌症、糖尿病、心血管和神经系统疾病有关[38-40],其在多种细胞信号机制中发挥着关键作用,涉及细胞代谢、生长和分裂、细胞凋亡抑制和血管生成。MAPK3和MAPK1属于有丝分裂原激活蛋白激酶,是调节各种细胞过程的关键信号通路,包括增殖、分化、凋亡和应激反应[41]。SRC家族激酶是一个非受体蛋白酪氨酸激酶家族,它们在信号转导和调节各种细胞生物过程中至关重要,如增殖、分化和凋亡[42]。
新会陈皮中“主要”黄酮类化合物靶向的重要通路是化学致癌—受体激活通路及脂质和动脉硬化通路。非基因毒性化合物致癌过程需要细胞表面或细胞内受体的参与,通过激活信号转导途径,导致包括基因转录在内的生化反应。该通路信号的转导与癌症有关。而脂质和动脉硬化通路的改变与多数心血管疾病及其并发症的发生有关,包括冠状动脉疾病、心肌梗塞和中风等疾病。柚皮苷和川陈皮素的核心靶向通路与细胞生长、分裂、脂类代谢相关。此外,脂质代谢失调对中枢神经系统的损伤和紊乱十分重要[43],而且大量与脂质代谢有关的分子突变被认为与运动神经元退行性疾病有关[44]。因此,脂质和动脉硬化通路与柚皮苷、川陈皮素对神经的保护作用直接相关。
3 讨论
陈皮在古方剂中被广泛应用并一直沿用至今。如《本草纲目》载:“其治百病,总是取其理气燥湿之功,同补药则补,同泻药则泻,同升药则升,同降药则降。”现代处方主要用于呼吸系统、消化系统、心血管疾病和妇科疾病等[45-46]。新会陈皮作为陈皮中的特殊地理品种有其独特的药理作用,《新会乡土志》记载:“柑皮之独可入药,为他地所不及”,而清代名医叶天士所开的“二陈汤”注明只用“新会皮”,因此有必要深入研究其化学成分的药理作用。
本研究测得新会陈皮中黄酮类化合物共197种,由于中药量效关系尚未形成完整的理论体系[47],本研究取相对含量前25%,共39种黄酮化合物作为研究对象,以排除可能“不够量”的活性成分干扰,明晰可发挥药效的化学成分。同时,本研究通过网络药理学共获得39种黄酮化合物的492个靶蛋白,在核心成分与核心靶点存在互作关系的前提下,通过构建核心成分—靶点—通路网络图,从而辨别新会陈皮的质量标志物,这样的思路与大部分中药网络药理学研究不同。首先,依赖现有成分(化合物)靶点数据库信息筛选靶点最多的化合物一共三个(图2),作为成分集合A;其次,将含量前25%的黄酮成分的所有靶点构建成一个PPI网络,由于PPI网络的压力中心度与该蛋白参与的细胞过程的重要性高度相关,因此我们选取压力中心度最高的十个蛋白作为一个靶点集合B(图3),该集合中的靶点是新会陈皮行使生物学功能的核心靶蛋白;最后,当集合A的成分和集合B的蛋白有相互作用时,才能构建出核心成分—靶点—通路网络(图4),该网络的可生成预示着这些基因与抗氧化、抗肿瘤、抗炎、祛痰、平喘、促消化、降脂、保肝、心肌保护等多种药理作用相关,其作用机制可能源于三个度值最高的化学成分(常规网络药理学仅依赖图2中的度值确定质量标志物)。
此外,依据网络中心度的概念,在核心成分—靶点—通路网络中进一步确定陈皮素、柚皮苷和AKT1、MAPK3、MAPK1、SRC四个靶蛋白为新会陈皮关键成分与靶点,其富集的相应高度值通路为化学致癌—受体激活及脂质和动脉硬化通路。除SRC在30种组织中检测到外,AKT1、MAPK3、MAPK1可以在人体80余种组织中有较高的表达量(图5),预示柚皮苷和川陈皮素的功效较为广泛,这一点和陈皮配伍成方剂可治疗多种组织疾病一致[48],也与文献检索结果一致(表5)。分子对接从数据模拟上验证了川陈皮素、柚皮苷与四个核心靶点的结合能力(图6), 揭示了其对疾病的可能干预机制,这一点同样与文献检索数据一致(表5)。但是,该研究也存在一些网络药理学研究存在的共性问题,例如成分与靶点的互作信息来源与数据库有关。如果能用人工智能模拟成分与蛋白质靶点之间在三维空间上的相互作用[49],进而无约束的预测化合物的相应靶点,不仅可对未收入数据库的成分和靶点进行分析,且可降低数据库对成分—靶点网络图中的中心度值影响,这对于今后进一步阐明新会陈皮药理作用机制,筛选其中的质量标志物具有重要意义。

表5 质量标志物文献信息
总之,本文预测新会陈皮黄酮类化合物质量标志物为川陈皮素和柚皮苷,通过网络药理学分析了川陈皮素和柚皮苷的作用机制及作用位置,同时耦合文献检索证据检验了川陈皮素和柚皮苷的生物效应,可为新会陈皮黄酮类成分质量标志物奠定工作基础。

