lncRNA SNHG14靶向miR-149-5p调控MIA诱导的骨关节炎模型细胞损伤
黄炜 贺媛 张卫涛
骨关节炎(osteoarthritis,OA)是最常见的慢性退行性关节疾病,是由关节软骨破坏、软骨下骨改变或滑膜积液引起的,引起关节疼痛和僵硬[1,2]。骨关节炎的流行病学非常复杂,其分子机制仍未完全了解。软骨细胞是维持软骨结构和功能的重要细胞结构,其死亡会破坏胞外基质合成与降解的平衡,从而进一步加剧OA[3]。长链非编码RNA(lncRNAs)是指长度超过200个核苷酸且不具备蛋白质编码能力的RNA分子,已被证实在炎症相关疾病的发生发展中发挥重要作用[4]。研究发现,在MPP诱导的帕金森细胞模型中,lncRNA SNHG14表达上调,下调lncRNA SNHG14通过miR-214-3p/KLF4轴增强细胞活力、抑制细胞凋亡和促炎因子的产生来减轻细胞损伤[5]。在OGD/R诱导的HT22小鼠海马神经元细胞损伤中,lncRNA SNHG14通过miR-182-5p/BINP3轴诱导HT22细胞过度自噬,从而加剧神经元损伤[6]。然而lncRNA SNHG14在骨关节炎中的作用尚不清楚。本实验通过StarBase预测发现lncRNA SNHG14与miR-149-5p具有结合位点。研究报道,下调miR-149逆转了抑制PVT1表达对IL-1诱导的软骨细胞异常代谢功能障碍和炎症的影响[7]。尽管已有研究确定miR-149在骨关节炎中的作用,但lncRNA SNHG14在骨关节炎中的作用及其机制是否与miR-149-5p有关目前还尚未可知。因此,本实验旨在研究lncRNA SNHG14是否通过靶向调控miR-149-5p表达来影响脓毒症炎性反应。
1 材料与方法
1.1 材料与试剂 雄性SD大鼠,购自上海斯莱克实验动物有限公司;碘乙酸纳(MIA)购自美国Sigma公司;DMEM培养液购自上海钰森生物技术有限公司;胎牛血清购自杭州亦博生物科技有限公司;Annexin V-FITC/PI凋亡检测试剂盒购自上海晶抗生物工程有限公司;RIPA蛋白裂解液、BCA试剂盒购自上海研谨生物科技有限公司;MDA、SOD、CAT检测试剂盒购自南京建城生物工程研究所;Trizol试剂、反转录试剂盒、荧光定量试剂盒购自日本Takara公司;Lipofectamine2000购自上海信帆生物科技有限公司。
1.2 大鼠软骨细胞制备 无菌环境下,小心刮取大鼠双侧膝关节胫骨坪及髌骨内侧透明软骨,充分漂洗数次,剪碎至1 mm3,依次用0.25%胰蛋白酶和0.2%胶原酶消化,得到单细胞悬液,用DMEM/F-12培养基重悬细胞,培养于37℃ 和 5% CO2培养箱中,取2~3代对数生长期细胞用于后续实验。
1.3 MIA处理与分组 将分离培养的大鼠软骨细胞记为对照组,将经4 μmol/L MIA 处理 24 h 的大鼠软骨细胞记为MIA组,将si-NC、si-SNHG14分别转染至MIA组中,记为MIA+si-NC组和MIA+si-SNHG14组;将miR-NC、miR-149-5p分别转染至MIA组中,记为MIA+miR-NC组和MIA+miR-149-5p组;将si-SNHG14分别与anti-miR-NC、anti-miR-149-5p共转染至MIA组中,记为si-SNHG14+anti-miR-NC组和si-SNHG14+anti-miR-149-5p组。
1.4 实时荧光定量PCR(RT-qPCR) 提取各组细胞总RNA,反转录成cDNA,按试剂盒说明进行PCR,检测各组lncRNA SNHG14和miR-149-5p水平以验证转染效果。lncRNA SNHG14上游引物序列:5’-GGGTGTTTACGTAGACCAGAACC-3’,下游引物序列:5’-CTTCCAAAAGCCTTCTGCCTTAG-3’;miR-149-5p上游引物序列:5’-CCCTCATTCTGT GCCACACTCCAGCTGGG-3’,下游引物序列:5’-TGGTGTCGTGGAGTCG-3’;GAPDH上游引物序列:5’-AATTCCATGGCACCGTCAAG-3’,下游引物序列:5’-TGGACTCCACGACGTACTC-3’;U6上游引物序列:5’-GCTTCGGCAGCACATATACTAAAAT-3’,下游引物序列:5’-CGCTTCACGAATTTGCGTGTCAT-3’;引物由上海生工生物工程公司合成。
1.5 Annexin V检测细胞凋亡 按照Annexin V-FITC/PI试剂盒说明检测SW480细胞凋亡,收集细胞并用PBS漂洗2次,结合缓冲液重悬后,加入Annexin V-FITC、碘化丙啶(PI)各5 μl,37℃孵育15 min后,用流式细胞仪检测细胞凋亡。
1.6 蛋白质印迹(Western blot)法检测蛋白表达 提取各组细胞总蛋白,用BCA试剂盒进行定量。各组蛋白上样量60 μg,进行SDS-PAGE后转移至PVDF上,用5%脱脂牛奶室温封闭,然后加入一抗4℃孵育过夜,PBS洗涤3次,加入二抗室温孵育2 h,PBS洗涤3次,暗室中曝光显影,定影,用Quantity One软件检测各组蛋白条带灰度值,以目的条带和GAPDH条带的比值作为蛋白表达水平。
1.7 MDA水平与SOD和CAT活性测定 按照MDA、SOD、CAT检测试剂盒说明书检测各组软骨细胞中MDA水平与SOD和CAT活性。
1.8 双荧光素酶报告实验检测lncRNA SNHG14和miR-149-5p的靶向关系 构建SNHG14野生型和突变型荧光素酶表达载体WT-SNHG14和MUT-SNHG14,将其分别与miR-NC和miR-149-5p共转染至MIA组软骨细胞中,按照说明书检测荧光素酶活性。

2 结果
2.1 lncRNA SNHG14和miR-149-5p在MIA诱导软骨细胞损伤中的表达 与对照组比较,经MIA诱导的软骨细胞中,SNHG14的表达水平升高,miR-149-5p的表达水平降低(P<0.05)。见表1。
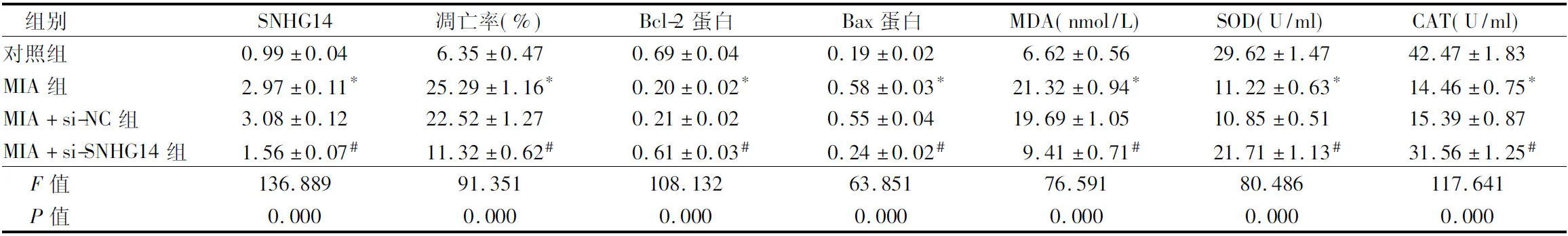
表1 lncRNA SNHG14和miR-149-5p在MIA诱导软骨细胞损伤中的表达
2.2 抑制lncRNA SNHG14表达对MIA诱导软骨细胞损伤的影响 与对照组比较,MIA组SNHG14的表达水平升高,细胞凋亡率升高,Bcl-2表达水平降低,Bax表达水平升高,MDA表达水平升高,SOD和CAT活性降低(P<0.05);与MIA+si-NC组比较,MIA+si-SNHG14组SNHG14的表达水平降低,细胞凋亡率降低,Bcl-2表达水平升高,Bax表达水平降低,MDA表达水平降低,SOD和CAT活性升高(P<0.05)。见图1,表2。
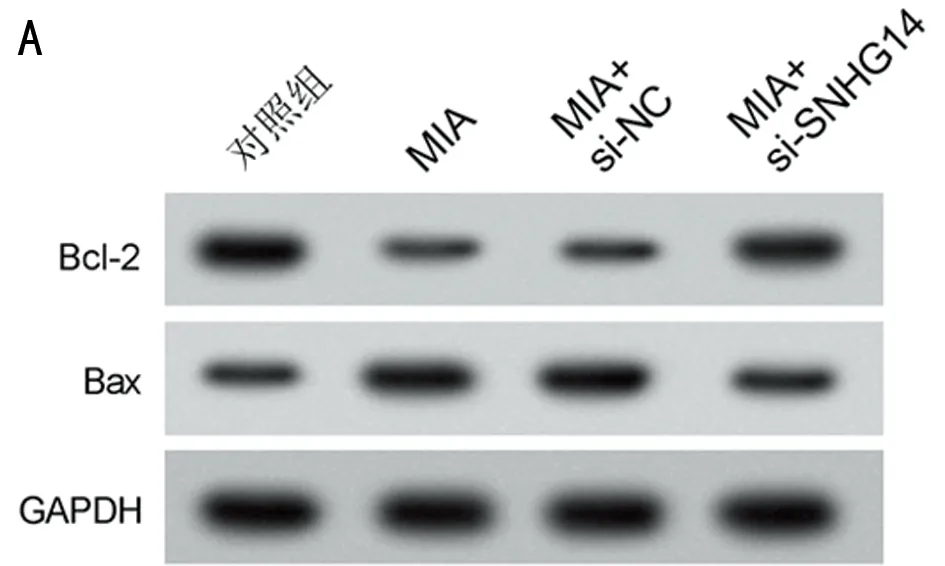
图1 抑制lncRNA SNHG14表达对MIA诱导软骨细胞凋亡的影响;A 细胞凋亡流式图;B 凋亡相关蛋白表达
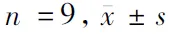
表2 抑制lncRNA SNHG14表达对MIA诱导软骨细胞损伤的影响
2.3 lncRNA SNHG14靶向调控miR-149-5p的表达(LncBase Predicted v.2) StarBase预测显示lncRNA SNHG14的序列中含有与miR-149-5p互补的核苷酸序列。双荧光素酶实验显示,与转染miR-NC的WT-SNHG14比较,转染miR-149-5p的荧光素酶活性降低(P<0.05),而转染miR-NC和miR-149-5p的MUT-SNHG14中,荧光素酶活性无差异(P>0.05)。与pcDNA组比较,pcDNA-SNHG14组的miR-149-5p表达水平降低(P<0.05);与si-NC组比较,si-SNHG14组miR-149-5p表达水平升高(P<0.05)。见图2,表3、4。
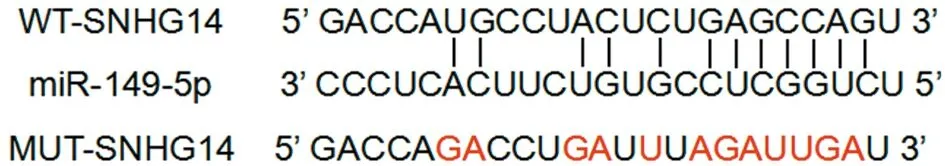
图2 lncRNA SNHG14的序列中含有与miR-149-5p互补的核苷酸序列

表3 双荧光素酶报告实验

表4 lncRNA SNHG14调控miR-149-5p的表达
2.4 过表达miR-149-5p对MIA诱导软骨细胞损伤的影响 与MIA+miR-NC组比较,MIA+miR-149-5p组miR-149-5p的表达水平升高,细胞凋亡率降低,Bcl-2表达水平升高,Bax表达水平降低,MDA表达水平降低,SOD和CAT活性升高(P<0.05)。见图3,表5。

表5 过表达miR-149-5p对MIA诱导软骨细胞损伤的影响
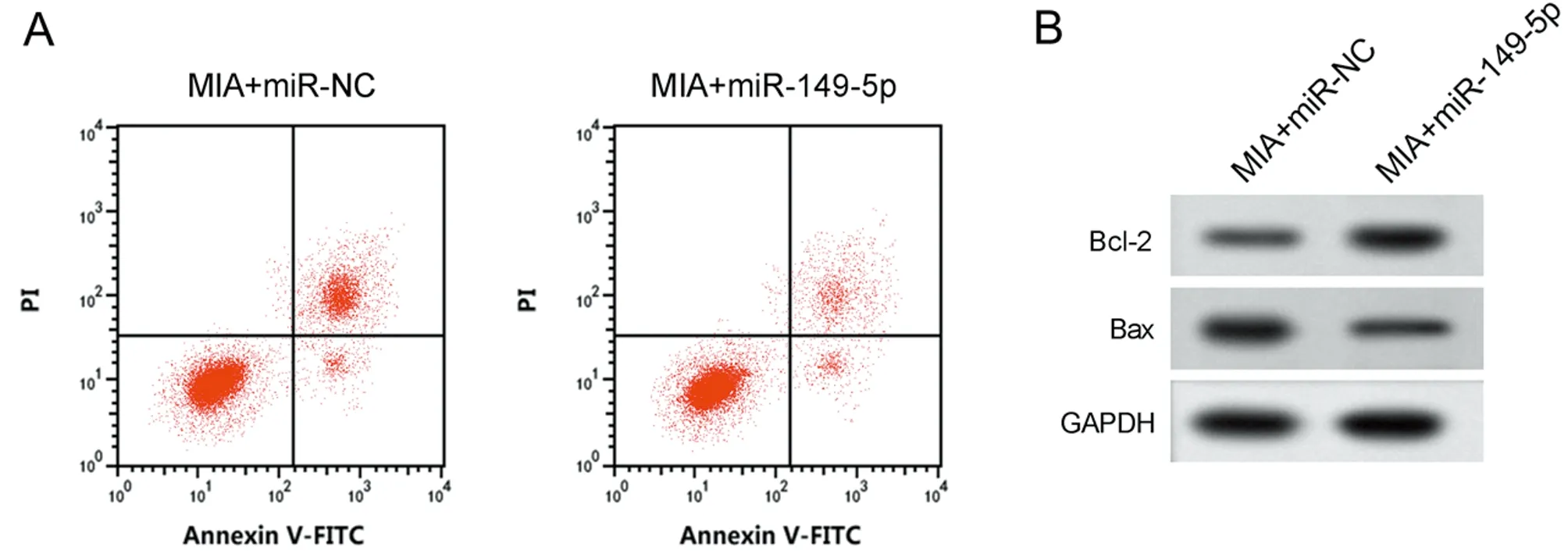
图3 过表达miR-149-5p对MIA诱导软骨细胞损伤的影响;A 凋亡相关蛋白表达;B 细胞凋亡流式图
2.5 干扰miR-149-5p表达逆转了抑制lncRNA SNHG14表达对MIA诱导软骨细胞损伤的作用 与MIA+si-SNHG14+anti-miR-NC组比较, MIA+si-SNHG14+anti-miR-149-5p组miR-149-5p的表达水平降低,细胞凋亡率升高,Bcl-2表达水平降低,Bax表达水平升高,MDA表达水平升高,SOD和CAT活性降低(P<0.05)。见图4,表6。

图4 干扰miR-149-5p表达逆转了抑制lncRNA SNHG14表达对MIA诱导软骨细胞凋亡的作用;A 凋亡相关蛋白表达;B 细胞凋亡流式图

表6 干扰miR-149-5p表达逆转了抑制lncRNA SNHG14表达对MIA诱导软骨细胞损伤的作用
3 讨论
研究发现,lncRNA的异常表达参与了许多炎症相关疾病。在帕金森病小鼠脑组织中,lncRNA SNHG14表达上调,在鱼藤酮诱导的MN9D细胞中,lncRNA SNHG14过表达,干扰lncRNA SNHG14通过调控miR-133b/α-synuclein通路减轻鱼藤酮诱导的神经元损伤[8]。在急性肺损伤中,lncRNA SNHG14和WISP1表达升高,miR-34c-3p表达降低,下调lncRNA SNHG14和过表达miR-34c-3p均降低IL-18、IL-1β、TNF-α和IL-6的表达水平,下调lncRNA SNHG14通过miR-34c-3p/WISP1轴缓解LPS诱导的急性肺损伤[9]。在脑缺血再灌注诱导的PC12细胞损伤中,lncRNA SNHG14通过miR-136-5p/ROCK1轴加重神经损伤和炎性反应[10]。在小鼠大脑中动脉闭塞模型和小胶质细胞缺氧缺糖模型中,lncRNA SNHG14过表达,敲减lncRNA SNHG14分别上调和下调miR-145-5p和PLA2G4A的表达,从而逆转缺氧缺糖对BV-2细胞的激活作用[11]。在低密度脂蛋白诱导的动脉粥样硬化细胞模型中,lncRNA SNHG14表达上调,lncRNA SNHG14通过miR-186-5p/WIPF2轴调节细胞增殖和凋亡[12]。在AngⅡ诱导心肌细胞肥大中,lncRNA SNHG14和PCDH17均可逆转敲除SP1基因对心肌细胞肥大的抑制作用[13]。在小鼠小胶质细胞缺血-再灌注损伤中,lncRNA SNHG14表达上调,右美托咪定可抑制小鼠小胶质细胞的活化,并下调lncRNA SNHG14表达,过表达lncRNA SNHG14通过上调HMGB1表达逆转了右美托咪定对小鼠小胶质细胞缺血-再灌注损伤的治疗作用[14]。与上述结果相似,本实验结果显示,在MIA诱导的软骨细胞中,lncRNA SNHG14表达水平升高,细胞凋亡率升高,Bcl-2表达水平与SOD和CAT活性降低,Bax和MDA表达水平升高;抑制lncRNA SNHG14表达降低了细胞凋亡率,提高了Bcl-2表达水平与SOD和CAT活性,降低了Bax和MDA表达水平。提示抑制lncRNA SNHG14表达可抑制细胞凋亡和氧化应激反应,从而减轻MIA诱导的软骨细胞损伤。
研究表明lncRNA SNHG14可作为竞争性内源RNA负调控炎症相关miRNA表达来促进相关疾病进展[5-6,8-13]。本实验的StarBase预测显示,lncRNA SNHG14的序列中含有与miR-149-5p互补的核苷酸序列,双荧光素酶报告实验结果显示,在WT-SNHG14中,miR-149-5p组的双荧光素酶活性显著降低,且过表达和抑制lncRNA SNHG14分别降低和提高miR-149-5p的表达水平,即lncRNA SNHG14靶向负调控miR-149-5p表达。研究表明,miR-149参与了炎症相关疾病的发生发展,在ox-LDL处理的人血管内皮细胞中,miR-149-5p表达降低,Circ 0124644通过miR-149-5p/PAPP-A轴加重内皮细胞[15]。褪黑素通过上调miR-149表达抑制缺血诱导的成肌细胞纤维化[16]。在缺血再灌注(I/R)诱导的脑损伤中,miR-149-5p表达下调,miR-149-5p通过Sirt1/p53轴在神经元细胞死亡中发挥调节作用[17]。在LPS诱导的肺损伤中,miR-149表达下调,lncRNA MALAT1通过miR-149/MyD88轴促进急性肺损伤的炎性反应[18]。与前人研究结果一致,在MIA诱导的软骨细胞损伤中,miR-149-5p表达水平降低,过表达miR-149-5p降低了细胞凋亡率,提高了Bcl-2表达水平与SOD和CAT活性,降低了Bax和MDA表达水平。提示过表达miR-149-5p可抑制细胞凋亡和氧化应激反应,以减轻MIA诱导的软骨细胞损伤。且下调miR-149-5p表达逆转了抑制lncRNA SNHG14表达对软骨细胞凋亡和氧化应激反应的影响,提高了细胞凋亡率,降低了Bcl-2表达水平与SOD和CAT活性,提高了Bax和MDA表达水平。提示lncRNA SNHG14可能通过调控miR-149-5p表达影响MIA诱导的软骨细胞凋亡和氧化应激反应。
综上所述,lncRNA SNHG14在MIA诱导的软骨细胞中上调,抑制lncRNA SNHG14表达通过靶向上调miR-149-5p表达调控MIA诱导的软骨细胞凋亡和氧化应激反应。这意味着lncRNA SNHG14可能成为治疗OA的新靶点,但仅限于体外实验,lncRNA SNHG14在体内的作用以及调控机制还有待进一步研究。

