严重主动脉瓣狭窄患者主动脉瓣流量、狭窄程度与全身耗氧量的相关性研究
张颖 王博静 王敏 李泽含 曲室先
主动脉瓣狭窄是发达国家常见的瓣膜性心脏病,随着我国居民生活水平的不断提高,其发病率在我国逐年提高[1-3]。它通常是逐渐进行的退行性疾病,导致主动脉瓣叶的钙化进而导致从左心室到主动脉的血流阻塞,导致左心室后负荷增加[4-6]。主动脉瓣狭窄作为最常见的瓣膜性心脏病,在临床检查期间通常利用跨瓣压力梯度(cross-valve pressure gradient,TPG)和主动脉瓣流量(aortic valve flow,AVSV)来评估其严重性,需要心脏导管插入术或通过多普勒超声心动图确定[7]。平均主动脉压梯度(MTPG)从未被证实可以作为严重主动脉瓣狭窄患者死亡的预测因素。有学者持续性跟踪主动脉瓣狭窄患者过程中注意到,全身耗氧量随着病情加重持续下降,但仍然不清楚全身耗氧量如何受脉瓣狭窄影响,是否可以将全身耗氧量列为评估主动脉瓣狭窄疾病的一个指标[8,9]。本研究通过考察严重主动脉瓣狭窄(severe aortic stenosis,SAS)患者的AVSV、主动脉压力梯度(aortic pressure gradient,TPG)与全身耗氧量(body oxygen consumption,SOC)的相关性,探讨SOC是否可以作为一种无损伤检测严重主动脉狭窄病情的指标。
1 资料与方法
1.1 一般资料 选择2015年12月至2018年11月,年龄≥18岁的患者被诊断为≥轻度AS[主动脉瓣钙化,受限制的收缩运动和主动脉瓣口面积(AVA)<2 cm2]和LVEF≥50%的患者被前瞻性鉴定并包含在电子数据库中。根据其基线压力梯度TPG将患者回顾性分为3组:第1组为TPG≥40 mm Hg的严重主动脉瓣狭窄患者(n=100);第2组为TPG<40 mm Hg的主动脉瓣狭窄患者(n=100);第3组为对照组(n=100),无主动脉瓣狭窄者)。入选标准:(1)性别不拘;(2)年龄40~70岁;(3)AVA≤1 cm2和(或)AVA标准化为体表面积(BSA)≤0.6 cm2/m2和TPG≥40 mm Hg。排除标准:(1)患有轻度主动脉和(或)二尖瓣关闭不全的患者;(2)患有人工瓣膜,先天性心脏病(二尖瓣主动脉瓣除外),瓣膜上或瓣下AS,或动态LV流出道梗阻的患者。本研究获得医院医学伦理委员会批准,且受试者均已签署书面知情同意书。
1.2 方法
1.2.1 主动脉瓣流量测定方法:患者均使用加拿大超声医疗技术有限公司生产的彩色多普勒超声诊断仪器进行全面的多普勒超声心动图研究[10-12]。在胸骨旁长轴视图中测量主动脉瓣流出道,同时放大主动脉瓣。在顶端5室视图中记录主动脉瓣流出道速度时间积分(TVI,m)。在几个声学窗口(顶端5室,右侧胸骨旁,胸骨上和上腹部视图)中系统地测量主动脉管腔横截面积(CSA,cm2),并且考虑最高记录值。使用连续性方程ASVA(cm3)=主动脉管腔横截面积(CSA)×主动脉瓣流出道速度时间积分(TVI),计算主动脉瓣流量ASVA。脉冲的对齐并且连续波多普勒被优化为与流动平行。当患者处于窦性心律时,对所有测量值平均3个心动周期。对于心房颤动患者,平均5个心动周期。使用舒张末期和收缩末期的前沿方法,通过二维引导的M模式从胸骨旁长轴视图评估主动脉管腔横截面积(CSA)。使用Simpson的双平面法计算CSA。见图1。

图1 彩色多普勒超声诊断的多普勒超声心动图
1.2.2 全身耗氧量测定方法:患者均使用美国GE通用电气医疗系统集团生产的Datex-Ohmeda呼出气体监测仪器进行耗氧量测定研究。Datex-Ohmeda气体监测仪连续监测各组患者呼气末CO2浓度、每分钟呼出气体量(Ve)和吸呼氧浓度。计算吸呼氧浓度差(Fi-eO2),耗氧量(ml/min)=每分呼出气量Ve(ml/min)×吸呼氧浓度差(Fi-eO2)[13,14]。

2 结果
2.1 患者一般情况 300例患者中,男154例,女146例,平均年龄(63.8±7.2)岁。3组患者一般情况(年龄、男性比例、体表面积、主动脉瓣面积、射血分数、左心房容积指数及收缩期肺动脉压)比较,年龄、男性比例、体表面积、左心房容积指数和收缩期肺动脉压差异无统计学意义(P>0.05);与对照组比较,主动脉瓣狭窄组和严重主动脉瓣狭窄组的主动脉瓣面积差异有统计学意义(P<0.05);与对照组比较,严重主动脉瓣狭窄组射血分数差异有统计学意义(P<0.05)。根据经主动脉压力梯度(TPG)调整严重主动脉瓣狭窄人群(n=300)的全因死亡率曲线。见表1,图2。
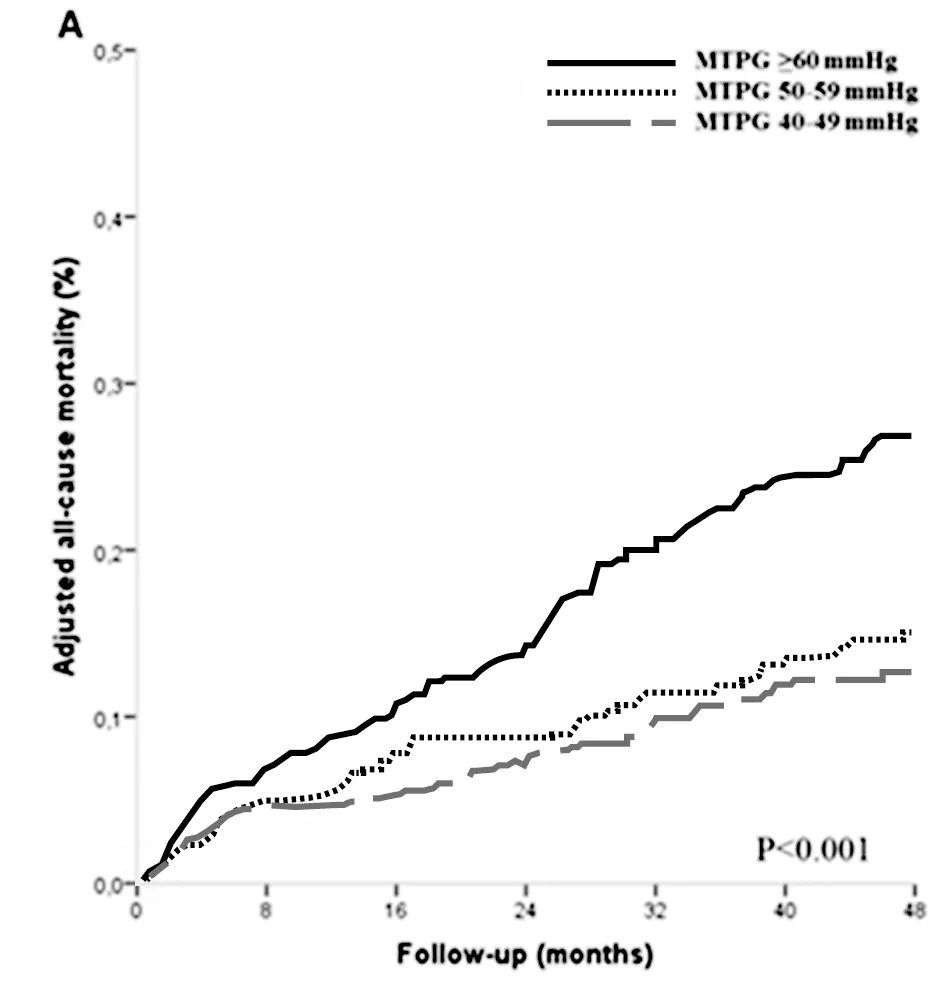
图2 根据经主动脉压力梯度(TPG)调整严重主动脉瓣狭窄人群(n=300)的全因死亡率曲线 分为3组(虚线:TPG 40~50 mm Hg;大虚线:TPG 50~59 mm Hg;实线:严重主动脉瓣狭窄)

表1 3组患者一般资料比较 n=100
2.2 3组患者主动脉流量比较 对照组的主动脉管腔横截面积(CSA)和主动脉瓣流出道速度时间积分(TVI)与主动脉瓣狭窄组比较,差异无统计学意义(P>0.05);对照组与严重主动脉瓣狭窄组比较差异有统计学意义(P<0.05)。见表2。
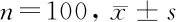
表2 3组患者主动脉瓣流量比较
2.3 3组患者全身耗氧量比较 与对照组比较,主动脉瓣狭窄组和严重主动脉瓣狭窄组呼气末CO2浓度、每分钟呼出气体量差异无统计学意义(P>0.05);主动脉瓣狭窄组吸呼氧浓度与对照组比较,差异无统计学意义(P>0.05);严重主动脉瓣狭窄组吸呼氧浓度与对照组比较差异有统计学意义(P<0.05);主动脉瓣狭窄组和严重主动脉瓣狭窄组吸呼氧浓度差与对照组比较差异有统计学意义(P<0.05)。见表3。
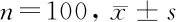
表 3 3组患者全身耗氧量比较
2.4 严重主动脉瓣狭窄患者的主动脉瓣流量、主动脉瓣狭窄程度与全身耗氧量的相关性 严重主动脉瓣狭窄患者的主动脉瓣狭窄程度与全身耗氧量呈负相关(P<0.05);严重主动脉瓣狭窄患者的主动脉瓣狭窄程度与主动脉瓣流量呈正相关(P<0.05);严重主动脉瓣狭窄患者的主动脉瓣流量与全身耗氧量呈负相关(P<0.05)。见表4~6。
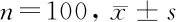
表4 3组全身耗氧量与主动脉瓣狭窄程度的相关性
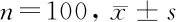
表5 3组患者主动脉瓣流量与主动脉瓣狭窄程度的相关性
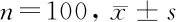
表6 3组患者全身耗氧量与主动脉瓣流量的相关性
3 讨论
严重主动脉狭窄由于“人口老龄化”的原因,已成为一种日益普遍瓣膜疾病。最常见的原因包括退行性钙化、先天性和风湿病。欧洲心脏瓣膜病研究显示,主动脉狭窄是年龄>65岁的患者中最常见的瓣膜疾病[15,16]。在美国一项针对1 797例>60岁患者的研究中,AS是仅次于二尖瓣返流的第二大最常见的瓣膜疾病,男性的AS患病率更高[14]。因为作为老年人越来越成为一种疾病,很可能伴有其他并发症包括心脏(冠状动脉疾病、收缩期和舒张功能不全的各种病因,心律失常如心房纤颤和传导疾病),以及进行非心脏肾脏功能障碍等疾病、肺部疾病。
非侵入性诊断和新型微创治疗模式的巨大进步促进了医学工作者对AS诊断治疗的理解。超声心动图是主动脉瓣狭窄诊断和评估的主要工具。因为临床决策基于超声心动图评估主动脉瓣狭窄的严重程度,因此采用一些标准和规范来保持超声心动图实验室的准确性和一致性是至关重要的。主动脉瓣狭窄的最常见的病因是三叶瓣瓣膜钙化狭窄、具有重叠钙化的二叶式主动脉瓣以及风湿性瓣膜病。由于先天性单瓣主动脉瓣狭窄在成年人中罕见,通常具有明显的异常特征,包括严重的增厚和钙化,并伴有显著的主动脉瓣反流(AR)。
TPG是严重AS患者的有力预后因素[12]。超声心动图测量TPG被认为比SVA更稳健,以评估在正常跨瓣血流存在时AS的严重程度。先前的研究专注于通过主动脉瓣Vmax作为严重程度的标志和结果的预测因子[17,18]。美国心脏病学会/美国心脏协会指南定义了“非常严重的主动脉瓣狭窄”,Vmax≥5 m/s和(或)TPG≥40 mm Hg。欧洲心脏病学会指南使用不同的Vmax截止值。严重主动脉瓣狭窄的预测能力在调整已知为主要预后因素的因素后保持不变,如年龄、性别、高血压、冠状动脉疾病、心房颤动和主动脉瓣手术[13]。
全身耗氧量能够较传统的TPG和AVSA值更迅敏地反映严重主动脉瓣狭窄的状况。本研究发现。结果发现:严重主动脉瓣狭窄患者的压力梯度与全身耗氧量呈负相关;严重主动脉瓣狭窄患者的主动脉瓣流量与全身耗氧量呈负相关;严重主动脉瓣狭窄患者的压力梯度与主动脉瓣流量呈正相关。Reynolds等[14,15]报道主动脉瓣狭窄患者中,低全身耗氧量组的随访死亡率高于正常全身耗氧量组,其数值减小代表了左心室收缩功能的下降。Ussia等[16,17]认为低全身耗氧量主动脉瓣狭窄患者在随访期二尖瓣环的位移降低,提示在随访期左心室收缩功能减低,低全身耗氧量主动脉瓣狭窄患者由于瓣膜、血管和心肌病变的综合变化及心肌收缩力的降低,导致了一个低压力阶差的病程改变,与高压力阶差、正常搏出量患者比较预后较差。Reynolds等[18]将主动脉瓣狭窄患者分为临床有症状组和无症状组,研究发现低全身耗氧量患者皆为有症状组,且其左室收缩功能受损,心肌的扭转减小,在应变和应变率降低的节段,心肌纤维化较明显。因此,对主动脉瓣狭窄患者常规测量全身耗氧量,弥补了常规超声仅以压力阶差或瓣口面积来评估主动脉瓣狭窄的局限性[19]。所以除了主动脉瓣流量和压力梯度外,还可将全身耗氧量作为对主动脉瓣狭窄患者的评估参数。
综上所述,全身耗氧量与严重主动脉瓣狭窄患者的主动脉瓣流量和压力梯度具良好的相关性,全身耗氧量评估可以成为严重主动脉瓣狭窄患者治疗决策过程的一个重要因素。

