potA 基因缺失对猪链球菌2 型生物学特性及致病性影响的研究
刘万全,郑立红*,刘 丹,梅庆步,张明龙,张春艳
(1.齐齐哈尔医学院基础医学院,黑龙江 齐齐哈尔 161006;2.赤峰学院基础医学院,内蒙古 赤峰 024000)
猪链球菌(Streptococcus suis)是在全世界范围内广泛传播的革兰氏阳性人兽共患病原菌。其中猪链球菌2 型(SS2)致病性最强,在全世界流行最广[1],能够引起猪和人的致命性感染,不仅给养猪业造成重大的经济损失,而且严重威胁人类健康。SS2能够致人的败血症、脑膜炎、关节炎、中毒性休克综合征和严重的后遗症甚至死亡,包括中国在内的东南亚是人、猪感染的重灾区。1998年和2005年该菌的感染在我国的两次大暴发造成了52人的感染死亡,成为世界高度关注的人兽共患病原菌之一[2-3]。
细菌中的多胺参与许多生理过程,如微生物的致癌作用、细菌素的产生、逃逸吞噬溶酶体的吞噬作用、生物被膜的形成和细菌的毒性作用等。在肺炎链球菌和大肠杆菌等病原菌中,多胺的合成和转运对病原菌的环境适应性和致病性均起重要作用,其相关基因的缺失均能够有效影响该病原菌对小鼠的致病能力[4-5]。多胺转运系统PotABCD 广泛存在于各类细菌中,其中PotD 是外源多胺的胞外结合蛋白,PotA 是与膜相关的胞内ATP 酶。而其他蛋白质包括:PotB 和PotC 构成了多胺转运的跨膜通道。PotD 结合胞外多胺会促使其构象改变,形成更加紧密的蛋白结构,进而诱发PotBC 通道的构象改变。PotA 在水解ATP 后能够将外源多胺摄入到胞内。
本研究室前期研究证实,SS2 和其他革兰氏阳性菌一样,只含有PotABCD 一个多胺转运系统,并证明了SS2 转运多胺的偏好依次为亚精胺、精胺和腐胺[6]。PotA 蛋白具有ATP 酶水解活性,能够水解ATP 为外源多胺的胞内转运提供能量。本研究利用同源重组方法构建SS2potA基因缺失突变株,通过表型观察、生长速率测定、SS2 感染后小鼠存活率及组织定植和粘附侵入细胞等试验进一步探究potA基因缺失对SS2 致病能力的影响,旨在为阐明SS2的生长和致病性的调控机制及抗该菌感染药物靶点的探寻奠定基础。
1 材料与方法
1.1 主要实验材料SS2 SC-19 株于2005 年分离自SS2 感染的病猪;大肠杆菌DH5α 购自Trans 公司;大肠杆菌-猪链球菌穿梭质粒pSET4S 由日本学者Daisuke Takamatsu 惠赠,用于SS2 菌株基因的定点敲除[7-8];4周龄~6周龄雌性昆明SPF小鼠,体重18(±2)g,购自武汉生物制品所;TSA 和TSB 培养基购自Difco公司;新生牛血清购自杭州四季青有限公司;壮观霉素(Spc)购自Biosharp 公司;鼠源PotA 蛋白多克隆抗体为本研究室自制;羊抗鼠IgG(H+L)购自Abcam公司;RNA 提取试剂RNAiso plus、高保真PCR 聚合酶PrimeStar、限制性内切酶、T4 DNA 连接酶及buffer 均购自TaKaRa 公司;细菌基因组提取试剂盒、质粒小量提取试剂盒与PCR 及酶切产物纯化试剂盒均购自北京全式金生物技术有限公司;细菌总蛋白提取试剂盒购自生工生物工程(上海)股份有限公司;HiScriptTMReverse Transcriptase 试剂盒和AceQTMqRCR 试剂盒购自Vazyme 公司。
1.2 引物的设计与合成本实验所有引物均参照SC-19 菌株的基因组(2005 年分离自四川省资阳市,NZ_CP020863.1)设计,包括:pSET4S-P 重组质粒构建引物、potA基因鉴定引物和qRT-PCR 检测引物(表1),均由上海生工生物工程技术服务有限公司合成。

表1 本研究所用的引物Table Primers used in this study
1.3 potA基因缺失菌株的构建与鉴定以提取的SC-19 菌株的基因组为模板,采用引物PotAup-F/R和PotAdown-F/R 分别经PCR 扩增potA基因的上下游同源臂,以SphI 和SalI 双酶切上游同源臂的PCR 产物,以SmaI 和EcoR I 双酶切下游同源臂的PCR 产物后依次克隆至pSET4S(pSET4S 为37 ℃温度敏感型自杀质粒)载体中构建重组质粒,经测序鉴定正确后命名为pSET4S-P。将pSET4S-P 电转入SC-19 菌株,3 h 后涂布于含Spc 的TSA 琼脂平板,28 ℃培养12 h,挑取单菌落于含Spc 的TSB 液体培养基,于28 ℃扩大培养12 h,将培养物(1∶100)转接至不含Spc的TSB 液体培养基,37 ℃继续培养6 h 后,涂布于不含Spc 的TSA 琼脂平板,37 ℃培养至长出单菌落并挑取单菌落分别涂布于含Spc 和不含Spc 的TSA 琼脂平板,阳性菌株不能在含Spc的TSA琼脂平板上生长。
分别提取SC-19和上述阳性菌株的基因组,利用potA基因检测引物PA-F/PA-R 经PCR 鉴定,以SC-19基因组作为阳性对照,ddH2O 为阴性对照;分别提取SC-19和阳性菌株的总蛋白,以鼠源PotA 蛋白多克隆抗体(1∶1 000)作为一抗,羊抗鼠IgG(H+L)(1∶10 000)作为二抗,经western blot 鉴定,上述鉴定结果正确的菌株即为potA基因缺失菌株,命名为ΔpotA。
1.4 potA基因缺失对SS2 形态影响的观察分别挑取SC-19 和ΔpotA的单菌落于TSB 培养基中过夜培养至OD600nm约为0.5~0.6 时,取培养物经革兰氏染色后,使用100 倍光学显微镜观察。另外取培养物经戊二醛固定、锇酸固定、丙酮脱水、树脂和丙酮混合渗透、包埋和聚合、制备超薄切片和染色后,使用透射电镜观察。同时取培养物经涂片、固定,再经30%、50%、70%、85%、95%和100%乙醇依次脱水,真空冷冻干燥,粘附于呈物台,离子喷金后,使用扫描电镜观察。
1.5 potA基因缺失对SS2 生长速率影响的检测分别挑取SC-19 和ΔpotA单菌落于TSB 液体培养基中过夜培养,每隔1 h 测定菌液OD600nm值,连续测定10 h;同时从1 h 开始,每隔2 h 将SC-19 和ΔpotA菌液分别做10 倍倍比稀释,取106、107和108稀释的菌液分别涂布TSA 琼脂平板,每个稀释度涂布3 个平板,12 h 后菌落计数,根据OD600nm的测定和平板的计数结果绘制SC-19 和ΔpotA的生长曲线,分析potA基因缺失对SS2 生长速率的影响。
1.6 potA基因缺失对SS2 致病性的影响
1.6.1 感染SC-19 和ΔpotA菌株后小鼠存活率的测定 将50 只雌性昆明系SPF 小鼠随机分成5 组,每组10 只;以之前已经测定的SC-19 对小鼠的半数致死量(LD50)为1.5×109cfu/只为参考[9],选择1×109cfu/只和7×108cfu/只两个剂量组。1~2 组小鼠分别经腹腔注射接种1 mL 浓度为1×109cfu/mL 的SC-19 和ΔpotA;3~4 组小鼠分别经腹腔注射接种1 mL 浓度为7×108cfu/mL 的SC-19 和ΔpotA;5 组小鼠经腹腔注射接种1 mL 生理盐水;在一周的观察期内记录小鼠的死亡情况。
1.6.2 感染SC-19 和ΔpotA菌株后小鼠血液和组织中载菌量的测定 将48 只雌性SPF 昆明小鼠随机分成3 组,第1 组和第2 组各20 只,第3 组8 只;第1~2 组小鼠分别接种1 mL 浓度为7×107cfu/mL 的SC-19和ΔpotA,第3 组小鼠接种1 mL 生理盐水作为阴性对照;在接种后的0.5 d、1 d、3 d 和5 d 各取5 只小鼠与阴性对照组2 只小鼠分别采血,并迫杀取其脑、肺和脾组织称重并经匀浆后10 倍倍比稀释,血液样品直接10 倍倍比稀释,涂布于无抗的TSA 琼脂平板。37 ℃培养过夜,经平板菌落计数后,计算小鼠各组织和血液的载菌量。
1.7 potA基因缺失对SS2 粘附与侵入细胞影响的检测将HEp-2 细胞铺于6 孔细胞培养板中,待长成单层后,以MOI 0.01 加入培养至对数生长期的SC-19 和ΔpotA,37 ℃孵育2 h。吸出培养液,PBS洗去游离细菌,用无菌双蒸水裂解细胞后10 倍倍比稀释并涂布于TSA 琼脂平板,37 ℃培养过夜后经菌落计数,该计数即为粘附与侵入细胞的细菌总数;侵入细胞的细菌数测定:PBS 洗涤HEp-2 细胞后,加入含100 μg/mL 氨苄青霉素的DMEM 培养液处理细胞2 h;用无菌双蒸水裂解细胞后10 倍倍比稀释并涂布于TSA 琼脂平板;37 ℃培养过夜后经菌落计数,该计数即为侵入细胞的细菌数目。其中,粘附细胞的细菌数目=粘附与侵入细胞的细菌总数-侵入细胞的细菌数。根据计算结果分析potA基因缺失对SS2 粘附与侵入细胞能力的影响。
1.8 potA基因缺失对SS2 粘附侵入相关基因转录水平影响的检测利用TRIzol 法分别提取对数生长期(OD600nm≈0.6)的SC-19 和ΔpotA菌株总RNA,反转录为cDNA。根据表1 中所列的引物,利用qRT-PCR检测与SS2 粘附及侵入细胞相关基因(srtA、aupA、sao、fbps、gapdH、eno、sadP、ccpA和dltA)在SC-19和ΔpotA菌株中转录水平的差异[10]。扩增程序为95 ℃30 s;56 ℃30 s;72 ℃35 s。每个样品重复3次,以16S rRNA 作为内参基因,根据2-ΔΔCt计算结果,分析potA基因缺失对SS2 粘附侵入相关基因的转录水平影响。
2 结 果
2.1 ΔpotA菌株的PCR 及western blot 鉴定结果基因水平鉴定:分别以SC-19 和ΔpotA菌株的基因组为模板,ddH2O 为阴性对照,利用检测引物PA-F/R,经PCR鉴定,结果显示,以SC-19基因组为模板扩增出1.1 kb左右条带,与potA基因大小一致,以ΔpotA基因组为模板则未扩增出该条带;Western blot 鉴定结果显示,SC-19 菌株在50 ku 处有目的条带,与PotA蛋白大小相符,ΔpotA菌株则无该条带(图1)。上述结果表明,ΔpotA菌株正确构建。

图1 ΔpotA突变株的构建与鉴定结果Fig.1 Construction and identification of ΔpotA mutant
2.2 potA基因缺失对SS2 形态影响的观察结果利用革兰氏染色、扫描电镜和透射电镜分别对SC-19 和ΔpotA菌株进行形态学观察,结果显示,ΔpotA菌株的链明显长于SC-19 菌株(图2A~图2C)。随机选取革兰氏染色视野中的SC-19 和ΔpotA菌株分别对菌链中的细菌个数进行统计分析,结果显示,SC-19 菌株60%以上的菌链由1~3 个细菌构成,而在ΔpotA菌株中由1~3 个细菌构成的菌链不足40%,二者差异极显著(P<0.001),而在4~6 个和8 个以上细菌构成的菌链中,ΔpotA菌株均极显著比SC-19 菌株占比多(P<0.001)(图2D)。表明potA基因的缺失严重影响了SS2 菌链的有效形成。
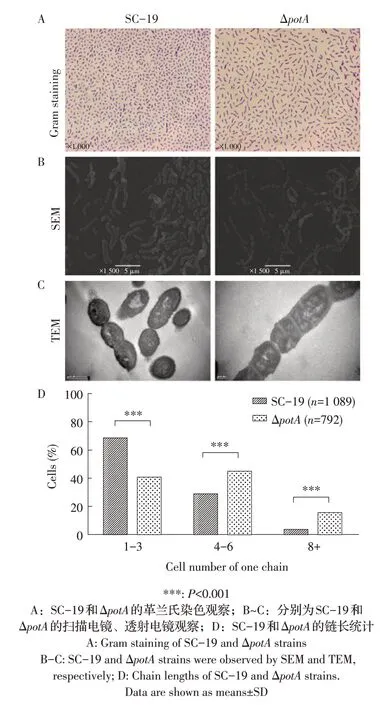
图2 SC-19和ΔpotA的形态观察及链长统计Fig.2 Morphology and statistics of length chain of SC-19 and ΔpotA strains
2.3 potA基因缺失对SS2 生长速率影响的检测结果通过培养并测定SC-19 和ΔpotA菌株连续10 h 的OD600nm值,同时,每间隔2 h 对SC-19 和ΔpotA菌株进行TSA 琼脂平板计数,并绘制生长曲线和柱状图,结果显示,ΔpotA菌株的生长速率慢于SC-19菌株,在3 h、5 h、7 h 和9 h 各时间点,ΔpotA菌株的菌落数均少于SC-19 菌株(图3)。表明potA基因的缺失降低了SS2的生长速率。

图3 SC-19和ΔpotA的生长曲线测定及平板计数统计Fig.3 Growth curves and plate count of SC-19 and ΔpotA strains
2.4 potA基因缺失对SS2 致病性影响的检测结果分别将7×108cfu/只和1×109cfu/只两个剂量的SC-19或ΔpotA菌株经腹腔注射接种小鼠,观察7 d内小鼠的感染死亡情况。结果显示,在7×108cfu/只剂量组中,感染SC-19菌株的小鼠在感染后第1 d死亡4只,之后再无死亡,小鼠存活率为60%,而感染ΔpotA菌株的小鼠在感染后第1 d死亡4只,第2 d死亡1只,第3 d死亡1 只,之后再无死亡,小鼠存活率为40%(图4A);在1×109cfu/只剂量组中,感染SC-19菌株的小鼠在感染后第1 d 死亡2 只,第2 d 死亡2 只,之后再无死亡,小鼠存活率为60%,而感染ΔpotA菌株的小鼠在感染后第1 d 死亡6 只,第2 d 死亡2 只,第3 d 死亡1只,之后再无死亡,小鼠存活率为10%(图4B)。表明potA基因的缺失导致SS2对小鼠的致病性增强。
将7×107cfu/只的SC-19 和ΔpotA菌株分别经腹腔接种小鼠,分别在接种后的0.5 d、1 d、3 d和5 d,利用TSA 琼脂平板计数对小鼠的血液、脑、肺和脾组织中的载菌量进行比较分析。结果显示,在接种后的第1 d 和第2 d,ΔpotA菌株在小鼠血液中的载菌量显著低于SC-19 菌株(P<0.05),之后二者的载菌量再无显著差异(图4C),而ΔpotA和SC-19 菌株在小鼠脑、脾和肺组织中的载菌量始终无显著差异(P>0.05)(图4D~图4F)。表明potA基因的缺失不影响SS2 在小鼠各组织中的定植。

图4 感染SC-19和ΔpotA后小鼠的存活率、血液和组织中载菌量的检测结果Fig.4 Survival curves of mice and bacterial load in blood and organs after infection with strain SC-19 and ΔpotA
2.5 potA基因缺失对SS2 粘附与侵入影响的检测结果将SC-19 和ΔpotA菌株分别与HEp-2 细胞共培养,利用TSA 琼脂平板计数法分别比较SC-19 和ΔpotA菌株对HEp-2 细胞的粘附和侵入数量,结果显示,和SC-19 菌株相比,ΔpotA菌株对HEp-2 细胞的粘附(P<0.01)与侵入(P<0.001)数量均极显著升高(图5A、图5B)。表明potA基因的缺失增强了SS2 粘附与侵入细胞的能力。
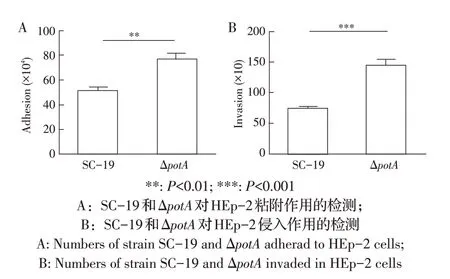
图5 SC-19和ΔpotA对HEp-2细胞粘附及侵入的检测结果Fig.5 Adhesion and invasion ability to HEp-2 cells of strain SC-19 and ΔpotA
2.6 potA基因缺失后SS2 粘附及侵入相关基因的转录水平影响分别以SC-19 和ΔpotA菌株的cDNA模板,利用qRT-PCR 检测SS2 粘附及侵入相关基因srtA、aupA、sao、fbps、gapdH、eno、sadP、ccpA和dltA的转录水平,结果显示,除dltA基因的转录无显著上调外,其他基因的转录均不同程度的上调,其中srtA、fbps和sadP基因的转录水平均极显著上调(Fold change>2,P<0.001)(图6)。表明potA基因的缺失促进了SS2 粘附侵入相关基因的转录。
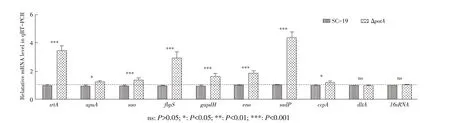
图6 SC-19和ΔpotA中粘附及侵入相关基因转录水平的检测结果Fig.6 Detection of transcriptional level of adhesion and invasion related genes in strain SC-19 and ΔpotA
以上结果表明,ΔpotA菌株致病性的增强,是由于potA基因缺失后,促进了SS2 粘附侵入相关基因的转录,从而增强了ΔpotA菌株对宿主细胞的粘附及侵入能力,但与ΔpotA菌株对宿主组织的定植能力无关。
3 讨 论
多胺是病原菌内重要的多聚阳离子小分子,参与病原菌的许多生理学过程,对病原菌的正常生长和分裂有着至关重要的作用[4]。病原菌内的多胺含量受多重机制的严格调控,主要是通过病原菌自身的多胺合成途径和转运途径来调节[11]。近年来,随着对多胺代谢研究的不断深入,多胺合成和转运相关基因参与病原菌生长、生物被膜形成、荚膜形成、肽聚糖合成和致病性等方面的研究也均有报道。然而,大部分研究仅是针对于大肠杆菌、金黄色葡萄球菌和肺炎链球菌等部分病原菌,但多胺代谢是如何调控这些病原菌生长和致病性的作用机制尚不明确。因此对多胺代谢及相关基因功能的研究仍任重道远。
基于多胺转运系统PotABCD 是SS 中唯一的多胺转运子[6],本研究利用同源重组方法构建了potA基因的缺失突变株ΔpotA,以进一步探究potA基因的功能。然而在构建回补菌株时,无论是potA基因自身的启动子还是已被证实的msmK、gidA和stk基因的启动子均无法驱动potA基因的正常表达,因此本研究未构建potA基因的回补菌株。通过对比分析ΔpotA与SC-19 菌株的形态和生长速率发现,potA基因的缺失影响了SS2 的正常生长(包括生长速率和链长)。有研究结果显示,多胺会影响链球菌的生长和其链的长度[12]。在体外培养时,肺炎链球菌必须依赖胆碱或腐胺才能生长,而肺炎链球菌在腐胺存在的条件下,其链会显著增长[13]。本研究中小鼠感染SC-19 和ΔpotA菌株后,小鼠的存活率结果证明potA基因的缺失增强了SS2 对小鼠的致病力。同样肺炎链球菌中potABCD的缺失、potD基因的缺失或者多胺合成基因cad或speE的缺失也能够影响病原菌对小鼠的致死能力[12-16]。本研究小鼠各组织中SC-19 和ΔpotA菌株的载菌量均无明显差异,表明potA基因缺失所致SS2 致病能力的增强与SS2 在小鼠组织中的载菌量无关。在肺炎链球菌中,无论缺失potABCD还是缺失多胺合成基因cad或speE,该菌在小鼠的鼻咽和肺组织中的载菌量均显著降低[16],造成二者结果差异的原因目前尚不清楚。此外,用PotD蛋白免疫小鼠后能够抑制肺炎链球菌在小鼠体内的定植和对小鼠的致死率[14-15],同时,很多与生长、复制和毒力相关蛋白的表达均下调,推测可能与病原菌中多胺含量的降低有关,但具体致病机制尚不明确[14]。进一步探究SS2 对HEp-2 细胞的粘附及侵入能力发现,缺失potA基因后SS2 对HEp-2 细胞的粘附及侵入能力均显著提高,qRT-PCR 结果也显示,与SS2 粘附及侵入相关基因(srtA、fbps和sadP)的转录水平均极显著上调。其中,srtA编码的细胞壁锚定蛋白SrtA、sadP编码的粘附素SadP 和fbps编码的纤连蛋白结合蛋白FBPS 均是SS2 中已经证实的重要粘附因子,以上蛋白的表达对SS2 的粘附及侵入细胞有重要的促进作用[18-20],多胺转运子potABCD通过调控毒力基因影响病原菌致病性的研究在大肠杆菌也有过报道,PotD 能够刺激大肠杆菌生物被膜基因的表达,促进其生物被膜的形成,从而提高大肠杆菌的环境适应性和致病能力[21]。
综上所述,potA基因的缺失致SS2 中srtA、fbps和sadP等粘附因子编码基因转录水平的上调,提高了SS2 对宿主细胞的粘附及侵入能力,从而增强了SS2 的致病能力,且与SS2 的生长速率和组织定植能力无关。本研究为进一步探究SSpotA基因的功能及致病机制提供了参考数据。

